Définition de la pharmacocinétique et buts
La pharmacocinétique a pour but d’étudier le devenir d’un médicament dans l’organisme.
La détermination des paramètres pharmacocinétiques d’un médicament apporte les informations qui permettent de choisir les voies d’administration et d’adapter les posologies pour son utilisation future.
On peut distinguer schématiquement 4 étapes dans la pharmacocinétique d’un médicament :
— son absorption
— sa diffusion dans l’organisme
— son métabolisme
— son élimination de l’organisme
Absorption d’un médicament
L’absorption est le processus par lequel le médicament inchangé passe de son site d’administration à la circulation générale (site de mesure).
La voie d’administration du médicament influence cette première phase : la voie intra-veineuse est la voie de référence puisque par définition, à la différence des autres voies (orale par exemple) toute la dose administrée atteint la circulation générale

Modalités d’absorption
Le médicament doit passer une barrière qui le sépare de la circulation générale (l’épithélium digestif lors d’une administration orale par exemple).
Parmi les différents mécanismes, 2 ont importants :
- Diffusion passive : pas de consommation d’énergie/non spécifique/ pas de compétition/ pas de saturation ⇒ Loi de Fick++
- Transport actif : contre un gradient/ saturable/ spécifique/ compétition++/ énergie++
L’absorption est influencée par :
- Les caractéristiques du médicament :
- Physico-chimiques : pKa (la forme non ionisée d’un médicament est absorbée plus facilement)
- Hydro/lipo solubilité
- Taille et morphologie de la molécule
- La forme galénique (sirop, comprimé, gélule…) qui détermine la vitesse de dissolution du médicament…
- Les caractéristiques liés à l’individu :
- Le pH digestif
- La vitesse de vidange gastrique et la mobilité intestinale
- L’alimentation : repas riche en graisses…
- La prise associée de médicament (pansements digestifs, modificateurs de vidange gastrique)
- L’âge
- Les pathologies associées : digestives, cardiaques (diminution débit…)
Evaluation de l’absorption : la biodisponibilité
La biodisponibilité se définit comme étant la fraction de la dose de médicament administré qui atteint la circulation générale et la vitesse à laquelle elle l’atteint.
L’absorption digestive proprement dite, c’est-à-dire la quantité de principe actif atteignant la circulation systémique est difficile à mesurer puisque la circulation porte est d’accès peu aisé.
L’approche de cette quantité disponible au niveau systémique se fait donc de manière indirecte à partir de la quantité de médicament dans le plasma prélevé au niveau périphérique, c’est à dire après le foie.
La quantité de médicament qui atteint la circulation générale (ou systémique) est fonction de la quantité absorbée par l’épithélium digestif (et donc de la dose administrée) mais également, d’autres processus d’élimination pré-systémique :
— dégradation dans la lumière intestinale,
— métabolisme au niveau des entérocytes (cf métabolisme),
— captage hépatique important au premier passage. Lorsque le médicament a une forte affinité pour l’hépatocyte et les enzymes hépatiques, une fraction de la dose absorbée est captée
lors du premier passage, c’est à dire avant même d’atteindre la circulation générale. La quantité de médicament retrouvée dans la circulation systémique est alors diminuée. C’est l’effet de premier passage hépatique.

Le facteur quantitatif (F) de la biodisponibilité ne peut être apprécié que par rapport à une forme de référence. On distingue ainsi :
— La biodisponibilité absolue : une forme extra-vasculaire est comparée à la forme de référence qui est le médicament administré par voie intraveineuse puisque par définition
toute la dose atteint la circulation générale.
— La biodisponibilité relative où la forme de référence est administrée par une autre voie que la voie intra-veineuse. Cette forme de référence peut être administrée par la
même voie que la forme à tester, mais il s’agit soit d’une autre forme galénique (solution aqueuse, suspension..) soit d’une autre formulation d’une forme commercialisée
depuis longtemps (cas des génériques).
En général la quantification du facteur (F) de biodisponibilité s’effectue par comparaison des surfaces sous la courbe des concentrations en fonction du temps (SSC) après administration de chaque forme séparément. Celles-ci sont en effet proportionnelles à la quantité de médicament présent dans la circulation générale (cf figure ci-dessous).
F est obtenu selon :
F= SSCpo / SSCiv (biodisponibilité absolue)
SAVOIR INTEPRETER LA BIODISPONIBILITE ABSOLUE :
On voit selon cette équation que si toute la dose administrée par voie orale est absorbée (comme en intra-veineux) la biodisponibilité absolue de ce produit sera 1.
Une biodisponibilité absolue de 0,5 pour un produit signifie que seule la moitié de la quantitéadministrée est retrouvée dans le circulation générale
Ainsi, la dose contenue dans le comprimé ou la gélule ne reflète pas toujours la dose biodisponible F est donc par définition compris entre 0 et 1
Le facteur vitesse est apprécié par la constante de vitesse d’absorption Ka ou plus facilement par la concentration maximale (Cmax) et le temps pour atteindre cette concentration (Tmax).
Au même titre que la quantité absorbée, la vitesse d’absorption d’un médicament est un paramètre significatif pour le délai d’action d’un principe actif.
La vitesse de passage est un paramètre prépondérant pour les médicaments destinés à une action rapide (antalgique par exemple) en prise unique ou de courte durée. Pour les traitements chroniques, où une imprégnation constante est recherchée, la notion de Tmax est moins déterminante.
Exemple : Comparaison des profils pharmacocinétiques de 2 médicaments Médicament A
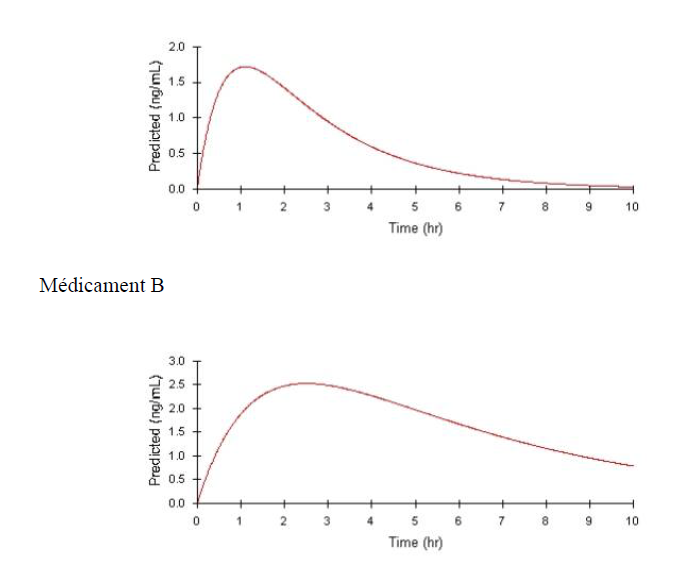
T max : plus rapide pour A que B (1 heure contre 2.5 heures)
C max : plus élevée pour B que A (2.5 ng/ml contre 1.7 ng/ml)
Comprendre l’intérêt de l’étude de la biodisponibilité
- La biodisponibilité absolue est déterminée lors de l’étude d’un nouveau médicament. La détermination de la biodisponibilité relative est utilisée pour comparer des formes galéniques ; elle est obligatoire pour tout changement de formulation(changement d’excipient...) et avant commercialisation d’un médicament « générique ». Un exemple classique permet de comprendre la nécessité de telles études est la survenue en 1972 en Angleterre d’intoxications digitaliques chez plusieurs patients liées une modification dans le procédé de fabrication de la digoxine (Lanoxine®) qui entraîna un doublement de sa biodisponibilité.
- Il ne faut pas assimiler obligatoirement mauvaise biodisponibilité et faible efficacité.
- En effet, la mauvaise biodisponibilité peut provenir d’un captage hépatique au 1er passage. Il est possible que ce captage aboutisse à la transformation du médicament en métabolite pharmacologiquement actif. Dans ces conditions, malgré une faible biodisponibilité, le médicament administré par voie orale pourrait être aussi actif que par voie intraveineuse. C’est le cas du propranolol dont la biodisponibilitéest de 30 % mais qui est métabolisé en 4-OH propranolol dont l’activité bloquante est comparable à celle du propranolol. A l’inverse, le vérapamil (inhibiteur calcique) avec une biodisponibilité de 15 % est, à dose identique, 7 à 10 fois moins actif par voie orale que par voie intraveineuse : ses métabolites sont beaucoup moins actifs que le produit inchangé. Par définition, les pro-drogues (précurseurs de médicament) ont une biodisponibilité nulle ou très faible puisqu’ils ne sont pas retrouvés dans la circulation générale : ils sont rapidement transformés en molécules responsables de l’activité.
- Une faible biodisponibilité ne serait pas gênante en soi si elle était constante pour un même individu et entre les individus. Ceci n’est pas le cas dans la réalité. Plus la biodisponibilité d’un médicament est faible, plus ses variations auront d’effet sur son profil pharmacocinétique. Exemple : la biodisponibilité d’un médicament varie au maximum de 5 % entre les individus. Si sa biodisponibilité est faible (10 % en moyenne par exemple) elle peut alors passer de 10 % à 15 % = 50 % d’augmentation relative. A l’inverse si sa biodisponibilité est forte (90 % en moyenne par exemple), une variation de 5 % aura beaucoup d’effet relatif.
LIAISON AUX PROTEINES PLASMATIQUES
Département de pharmacologie - Université Victor Segalen Bordeaux 2. Tous droits réservés. EDITION 2006
PHASE VASCULAIRE
Après avoir été absorbé, le médicament gagne le sang qui occupe une position centrale dans l'organisme. Le sang est un tissu comme un autre ; ce qui fait son originalité, c'est son rôle de transport et de distribution aux autres tissus.
TRANSPORT
Les médicaments sont transportés dans le sang, soit dissous dans le plasma, soit fixés sur les protéines . Cette fixation intervient dans les possibilités de diffusion du médicament hors du plasma.
Fraction libre
Le plasma étant un milieu aqueux, le médicament pour s'y dissoudre doit être hydrosoluble ; cette fraction dissoute est dite « libre », elle est diffusible, elle peut gagner les tissus.
Seule la fraction plasmatique libre est diffusible, active et éliminable.
Fraction liée aux protéines
Beaucoup de substances chimiques sont plus solubles dans le plasma que dans l'eau pure :
elles se fixent sur les protéines plasmatiques. Cette fixation est d'une importance très variable.
On en distingue deux types :
- les substances ionisées au pH plasmatique, c'est-à-dire les acides faibles de pK compris entre 3,5 et 6, se fixent sur l'albumine avec une affinité relativement forte. Le nombre de sites de fixation est limité. Ils sont communs à ces médicaments et à de nombreuses substances physiologiques (bilirubine, acides gras, hormones).
L'albumine est rarement saturée aux concentrations actives. Dans les rares cas où elle l’est (exemple : sulfamides), l’augmentation de la dose administrée est suivie d’une augmentation disproportionnée de la fraction libre.
On peut observer parfois des phénomènes de compétition et de déplacement entre deux médicaments. Il en résulte une augmentation de la fraction libre d'un (ou de deux) médicament(s), donc de sa fraction diffusible, potentiellement active et/ou éliminable. Dans certains cas, mais dans certains cas seulement, si la fixation initiale est élevée, si l'affinité des tissus d'action est grande par rapport à ceux d'élimination et si la variation de concentration tissulaire est suffisante pour faire varier de manière appréciable les effets pharmacodynamiques, ceci peut entraîner des accidents. Les exemples cliniques sont cependant peu nombreux.
Ce n’est que dans quelques cas particuliers que le déplacement d’un médicament lié à l’albumine plasmatique, entraîne des conséquences cliniques.
Ces cas sont signalés dans les résumés des caractéristiques des produits (RCP) mis à la disposition des praticiens ;
- les substances peu ou pas ionisées au pH plasmatique (bases faibles, acides très faibles, molécules non ionisables) se fixent sur l'albumine avec une faible affinité, mais sur un grand nombre de sites différents des précédents. Elles se fixent également sur les lipoprotéines. Il n'y a pas de phénomènes de compétition.
Les médicaments se fixent sur les protéines par des forces diverses, attraction électrostatique ou forces de VAN DER WALLS. Cette fixation est labile : la fraction liée est en équilibre réversible avec la fraction libre ; le taux de celle-ci conditionne la quantité fixée. La fraction liée n'est pas diffusible, ne peut pas gagner les tissus ni être éliminée ; elle est inactive. Elle constitue une réserve qui sera libérée au fur et à mesure que la fraction libre quittera le plasma.
La durée d'action d'un médicament est en gros proportionnelle à son degré de liaison aux protéines sanguines.
Au terme de cet enseignement,l’étudiant AMAR SP devra être capable de :
- Maitriser la pharmacologie des différents produits utilisés en anesthésie-réanimation.