Introduction
L'histoire des anesthésiques halogénés commence en 1831 avec la découverte du chloroforme (trichlorométhane) simultanément par Soubeiran, Von Liebig et Guthrie. En 1847, Flourens attire l'attention sur ses propriétés anesthésiques et H. Goote l'utilise chez l'homme, bientôt suivi par Simpson et John Snow. Le chlorure d'éthyle, comme le trichloréthylène ne sont plus utilisés en France. Le fluroxène, apparu en 1951, a été le premier agent halogéné fluoré. II a été abandonné en raison de l'importance de ses effets dépresseurs respiratoires et cardiocirculatoires
Généralités
La pratique de l'anesthésie met en jeu des phénomènes mathématiques, physiques et chimiques dont la compréhension oblige à s'assurer que certaines notions de bases sont toujours présentes àl'esprit:
Le systéme métrique International
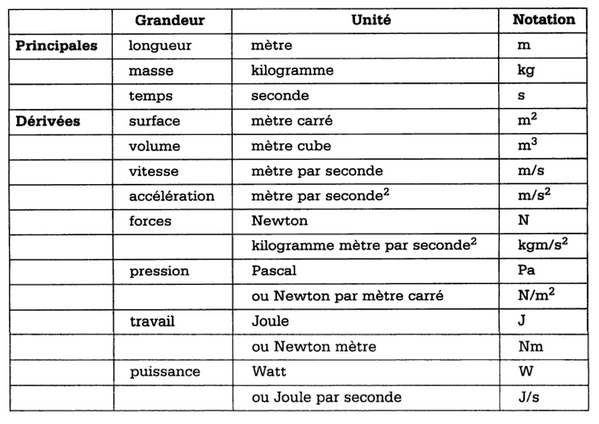
Le systéme MKSA
L'extension de ce système à l'ensemble de la physique introduit de nouvelles unités qui constituera le système MKSA (mètre, Kg, Seconde, Ampère)
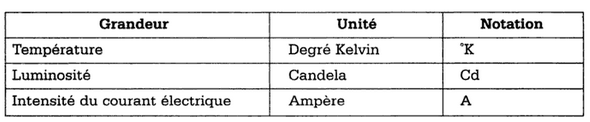
La Biochimie ajoute une septième grandeur: la quantté de substance dans l'unité est la Mole si bien que les concentrations de substances remplaceront les concentrations de masses.
Les résultats s'exprimeront en mole ou fraction de mole par litre (mol/l)
En biologie la mole représente une grande quantité de substance et ce sont ses sous multiples qui seront utilisés: millimole,micromole, nanomole.
La mole à été choisie car les corps dans les réactions biochimiques réagissent dans des rapports moléculaires.
Un mole contient toujours le même nombres de particules 6.1023 (nombre d'Avogadro).
Formule de grandeurs Physiques
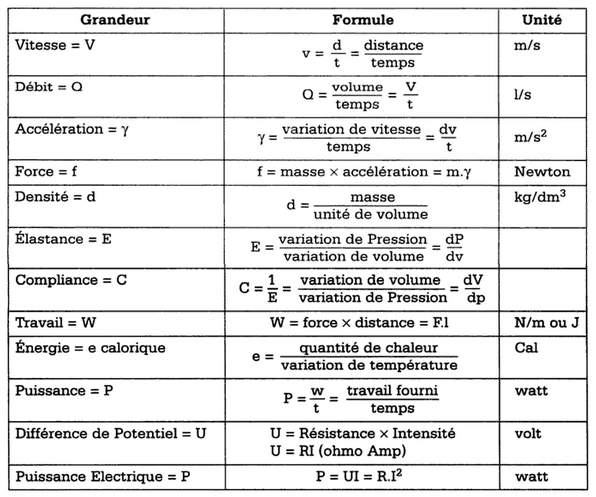
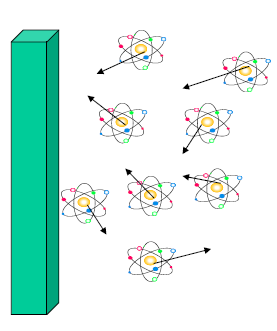
Pression d’un gaz
La pression est le résultat du choc des particules contre la paroi
- Quand la vitesse des particules augmente, la pression augmente
- Quand le nombre des particules augmente, la pression augmente
- Quand la température augmente, la vitesse des particules augmente
Notion de Pression
PRESSION = FORCE s’appliquant sur une SURFACE ⇒ P = F/S
- L’unité de pression est le pascal (Pa) qui correspond à la pression exercée perpendiculairement par une force de 1 newton sur une surface plane de 1 mètre carré.
- L’unité de force est le newton (N). C’est la force que communique un corps dont la masse est de 1 kg à une accélération de 1 mètre par seconde2. Le poids d’un corps représente la force exercée par l’attraction terrestre sur ce corps. Il est égal au produit de sa masse exprimée en kg par l’accélération de la pesanteur (g = 9,80 m.s-²) à la latitude de 45° N ou S et au niveau de la mer
- Poids d’un corps = masse (kg) x g (force de gravitation)
- Force de gravitation = manifestation de la déformation de l’espace-temps sous l’effet de la matière (g)
- L’unité de surface est le mètre carré (m2)
Les unités :
– Internationales : SI
- Le Pascal : 1 Pa = 1 N/1 m2 ,mais très petite unité, donc utilisation de sous multiples: hectoPascal (hPa)
- « Technique » : Le bar : 1 b = 1 Kgf/1 cm2, (=100 kPa)
- « Médical » :
- mmHg ou torr
- Hauteurs d’eau (cm H2O)
- Pour les volumes, le m3, le dm3 ou litre (l) et le cm3 ou millilitre (ml) sont utilisés fréquemment
- Pour la température, au lieu du degré Kelvin, on se sert souvent du degré Celsius ou centigrade C (°C = K-273,15) mais aussi dans certains pays anglo-saxons du degré Fahrenheit F (°F = 1,8 K -459,7)
Rappels de quelques notions sur les propriétés physicochimiques des gaz
Unités dérivées du pascal et autres unités :
- l’hectopascal (hPa = 100 Pa) ou le kilopascal (Kpa = 1000 Pa)
- le mmHg ou torr est la pression exercée par une colonne de mercure de 1 cm² de surface par 1 mm de hauteur, soit une masse de 1,36 g par cm². La force correspondante est de 1,36 10-3 X 9,80 N appliquée à une surface de 10-4 m2, soit une pression de 133,3 Pa = 760 mmHg
- le bar est égal à 105 Pa ou 1000 hPa soit 0,987 atm ou 750,1 mmHg
- l’atmosphère (atm) est la pression exercée par une colonne de mercure de 760 mm de hauteur et de 1 cm² de surface de base soit : 133,3 X 760 = 101 325 Pa = 1,013 bar = 1013 hPa ou mbar à la latitude de 45° N et au niveau de la mer
Qu’est-ce qu’un gaz ?
Un gaz est un corps qui, dans les conditions normales de pression et de température, se présente sous forme gazeuse.
Gaz : un des 3 états de la matière (solide / liquide / gazeux)
Le gaz est un des trois états de la matière
- Solide : Particules proches, fortement liées (liaison cristalline), structure stable (pas de mouvement des particules au repos) Le corps a une forme propre et est peu déformable
- Fluide
- Liquide : Particules relativement éloignées, peu liées (liaison électromagnétique), vitesse des atomes faible Volume propre mais pas de forme propre
- Gazeux : Grande distance entre les particules, très peu d’interaction, grande vitesse des particules, perpétuel mouvement. Ni forme, ni volume
- Le diagramme de phases est défini par l’unité de masse de tout corps chimiquement stable.
- Les domaines d’existence des différentes phases sont : solide, liquide, vapeur (ou état gazeux), en fonction de 3 variables d’état : température, pression et volume
- Le GAZ est un corps pur existant dans cet état au voisinage des conditions ordinaires de température et de pression (Pa = 1 atm et Ta = 15 °C)
- La VAPEUR est la phase «gazeuze» d ’un corps existant naturellement à l ’état solide ou liquide
- Par rapport à un solide ou un liquide, un gaz ou une vapeur se caractérise par une forte expansibilité ou compressibilité
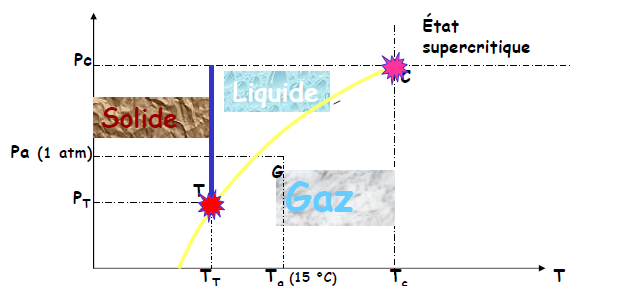
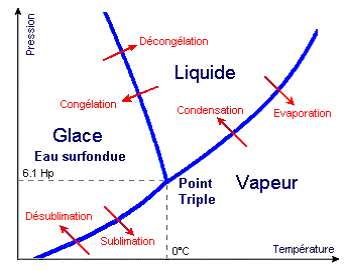
- Point T = point triple : à pression PT et températureTT, le s 3 phases sont en présence
- Point C = point critique : pour T>TC et P>PC, le corps pur est dans un état intermédiaire entre l’état liquide et l’état vapeur (densité proche de celle d’un liquide mais viscosité proche de celle des gaz) ; on l’appelle « état supercritique » ou encore zone de « gaz dense »
- Diagramme des phases
- point T ou les 3 phases sont en présence
Conditions de mesure
- Standard Temperature and Pressure Dry
- 0°C (273 K),101,3 kPa, gaz sec
- Body Temperature and Pressure Saturated
- 37°C (310 K), pression ambiante
- gaz saturé en eau à 37°C
- Ambiant Temperature and pressure Saturated
- température et pression ambiante
- gaz étant saturé en eau à température ambiante
Les Lois de l’état Gazeux
• Une mole de gaz contient 6,02.1023 molécules vraies (nombre d’Avogadro).
Elle occupe un volume de 22,4L à 273°K (0°C) sous une pression de 1013 hPa (volume molaire).
Le nombre de moles de gaz dans un récipient de volume V est dépendant de ce dernier volume
Loi des gaz parfaits
Les molécules de gaz, sous l’effet de leur énergie thermodynamique E, viennent frapper les parois.
Cette pression est proportionnelle à la température T du gaz
E=RxT ⇒ T est la température absolue (°K)
⇒ R est la constante universelle des gaz
- R = kB x Nombre d’Avogadro
- R = 8,317 J.mol-1.K-1 lorsque la pression est exprimée en Pascals, la température en degrés K et le volume en m3
- Nombre d’Avogrado = 1.602 x 1023 mole-1
- kB = constante de Boltzman = 1.381x10-23 JK-1 R est la constante universelle des gaz
Si la température augmente, la vitesse des particules augmente
Si la vitesse ou le nombre de particules augmente, la pression augmente
Loi d’Avogadro
- Des volumes égaux de 2 gaz (à la même pression et même température) contiennent des nombres égaux de molécules
- La mole (molécules-gramme) de gaz correspond à 6,023.1023 molécules réelles (à l’échelle atomique) et occupe un volume de 22,4 litres à 0°C et 1 atm (101,3 kPa)
- La densité d’un gaz est donc proportionnelle à sa masse molaire
- La densité d d’un gaz par rapport à l’air est donnée par : d = masse molaire/29
Loi de Gay-Lussac et loi de Charles
- Les gaz se dilatent (augmentation de volume) sous l’effet d’une augmentation de la température (à pression constante)
Vt = Vo (1 + αt)
- Vt= volume de gaz à la température t en °C
- Vo= volume de gaz à la température de O°C
- α = coefficient de dilatation du gaz à pression constante: il est égal à 1/273,15
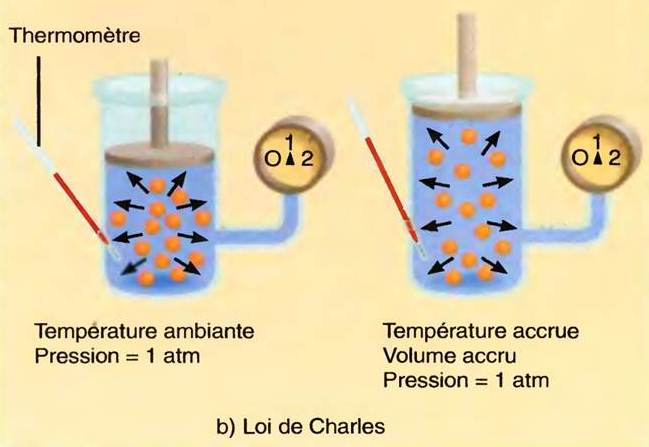
- Il en est de même pour la pression. A volume constant, celle-ci augmente aussi avec la température.
Pt = Po (1 + βt)
- Pt = Pression du gaz à la température t en °C
- Po = Pression du gaz à la température de 0°C
- β = Coefficient d’augmentation de pression à volume constant : il est égal lui aussi à 1/273,15
- Ainsi, lorsqu’on expose une bouteille de gaz à la chaleur, la pression à l’intérieur de la bouteille augmente
CONSEQUENCES :
Les gaz se dilatent sous l’effet d’une augmentation de la température
- Une mole de gaz occupe :
- À 0°C et 1 atm : 22,4 litres
- À 25°C et 1 atm : V25 = 22,4 X (1 + 25/273,15) = 24,45 litres
- À 37°C et 1 atm : V37 = 22,4 X (1 + 37/273,15) = 25,45 litres
- Si l’on expose une bouteille de gaz à la chaleur, la pression à l’intérieur de la bouteille augmente
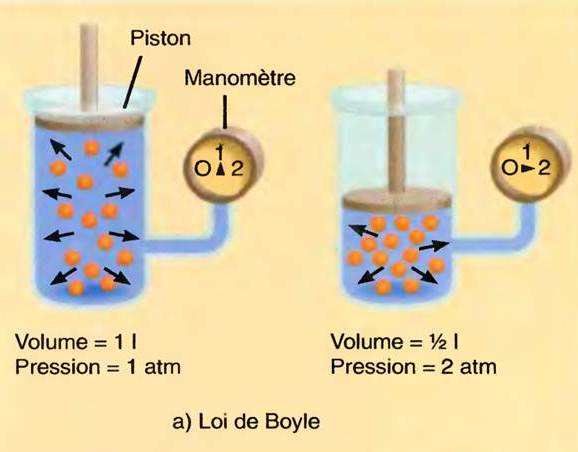
Loi de Boyle-Mariotte
Loi sur la compressibilité des gaz
- A température constante, le produit du volume V d’un gaz parfait par la pression P à laquelle il se trouve est constant ou autrement dit a température constante et pression faible, le volume d’un gaz est inversement proportionnel à sa pression
PV = constante
- La combinaison des lois de Gay-Lussac et Boyle-Mariotte conduit à la relation
PV = nRT
- où n est le nombre de moles de gaz, T la température en degrés K et R la constante des gaz parfaits (R = 8,32 J mol-1 K-1 lorsque la pression est exprimée en pascals, température en degrés K et le volume en m3)
- Pour les gaz réels
- Correction par un facteur de compressibilité Z
CONSEQUENCES :
- Lorsqu’on comprime un gaz, son volume diminue dans un même rapport. Ainsi, à la pression de 200 bar (20 Mpa), une bouteille d’acier d’une capacité de 50 litres contient l’équivalent de 10 m3 d’O2 ou d’azote à température et pression ordinaires.
- Si l’on se réfère à la forme du diagramme de phases, certains gaz tels que N2O ou le CO2 dont la température de liquéfaction est comprise entre - 100 et 0°C vont changer d’état lors de la compression à température ambiante (15°C). Dans la bouteille, nous aurons un liquide en équilibre avec sa vapeur.
- Barotraumatismes à la remontée
- Consommation d'air variant selon la profondeur…
Loi de Dalton ou loi des pressions partielles
- Dans un mélange gazeux de volume V, la pression partielle d’un gaz (constituant du mélange) est la pression qu’exercerait ce gaz s’il occupait seul le volume V.
- Chaque gaz du mélange gazeux exerce une pression proportionnelle à sa fraction molaire F. Comme, quel que soit le gaz, pour une pression donnée, une mole occupe un même volume (loi d’Avogadro), la pression partielle d’un gaz est proportionnelle à son % en volume dans le mélange. Ainsi dans l’air sec, l’O2 représente 21 % soit une fraction molaire FO2 = 0,21
- La pression partielle P d’un gaz dans un mélange gazeux est égale au produit de la pression totale Pt par sa fraction F.
P = Pt F
Pt = Σ p°partielles
- La somme des pressions partielles des différents gaz constituant un mélange gazeux est égale à la pression totale du mélange Pt.
Conséquences
- Exemple de l’air sec
- PiO2 = FiO2 x PpO2
- STPD : Pi02 = 21% x 760 = 160mmHg
- Exemple de l’air humide
- Lorsque la température augmente, la pression partielle en vapeur d’eau augmente (énergie cinétique et tendance àl’échappement) jusqu’à sa tension de vapeur saturante
- L’équilibre est atteint quand le gaz est saturé en vapeur d’eau
- BTPS : PiO2 = 21% x (760 – 47) Soit 150mmHg
- L’air atmosphérique est en fait plus ou moins chargé d’humidité (vapeur d’eau). En effet, les molécules d’un liquide, comme celles d’un gaz, sont perpétuellement en mouvement.
Celles qui se trouvent en surface d’un liquide ont tendance à s’échapper dans le gaz qui le recouvre.
- Lorsque la température s’élève, l’énergie cinétique des molécules du liquide augmente ainsi que la tendance à l’échappement, jusqu’à ce que la pression partielle de la vapeur du liquide dans le gaz soit égale à sa tension de vapeur saturante (équilibre atteint : le gaz est saturé en vapeur de liquide). La pression partielle de l’eau dans l’air croît avec la température comme le montre le tableau suivant.
Variation de la pression partielle en vapeur d’eau dans l’air en fonction de la température
| Température (°C) |
20 |
25 |
30 |
35 |
37 |
| P H2O (kPa) |
2.3 |
3.2 |
4.2 |
5.6 |
6.3 |
| P H2O (torr) |
17.5 |
23.8 |
31.8 |
42.2 |
47.0 |
Pression partielle d’un gaz dans un liquide Loi de Henry
- Loi de dissolution des gaz dans un liquide
- Les gaz se dissolvent dans les liquides
- Plus un liquide est froid, plus le point de saturation est élevé
- Loi de Henry : à température donnée, la quantité de gaz dissous à saturation dans un liquide est proportionnelle à la pression partielle du gaz sur ce liquide (et à son coefficient de solubilité dans ce liquide)
- Elle mesure la solubilité d’un gaz dans un solvant avec lequel le gaz est en contact
- Volume dissout = Solubilité x P°partielle x …
- Lorsqu’une phase liquide et une phase gazeuse sont en présence, nous venons de voir que des molécules du liquide avaient tendance à s’échapper vers la phase gazeuse. Il en est de même pour les molécules de gaz qui s’immiscent par diffusion entre les molécules du liquide jusqu’à ce que la pression partielle du gaz tendant à sortir du liquide soit égale à celle du gaz qui tente d’y entrer.
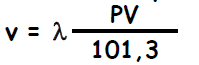
- Le système est alors en équilibre et le volume v de gaz dissous dans un volume V est donné par la loi de Henry : où P est la pression partielle du gaz dans le liquide et l’atmosphère environnante et λ le coefficient de solubilité (en m3 de gaz/m3 de liquide ou ml/ml) qui dépend du gaz considéré, du liquide, de la force ionique et de la température
EXEMPLE :
- Le coefficient de solubilité λ de l’O2 dans le plasma est de 0,0237 à 37°C, soit pour une PO2 dans le sang artériel de 13,3 kPa (100 torr) : v = 0,0237 X 13,3/101,3 X 100 = 0,3 ml O2/100 ml sang
- Bien que faible, la quantité d’O2 dissous est un facteur important; c’est l’étape intermédiaire indispensable avant la fixation de l’O2 sur l’hémoglobine après le passage par diffusion à travers la membrane alvéolocapillaire.
Conséquences
- Les truites vivent en eau froides (qui contient plus d’oxygène dissout)
- Phénomènes de décompression et accidents de décompression
- Un gaz inerte (He ou azote) est inhalé à haute pression, et donc dissout dans le sang et les muscles lors de la compression
- À la remontée, les gaz sont dégagés sous forme de microbulles…qui peuvent être exhalées si on prend son temps…
- Les paliers de décompression réduisent le volume et le nombre de bulles
- L’oxygène qui traverse la membrane alvéolo-capillaire est d’abord dissout…puis lié à l’hémoglobine
- La demi-vie de l’HbCO baisse si la PiO2 augmente (Fi ou P°)
- 6 heures en AA / 1 atm ; 30 à 90 min à FiO2 = 1 / 1 atm
- 10 à 30 min à FiO2 = 1 / 2 atm ; < 20 min à FiO2 = 1 / 3 atm
Notion de chaleur latente de vaporisation et conséquences
- Le passage de l’état liquide à l’état gazeux nécessite de la chaleur. Ainsi, à la pression atmosphérique, on doit chauffer l’eau pour la faire bouillir.
- A l’inverse, si un liquide se vaporise sans apport extérieur de chaleur, il emprunte la chaleur nécessaire à sa vaporisation au milieu ambiant et le refroidit; c’est ce qui se passe lorsqu’on est en sueur dans un courant d’air ou lorsqu’on verse de l’éther sur la peau, celui-ci s’évapore en donnant une sensation de froid :
- propriété utilisée pou obtenir une anesthésie locale par le froid.
- La chaleur latente de vaporisation est la quantité de chaleur qu’il faut fournir à une mole de substance pour qu’elle passe de l’état liquide à l’état gazeux, la température restant constante pendant tout le temps de la transformation (température d’ébullition)
- Quand on détend (diminution brusque de pression) à une température ordinaire un bouteille contenant un gaz liquéfié, le liquide se vaporise en empruntant la chaleur
au milieu
- Le liquide et la bouteille qui le contient se refroidissent (ce principe est utilisé dans les réfrigérateurs pour obtenir du froid). La bouteille se couvre éventuellement de givre
ainsi que le robinet détendeur par cristallisation de la vapeur d’eau de l’air atmosphérique. Si le débit de gaz est important, le refroidissement peut être suffisant pour geler et donc bloquer le mécanisme du détendeur.
- Ce type d’accident peut se produire avec des bouteilles renfermant du protoxyde d’azote ou du dioxyde de carbone. Il est important de ne pas utiliser des débits élevés de gaz sur ce type de bouteille (débit toujours inférieur à 8 l/min)
- Une autre précaution doit être prise avec ces bouteilles liquéfiées : elles ne doivent être utilisées que debout. En effet, la phase liquide plus dense est toujours la phase inférieure. La pression dans la bouteille est exercée par la phase gazeuse supérieure.
- Si l’on ouvre le détendeur lorsque la bouteille est debout, le gaz s’échappe. Par contre, lorsque la bouteille est couchée ou à l’envers, c’est la phase liquide sui s’échappera pouvant provoquer de graves brûlures (propriété utilisée, mais de façon contrôlée en cryochirurgie)