DR DELANOUE, COURS IADE, 2006/Pierre Beaulieu MD, PhD; Département d’anesthésiologie et de pharmacologie/Faculté de Médecine;Université de Montréal
HISTORIQUE
- Découverte par hasard
- Chlordiazépoxide (Librium*)synthétisée en 1957 par Sternbach puis utilisation clinique en 1961
- Diazepam synthétisé en 1959
- Oxazépam synthétisé en 1961 par Bell
- Lorazépam en 1971
- Récepteur des benzodiazépines postulé en 1971
- Midazolam synthétisé en 1976 par Fryer et Walser
- Flumazénil identifié en 1981
INTRODUCTION
Structure chimique identique
Action sur les récepteurs spécifiques centraux identiques : GABA A
5 propriétés fondamentales:
- Amnésiantes
- Anxiolytiques
- Sédatives et hypnotiques
- Myorelaxantes
- Anticonvulsivantes
Acide gamma amino butyrique ou GABA, inhibiteur
- présent dans les neurones où il est synthétisé à partir de l'acide glutamique, sous l'influence de l'acide glutamique décarboxylase (GAD) utilisant le phosphate de pyridoxal comme cofacteur.
- Stocké dans les granules des terminaisons présynaptiques et libéré dans la fente synaptique,
- agit sur des récepteurs spécifiques de type GABAA et GABAB situés sur la fibre postsynaptique.
Récepteurs et effets
- Le GABA exerce ses effets par l'intermédiaire de deux types de récepteurs :
- le récepteur GABA A, le plus connu, et le récepteur GABA B (Des récepteurs GABA C ont été décrits récemment).
Mode d'action et pharmacocinétique des benzodiazépines
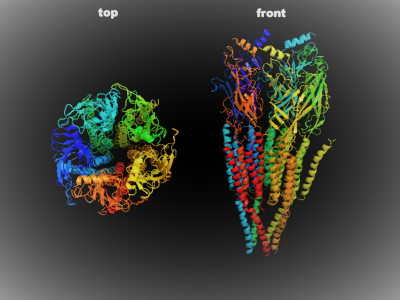
Structure et organisation
- Organisation tridimensionnelle des récepteurs GABAA.
- Chaque sous-unité est colorée différemment.
- Top : vue parallèle au plan de la membrane (non représentée), la face extracellulaire est la plus proche de l'observateur.
- On distingue le pore central de conduction ionique.
- Front : vue perpendiculaire au plan de la membrane (les ions s'écoulent verticalement)
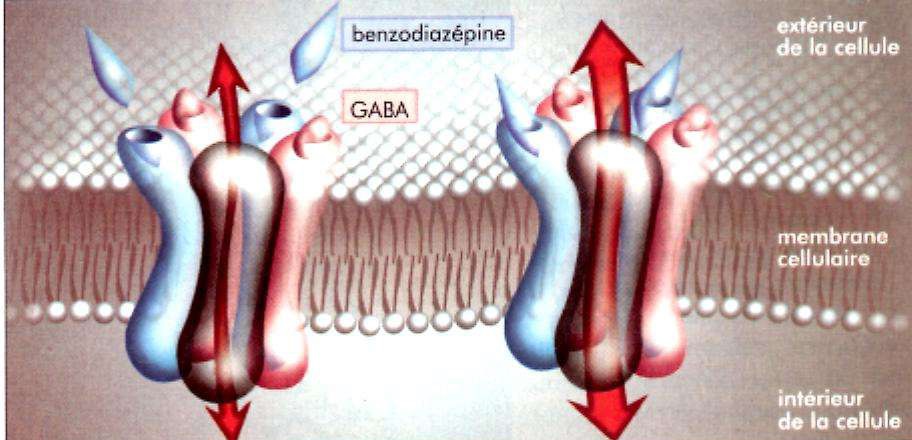
Récepteurs et effets GABAA
- Sous la dénomination de récepteur GABAA, on désigne un complexe macromoléculaire qui, en plus des sites de fixation du GABA, comporte des sites de fixation
- des benzodiazépines,
- des barbituriques,
- de certains stéroïdes.
- Il s'agit d'un récepteur canal, perméable préférentiellement aux ions Cl- et accessoirement aux ions Br-.
- L'ouverture de ce récepteur canal perméable aux ions Cl- est commandée directement par le GABA qui est le médiateur essentiel.
- La fixation de deux molécules de GABA entraîne son ouverture, la pénétration des ions Cl- et une hyperpolarisation cellulaire.
- Cependant, un excès de GABA désensibilise le récepteur.
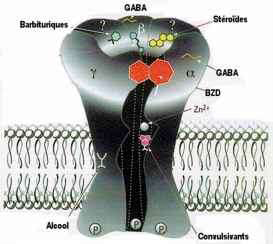
- Ces récepteurs sont situés auprès des sites de fixation du GABA. Il s'agit des récepteurs aux benzodiazépines, aux barbituriques et à certains stéroïdes comme l'alloprégnanolone, métabolite de la progestérone.
- Ces substances favorisent l'effet du GABA, mais sont sans effet en absence de GABA.
- Il existe des agonistes agissant sur des récepteurs à effet opposé à ceux des benzodiazépines et que l'on désigne par agonistes inverses.
- Au niveau du système nerveux,
- L'influx intracellulaire de chlore entraîne une hyperpolarisation de la membrane qui inhibe l'activité neuronale.
- l'augmentation de la fréquence d'ouverture du canal chlorure, laissant entrer des ions Cl- est à l'origine d'effets inhibiteurs, et sa diminution, à l'origine d'effets opposés.
Une particularité du récepteur GABAA est d'être modulé allostériquement *par d'autres récepteurs qui favorisent ou inhibent l'effet du GABA.
*(L'allostérie (du grec ἄλλως, allos : autre et στερεός, stereós : forme) est un mode de régulation de l'activité d'une enzyme par lequel la fixation d'une molécule effectrice en un site modifie les conditions de fixation d'une autre molécule, en un autre site distant de la protéine. Ce concept a été formalisé par Jacques Monod, Jean-Pierre Changeux et Jeffrey Wyman dans une série d'articles, dont le plus important a été publié en 1965 dans Journal of Molecular Biology.)
Mode d'action
- Les benzodiazépines se lient uniquement au récepteur GABAA, et augmentent la fréquence d'ouverture des canaux chlorés, alors que les barbituriques augmentent la durée d'ouverture de ces canaux.
- L'action des benzodiazépines est indirecte, comme le montre leur absence d'effets GABAergiques en l'absence de GABA.
- Elles modulent de façon allostérique l'affinité du GABA pour son site de liaison.
- Il convient de noter que l'inhibition neuronale ne se traduit pas toujours par une action dépressive au niveau d'un système neuronal : l'inhibition de neurones eux-mêmes inhibiteurs peut avoir pour conséquence une excitation.
- Les agonistes à effet allostérique modulent la sensibilité du récepteur GABAA à l'effet du GABA.
- Il peuvent favoriser ou réduire l'effet du GABA
- Ce sont principalement les benzodiazépines, les barbituriques et certains stéroïdes.
- On distingue deux types de récepteurs des (BZD) selon que leur activation par des agonistes :
- favorise l'effet du GABA, c'est-à-dire l'ouverture du canal Cl-. La quasi-totalité des BZD utilisées en thérapeutique sont des agonistes de ces récepteurs. Ils peuvent être considérés comme des ouvreurs des canaux chlorure GABA-dépendants.
- inhibe l'effet du GABA, c'est-à-dire tentent de s'opposer à l'ouverture du canal Cl-, on les appelle le plus souvent agonistes inverses.
|
Ouverture : entrée de Cl-
|
Fermeture : inhibition d'entrée de Cl-
|
| Anxiolytique |
Anxiogène |
|
Sédatif hypnotique
|
Stimulant |
|
Anticonvulsivant
|
Proconvulsivant |
| Amnésiant |
promnésiant |
| Myorelaxant |
|
Classification des BZD en fonction des indications
- BZD anxiolytiques
- diazépam, oxazépam, bromazépam, clobazam, alprazolam, chlorazépate…
- BZD hypnotiques
- nitrazépam, flunitrazépam, témazepam, loprazolam, triazolam… et aussi zopiclone et zolpidem
- BZD antiépileptiques
- BZD anesthésiques
L'affinité relative des principales benzodiazépines utilisées en anesthésie pour le récepteur GABAA est la suivante : flunitrazépam > lorazépam > midazolam > diazépam.
On ne sait pas comment les différents effets des benzodiazépines sont relayés.
Il est possible que la nature de la réponse dépende tout simplement du degré d'occupation des récepteurs :
- une occupation inférieure à 20 % = l'anxiolyse,
- 30 à 50 % d'occupation = sédation,
- > 60 % d'occupation = une perte de connaissance
Pharmacocinétique
Distribution initiale
- Toutes les benzodiazépines destinées à l'anesthésie-réanimation ont un volume initial de distribution identique, de l'ordre de 0,3 l/kg, et une demi-vie initiale de distribution rapide (3 à 10 min).
- Ceci explique que la durée d'action d'une dose unique de midazolam ou de diazépam par exemple soit identique quelle que soit par ailleurs la clairance d'élimination du composé.
Distribution périphérique
- La liposolubilité des benzodiazépines explique l'importance de leur Vdss.
- Ce volume sera donc très sensible aux modifications de la composition de l'organisme, et l'élimination des benzodiazépines sera retardée chez les obèses et les vieillards.
Elimination
- Les benzodiazépines sont toutes des agents liposolubles ⇒ ne peuvent être éliminées à l'état natif par le rein
- ⇒Elles subissent donc toutes une biotransformation hépatique .
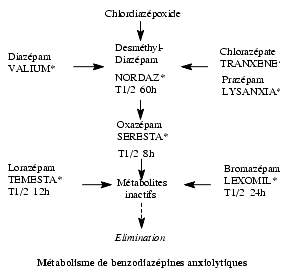
Métabolites
- De nombreux métabolites de benzodiazépines sont pharmacologiquement actifs.
- Ceux dont l'élimination est au moins aussi rapide que celle du composé natif ne contribuent pas à prolonger l'effet pharmacologique.
- Par contre, le desméthyldiazépam dont l'élimination est deux fois plus lente que celle du diazépam a été rendu responsable de retards de réveil très prolongés après des administrations importantes et répétées de diazépam pour la sédation en réanimation.
- Ainsi, la lenteur d'élimination du diazépam, jointe à l'existence de ce métabolite actif de demi-vie plus longue encore, ont fait pratiquement abandonner son usage en doses itératives ou en perfusions continues.
Pharmacodynamique
Effets sur le système nerveux central
Ils sont proportionnels au degré d'occupation des récepteurs, l'anxiolyse précédant la sédation, elle-même suivie de l'hypnose.
Les différentes propriétés peuvent être présentes à des degrés divers selon les molécules.
Anxiolyse
- Les benzodiazépines sont anxiolytiques.
- Cette propriété majeure explique leur intérêt non seulement dans le traitement au long cours des états anxieux , mais aussi pour la prémédication anesthésique et la sédation en réanimation.
Hypnose
- A forte dose, les benzodiazépines induisent un effet narcohypnotique, ce qui a permis de les proposer comme agents de l'anesthésie générale ou comme inducteurs du sommeil.
Amnésie
Les benzodiazépines sont amnésiantes .
- L'amnésie induite porte surtout sur l'acquisition des faits récents (amnésie antérograde) .
- Elle persiste après que l'hypnose et la sédation aient disparu. L'impression de récupération totale est donc trompeuse .
- En cas d'anesthésie ambulatoire, il est impératif que les patients reçoivent par écrit des instructions postopératoires détaillées .
- Cet effet amnésiant apparaît même pour de faibles doses, et peut avoir son utilité chez les patients soumis à des actes désagréables appelés à se répéter.
Stabilisation des membranes
Les benzodiazépines sont anticonvulsivantes .
- Elles permettent de contrôler plus de 90 % des convulsions généralisées.
- Cette propriété est mise à profit en thérapeutique humaine, en particulier avec le clonazépam (Rivotril®). Le midazolam est un traitement efficace et sûr de l'état de mal épileptique chez l'enfant .
- Dans certains cas très particuliers (syndrome de Lennox-Gastaut), le diazépam peut paradoxalement déclencher des crises convulsives cliniques et électroencéphalographiques
Métabolisme cérébral
- Les benzodiazépines exercent un effet protecteur en cas d'ischémie cérébrale en diminuant la consommation d'oxygène du cerveau.
- Les benzodiazépines peuvent être utilisées chez les patients atteints d'hypertension intracrânienne dès lors que la ventilation est contrôlée et l'hypercapnie prévenue.
- La protection apportée par le midazolam est supérieure à celle apportée par le diazépam, mais reste inférieure à celle obtenue avec les barbituriques.
Effets cardiovasculaires
- Les effets hémodynamiques des benzodiazépines utilisées seules sont modérés .
- Elles induisent une réduction peu importante (- 5 à - 25 %) de la pression artérielle principalement due à une action vasodilatatrice.
- Un effet vasodilatateur direct a pu être mis en évidence expérimentalement avec le diazépam, le flunitrazépam, et le midazolam.
- La conséquence de cette vasodilatation est une diminution du retour veineux et donc de la précharge ventriculaire, source des variations de débit cardiaque observées après administration de ces produits.
- L'ensemble de ces effets tend à produire une diminution de la demande en oxygène du myocarde.
- Si le flunitrazépam et le diazépam induisent une vasodilatation coronaire, le midazolam, quant à lui, préserve l'autorégulation de la circulation coronaire, dans la mesure où il n'entraîne pas de vasodilatation coronaire
- Le diazépam et le midazolam dépriment le baroréflexe et diminuent le tonus sympathique.
- L'ensemble de ces effets hémodynamiques explique la mauvaise tolérance des patients hypovolémiques à l'administration de benzodiazépines, en tout cas en injection intraveineuse directe.
- Si l'administration d'un agent sédatif est nécessaire dans ces situations, il faudra préférer la perfusion continue, à doses d'autant moindres que l'hypovolémie ralentit l'élimination du midazolam , et sous couvert d'une surveillance continue des pressions de remplissage.
- Il faut noter cependant que cette bonne tolérance hémodynamique des benzodiazépines ne vaut que lorsqu'elles sont utilisées seules.
- Leur association à des agents analgésiques ou hypnotiques ayant eux-mêmes des effets inotropes négatifs ou vasodilatateurs marqués peut induire des situations périlleuses.
Effets respiratoires
- Les effets respiratoires des benzodiazépines sont moins marqués que ceux d'autres agents anesthésiques ou des analgésiques centraux.
- Ils ne sont néanmoins pas négligeables : apnées centrales et obstructives lors de l'administration en injection intraveineuse rapide, hypoventilation alvéolaire, dépression de la réponse ventilatoire au CO2 et à l'hypoxie .
Effets neuromusculaires
- Les benzodiazépines ont un effet myorelaxant certain , mis à profit depuis longtemps par exemple dans le traitement du tétanos, et qui peut contribuer à faciliter l'adaptation des patients de réanimation au respirateur, mais aussi à potentialiser l'action des curares en anesthésie.
- Cette action myorelaxante des benzodiazépines est une action centrale (inhibition des réflexes polysynaptiques à un niveau supraspinal et inhibition médullaire), observée avec d'autres agents anesthésiques.
- Il n'y a pas d'effet direct sur la plaque motrice.
Effets indésirables
- Comme la plupart des anesthésiques généraux et des dépresseurs du système nerveux central, les benzodiazépines réduisent la pression intraoculaire.
- Néanmoins, comme elles n'atténuent que modérément l'hypertension artérielle et la tachycardie induites par l'intubation endotrachéale, elles ne sauraient être utilisées seules pour induire l'anesthésie générale lorsqu'une augmentation de la pression intraoculaire est dangereuse.