- Accueil
- Modules 1ére année
- 2. PHARMACOLOGIE (Vh : 100 h , Coef : 3)
- 1) Pharmacocinétique et pharmacodynamique appliquées à l'anesthésie.
1) Pharmacocinétique et pharmacodynamique appliquées à l'anesthésie.
Principes de pharmacocinétique appliqués à l’anesthésie
J.-P. Haberer
Introduction
La pharmacocinétique est l’étude quantifiée du devenir des médicaments dans l’organisme depuis leur administration jusqu’à leur élimination [1–5]. Ainsi, elle s’intéresse directement à la relation entre la dose administrée et la concentration du médicament dans le sang et au site d’action. La pharmacodynamie décrit la relation entre la dose administrée ou la concentration plasmatique du médicament et son effet pharmacologique [6].
L’intensité et la durée de cet effet dépendent de la concentration du médicament au site d’action et de son évolution dans le temps. L’objectif de la pharmacocinétique est d’améliorer l’administration des agents anesthésiques en adaptant les doses et les modalités d’administration (bolus, perfusion continue) aux nécessités de la procédure chirurgicale (profondeur de l’anesthésie, de la myorelaxation, de l’analgésie). Les modèles pharmacocinétiques sont une aide à l’ajustement des doses des anesthésiques, permettant de réduire les risques de sousdosage ou de surdosage et les effets secondaires qui y sont liés. En anesthésie, du fait de l’administration des médicaments
pendant une durée limitée et de la nécessité de modifier souvent la concentration plasmatique, les modèles pharmacocinétiques conventionnels ont certaines limites. Pour optimiser l’administration des anesthésiques, la pharmacocinétique et la pharmacodynamie sont intégrées dans des modèles dits « pharmacocinétique/pharmacodynamie » (PK/PD) qui décrivent la relation temporelle entre la dose, la concentration plasmatique ou au site d’action et l’effet pharmacologique [7]. Ces modèles sont indispensables lorsque les anesthésiques sont administrés selon la technique à objectif de concentration (target-controled infusion [TCI], anesthésie intraveineuse à objectif de concentration, [AIVOC]) [8–10].
Pharmacocinétique descriptive
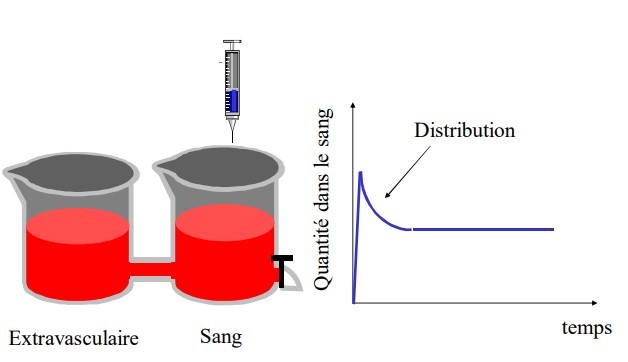
En anesthésie, les médicaments sont pour la plupart administrés par voie intraveineuse, ce qui supprime la phase d’absorption et s’accompagne d’une biodisponibilité proche de 100 %. L’évolution de la concentration plasmatique en fonction du temps est le résultat de la distribution et de l’élimination du médicament. Ces phénomènes de distribution et d’élimination sont décrits par les concepts de volume de distribution et de clairance [3, 5].
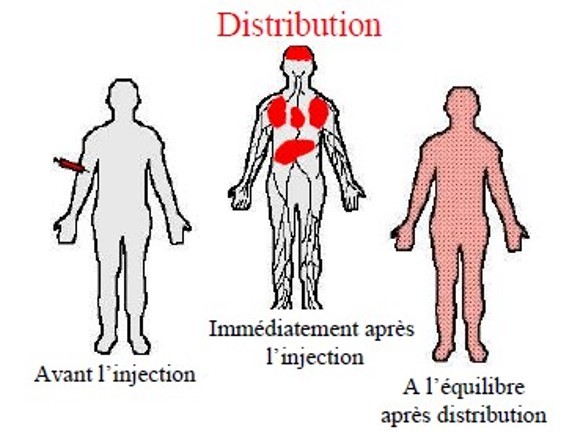
Distribution
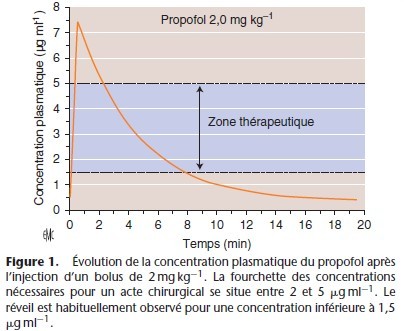
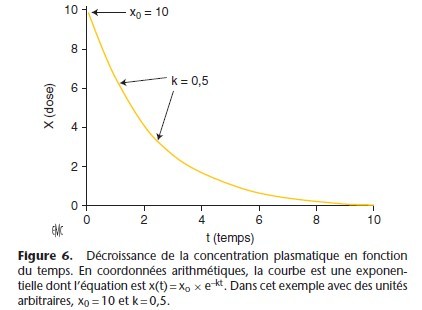
Après l’injection intraveineuse d’un anesthésique, la concentration plasmatique décroît selon une courbe exponentielle [11] (Fig. 1). Injecté dans le sang circulant, le médicament quitte la circulation pour être fixé par les organes périphériques. Les principaux facteurs qui régissent cette distribution tissulaire sont résumés dans les Tableaux 1, 2. Pour atteindre son site d’action, l’agent anesthésique doit traverser les membranes cellulaires, endothélium vasculaire et membrane de la cellule cible, par
exemple neurones du système nerveux central. Le transport à travers les membranes cellulaires peut se faire par trois mécanismes, passif, actif, et facilité (intervention d’une protéine de transport sans nécessité d’énergie).
Pour les agents anesthésiques c’est essentiellement le transport passif qui est en jeu et il dépend du gradient de concentration entre le sang circulant et les organes périphériques.
Pour les médicaments hydrosolubles, la diffusion passive selon le gradient de concentration se fait par des canaux protéiques hydrophiles (par exemple, curares et canal ionique des récepteurs cholinergiques).
En anesthésie, cette étape de distribution a une importance particulière : c’est elle qui est à l’origine des variations les plus rapides de la concentration plasmatique de l’agent, et donc de la quantité d’agent qui est présentée à chaque instant devant les sites d’action.
Les variations de la concentration plasmatique modulent directement la cinétique d’action du médicament. Ainsi, deux agents dont la vitesse d’élimination est proche, par exemple le fentanyl et le sufentanil, ont une cinétique d’action très différente par le simple fait de leur distribution : le sufentanil distribué rapidement et de facon extensive voit sa concentration plasmatique décroître très vite au-dessous du seuil de concentration efficace, alors que la concentration plasmatique du fentanyl distribué plus lentement reste plus longtemps dans la zone thérapeutique, même si secondairement les concentrations résiduelles des deux agents diminuent à la même vitesse du fait d’une élimination comparable.
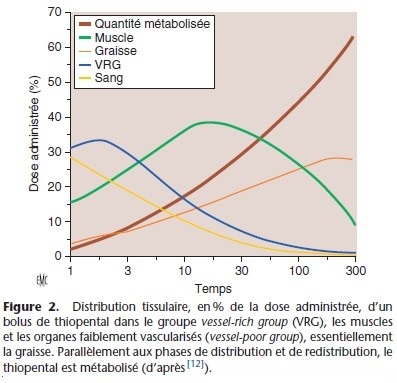
Après un temps variable, en fonction du médicament, de la dose et du mode d’administration (injection unique, perfusion), la concentration tissulaire dépasse la concentration plasmatique, le gradient de diffusion s’inverse et le médicament quitte les organes périphériques. Dans les années 1960, la cinétique de la distribution vers les organes périphériques a été décrite pour le thiopental en regroupant les organes en trois groupes selon l’importance de leur débit sanguin et de leur capacité de captage
du médicament (Fig. 2) : organes richement vascularisés (vessel-rich group [VRG] : cerveau, poumons, reins), groupe des muscles et circulation splanchnique, et organes faiblement vascularisés (vessel-poor group [VPG] : tissu adipeux, os) [2, 11, 12]. Très rapidement, c’est-à-dire quelques minutes après l’injection intraveineuse, les phénomènes de distribution et de redistribution se déroulent simultanément. Après une injection unique, la redistribution se fait essentiellement vers les muscles, le tissu adipeux captant une fraction plus faible du médicament. En revanche, lors des réinjections ou d’une perfusion continue, l’accumulation périphérique du médicament touche aussi le tissu adipeux. Certains médicaments, par exemple le fentanyl qui est une base faible, subissent un cycle entérohépatique, cette réabsorption digestive pouvant s’accompagner d’une remontée de la concentration plasmatique.
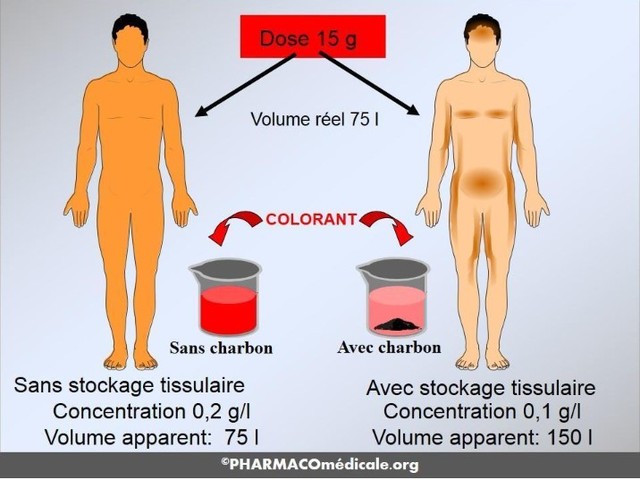
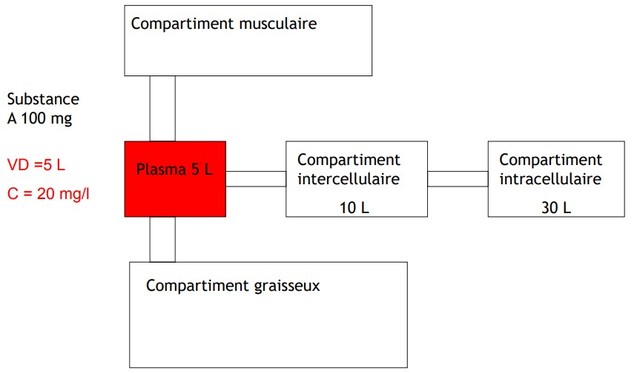
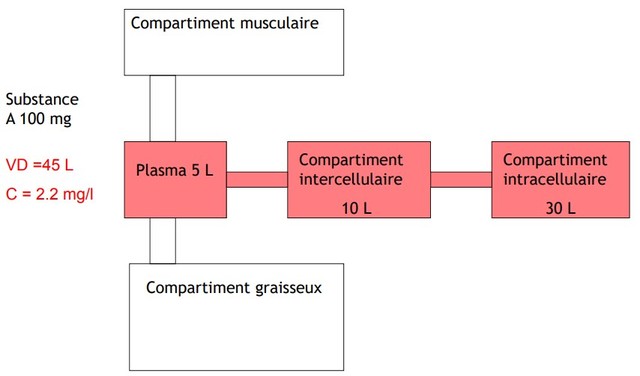
Volumes de distribution
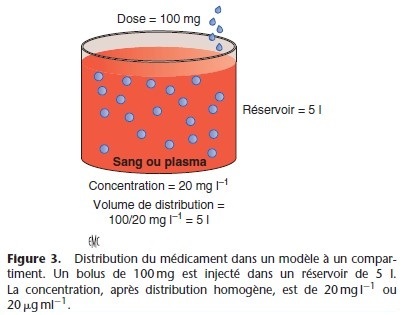
Le volume de distribution se définit comme le volume apparent d’un réservoir dans lequel se dilue le médicament, le volume du réservoir étant celui pour lequel la concentration est identique à la concentration plasmatique (Fig. 3). La concentration dans le réservoir est la quantité de médicament injecté divisée par le volume. Si le volume est inconnu, mais que la concentration (C) peut être mesurée, le volume (Vd) est calculé selon la formule : volume = quantité (dose)/concentration :
Vd = dose/C
Volume de distribution central
C’est le volume dans lequel se dilue le médicament au tout début de son injection. Le volume central est calculé en extrapolant la courbe de concentration en fonction du temps et en appliquant la concentration plasmatique qui serait mesurée si la circulation avait une vitesse infinie, c’est-à-dire si le mélange était instantané. En pratique, cette dernière hypothèse n’est pas vérifiée puisque le médicament n’apparaît dans le sang artériel que 30 à 40 secondes après son injection intraveineuse. La notion de volume central est utile au plan didactique, mais sa mesure précise est difficile. Ceci explique les limites du volume central (Vc) lorsqu’il est utilisé pour le calcul de la dose à administrer pour atteindre une concentration plasmatique donnée selon l’équation :
Dose de charge = Vc × concentration cible
Cette relation est une approximation car le volume qui permet le calcul de la dose de charge avec le plus de précision est le volume de distribution au pic de l’effet clinique (Vd peak-effect [Vdpe]).
Au moment du pic de l’effet clinique, on observe un pseudoéquilibre avec une égalité entre la concentration plasmatique et la concentration au site effet (cf. infra) [8, 10, 13–15].
Volumes de distribution périphériques
Le médicament injecté dans le volume sanguin circulant est distribué aux organes périphériques. Cette distribution est décrite par l’adjonction au volume central de compartiments périphériques.
La liaison du volume central aux volumes périphériques est représentée par un modèle dénommé modèle mamillaire (à l’image d’un système central de canalisation alimentant en dérivation d’autres tuyaux et par analogie avec les mamelles d’une femelle allaitante). La distribution du débit cardiaque détermine la vitesse à laquelle les différents organes sont exposés au médicament. Les VRG sont les organes qui s’équilibrent le plus rapidement avec la concentration plasmatique. Puis, l’équilibre se fait avec les organes comme les muscles et le foie, et en dernier avec les VPG. L’équilibre avec le VRG se fait en minutes, avec les muscles en heures et avec le VPG en jours.
Le volume des compartiments périphériques reflète la solubilité tissulaire du médicament. Plus un médicament est liposoluble, plus important est son volume de distribution dans les tissus.
En pratique, la solubilité tissulaire exacte n’est pas connue et elle est assimilée à la solubilité dans le sang. Une telle extrapolation explique que le volume de distribution périphérique des médicaments liposolubles est très élevé et sans rapport avec la réalité physiologique (par exemple 5000 l pour le propofol). Un volume de distribution tissulaire très élevé s’explique aussi par la fixation sur les protéines tissulaires. Il faut se rappeler que le volume de distribution périphérique calculé est le volume virtuel dans lequel le médicament devrait être dilué pour y être à la même concentration que dans le plasma. À l’inverse, pour un médicament hydrosoluble, curares par exemple, le volume de distribution est proche des volumes extracellulaires.
Au cours d’une perfusion intraveineuse, lorsque la concentration plasmatique reste constante, un état stable est atteint. À l’état stable, la quantité de médicament administrée est égale à la quantité éliminée. Le volume de distribution à l’état stable (Vdss) est le volume qui relie la concentration plasmatique à l’état stable
à la quantité totale de médicament présente dans l’organisme.
Vdss = Qss/Cp
Qss = quantité de médicament présente dans l’organisme à l’état stable ; Cp = concentration plasmatique.
Vdss est égal au volume central plus les volumes périphériques.
En anesthésie, la durée d’administration est relativement brève par rapport au temps nécessaire à l’obtention de l’état stable, ce qui nécessite le recours à une approximation pour définir un état pseudostable.
Élimination des médicaments
L’élimination désigne l’ensemble des processus qui aboutissent à la disparition du médicament de l’organisme [1, 16]. Le médicament peut être éliminé sous forme inchangée ou après métabolisme. Le foie et les reins sont les organes principaux de l’élimination. Néanmoins, d’autres organes et tissus participent au métabolisme (poumons, globules rouges, intestin).
Pour la plupart des anesthésiques, le métabolisme aboutit à des métabolites inactifs. Le métabolisme peut aussi aboutir à des métabolites qui conservent une activité pharmacologique proche de la molécule mère (hydroxymidazolam, morphine-6-glucuronide).
Enfin, le métabolisme peut transformer une prodrogue en médicament actif (déméthylation de la codéine en morphine).
Réactions de biotransformation
La plupart des médicaments anesthésiques sont lipophiles et nécessitent leur transformation pour être éliminés. Les réactions enzymatiques qui transforment les médicaments sont classées en réactions de phases I et II (Tableau 3). La phase I transforme le médicament en un ou plusieurs composés polaires, plus faciles à éliminer. La phase II rend le métabolite encore plus hydrophile en conjuguant les sites polaires avec divers composés endogènes. La plupart des médicaments subissent successivement les réactions de phase I, puis de phase II. Néanmoins, certains médicaments ne sont soumis qu’à un type de réaction, soit de type I, soit de type II [16].
Réactions de type I
Les principales réactions de type I sont l’hydrolyse, l’oxydation ou la réduction de la molécule mère. L’hydrolyse qui dégrade la molécule en deux métabolites par adjonction d’une molécule d’eau est le mode de métabolisme des esters comme les anesthésiques locaux, la succinylcholine et le rémifentanil. L’oxydation, réaction la plus fréquente, introduit un groupe OH dans la molécule. L’hydroxylation initiale précède souvent une seconde réaction qui est une désalkylation (suppression d’un radical carboné), une désamination (suppression d’un radical azoté), une oxydation d’un radical azoté, une désulfuration, une déshalogénation ou une déshydrogénation.
Cytochrome P450. Le cytochrome P450 (CYP) est une superfamille d’enzymes qui catalysent la plupart des réactions de type I [16]. Le CYP est aussi appelé oxydases à fonction mixte ou mono-oxygénases. Le CYP est intégré au réticulum endoplasmique lisse (microsomes) des hépatocytes et à la membrane des entérocytes de l’intestin grêle. Il existe aussi au niveau des poumons, des reins et de la peau. Les isoenzymes du CYP oxydent leur substrat essentiellement par insertion d’un atome d’oxygène
sous forme de radical hydroxyle. La réaction d’oxydation typique implique une hydroxylation initiale, le nicotinamide adénine dinucléotide phosphate (NADPH) fournissant deux électrons pour réduire un atome d’oxygène moléculaire en eau et insérer un autre électron dans le substrat selon la réaction suivante :
RH + O2 + NADPH + H+ → ROH + H2O + NADP+
RH = substrat ; ROH = métabolite oxydé.
Plus de 50 isoformes du CYP ont été identifiées, mais seules quelques-unes sont responsables du métabolisme de la majorité des médicaments. Les CYP ont une plus ou moins grande spécificité vis-à-vis de leurs substrats. Dans le métabolisme des anesthésiques, les CYP les plus importants sont les CYP2B6, 2D6, 2E1 et 3A. Le CYP3A4 est l’enzyme quantitativement la plus importante, elle représente 40 à 45 % du métabolisme médié par le CYP. Le CYP3A4 métabolise un large éventail de médicaments
dont plusieurs anesthésiques (Tableau 4). Chez certains sujets, c’est le CYP3A5 qui assure une grande partie des fonctions du CYP3A4.
Certaines enzymes (CYP3A4 et CYP2B6) subissent une induction ou une inhibition par divers xénobiotiques, dont des médicaments (Tableau 5). Ces phénomènes d’induction ou d’inhibition peuvent influencer la pharmacocinétique des anesthésiques.
Ainsi, la troléandomycine diminue la clairance de l’alfentanil de près de 88 %[16, 17]. Néanmoins, dans la plupart des cas, l’incidence clinique de ces modifications n’est pas majeure car c’est la phase terminale d’élimination qui est prolongée alors que l’effet pharmacologique est surtout observé durant la phase initiale de distribution. De plus, ces modifications sont en partie masquées par les variations inter-individuelles de la pharmacocinétique.
Autres enzymes. D’autres enzymes interviennent dans les réactions de type I. Ce sont les estérases, carboxylestérases et cholinestérases. Les carboxylestérases sont des enzymes microsomiales présentes dans de nombreux tissus, dont le foie. Elles comportent deux types principaux, hCE-1 et hCE-2. La hCE-1 métabolise la cocaïne, la mépéridine et l’héroïne. La hCE-2 hydrolyse l’héroïne en 6-monoacétylmorphine puis en morphine.
Les cholinestérases comportent l’acétylcholinestérase (AchE) et la butyrylcholinestérase ou pseudocholinestérase plasmatique.
Cette dernière intervient dans le métabolisme de la succinylcholine, du mivacurium, des anesthésiques locaux de type esters dont la cocaïne et l’héroïne. Le rémifentanil est hydrolysé par des estérases plasmatiques et surtout tissulaires, non spécifiques.
Réactions de type II
Les réactions de type I introduisent des groupes polaires dans la molécule, ce qui permet les réactions de conjugaison.
La morphine comporte d’emblée des groupes polaires et elle subit une conjugaison directe. Les principales enzymes de conjugaison sont les méthyltransférases, les sulfotransférases, les acétyltransférases, les acyltransférases, les glucuronosyltransférases ou glucuronyltransférases et les glutathion-S-transférases (Tableau 3). Les métabolites conjugués sont hydrosolubles et peuvent être éliminés par le rein et la bile.
Clairance
La clairance quantifie l’élimination du médicament du sang circulant.
Deux processus participent à cette clairance : la clairance systémique et la clairance intercompartimentale. La clairance systémique correspond à l’élimination définitive du médicament de l’organisme, soit sous forme inchangée, soit sous forme demétabolites. La clairance intercompartimentale représente les transferts du médicament entre le sang et les organes périphériques.
La clairance systémique ou plasmatique totale, définie en unité de flux, est le volume totalement épuré du médicament par unité de temps (l min–1). La quantité de médicament réellement éliminée par unité de temps est obtenue en multipliant la clairance plasmatique totale par la concentration plasmatique. La clairance plasmatique totale est souvent indexée au poids ou à la surface corporelle (ml min−1 kg−1 ou ml min−1m−2). Cette clairance est la somme de toutes les clairances des différents organes périphériques. Pour la plupart des médicaments anesthésiques, le foie est l’organe d’élimination principal, d’où l’importance de la clairance hépatique.
Clairance hépatique
Le foie est le principal organe d’élimination des médicaments, les exceptions notables étant les agents métabolisés par des enzymes plasmatiques ou tissulaires (succinylcholine, rémifentanil, curares benzylisoquinolines) et ceux excrétés par le rein (rocuronium, néostigmine). Pour la plupart des anesthésiques, le taux de métabolisme hépatique est proportionnel à la concentration du médicament dans le sang afférent (concentration qui est la moyenne des concentrations dans l’artère hépatique et dans la veine porte). Ceci veut dire que la clairance métabolique est habituellement constante et indépendante de la dose, c’est-à-dire qu’il n’y a pas de saturation des sites de métabolisme (cf. infra).
Cette hypothèse est vraie pour la plupart des situations et des anesthésiques.
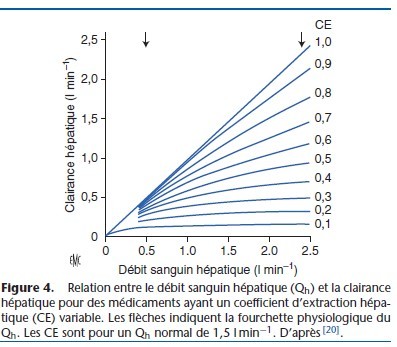
La quantité (R) d’un médicament éliminée par le foie correspond au débit sanguin hépatique multiplié par la différence de concentration entre le flux d’entrée (concentration afférente) et de sortie (concentration efférente) [18–20] :
R = Qh (Caff − Ceff)
Qh = débit hépatique afférent (somme des débits de l’artère hépatique et de la veine porte), valeur moyenne chez l’adulte : 1,4 l min−1 ; Caff = moyenne de la concentration dans l’artère hépatique et la veine porte ; Ceff = concentration dans les veines sus-hépatiques.
Si tout le médicament était capté par le foie lors d’un seul passage, la clairance hépatique serait égale au débit sanguin hépatique.
Mais le plus souvent, une certaine fraction du médicament n’est pas captée et quitte le foie par les veines sus-hépatiques.
La fraction captée par le foie est exprimée par le coefficient d’extraction (CE) qui est le rapport :
CE = Caff −Ceff/Caff
La clairance hépatique est :
Clh = Qh × CE = Qh ( Caff − Ceff/Caff)
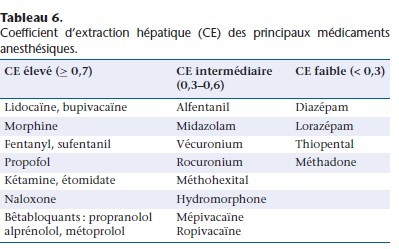
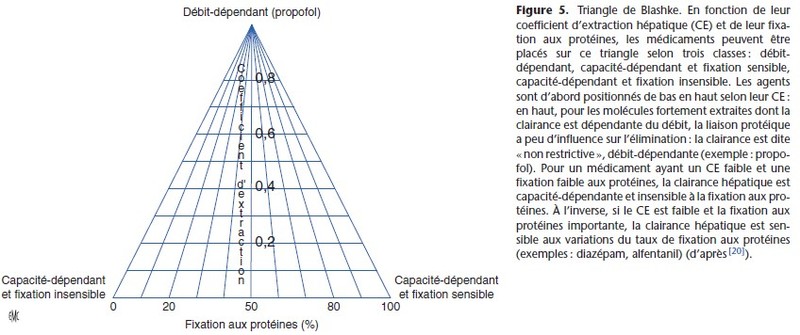
Le CE des anesthésiques est résumé dans le Tableau 6. La relation entre la clairance, le débit hépatique et le coefficient d’extraction est décrite dans la Figure 4 [18]. Si le CE est élévé (> 0,7) (proche de 1 pour le propofol), la clairance est proportionnelle au Qh (médicament à métabolisme débit-dépendant). Si le CE est inférieur à 0,3 (thiopental) ou intermédiaire (alfentanil), la clairance est peu dépendante du Qh, mais elle dépend des capacités métaboliques des hépatocytes (métabolisme capacité-dépendant). Les médicaments capacité-dépendants sont divisés en deux catégories selon leur taux de fixation aux protéines. Si la fixation aux protéines est importante (fraction libre faible), leur métabolisme hépatique est sensible aux variations de la fixation aux protéines (capacité-dépendant et fixation sensible). Les médicaments
capacité-dépendants, mais peu fixés aux protéines, ne sont pas sensibles aux variations de la fixation aux protéines. Le triangle de Blashke [20] permet de situer les anesthésiques selon leur CE et leur taux de fixation aux protéines (Fig. 5).
Clairance rénale
Le rein élimine la forme inchangée des médicaments hydrosolubles (vécuronium, rocuronium) et les métabolites hydrosolubles des médicaments liposolubles. L’élimination se fait par filtration glomérulaire et par sécrétion tubulaire. La pharmacocinétique de la plupart des anesthésiques est peu influencée par une modification
de la fonction rénale. Seuls les curares non dépolarisants stéroïdes sont partiellement éliminés par le rein. Certains médicaments comme le midazolam et la morphine ont des métabolites conjugués (α-hydroxymidazolam, morphine-6-glucuronide) qui sont éliminés plus lentement en cas d’insuffisance rénale et dont l’accumulation peut induire des effets secondaires.
Le rein contient de nombreuses enzymes dont le CYP (CYP3A4, CYP3A5), la glutathion-S-transférase, les estérases et les glucuronyltransférases.
Le rein contribue pour près de 30 % au métabolisme du propofol par glucuronoconjugaison.
Clairance tissulaire
D’autres tissus tels le sang, les muscles, le poumon et l’intestin possèdent les différentes enzymes (CYP, estérases, glucuronyltransférases, sulfotransférases, glutathion-S-transférases) capables de métaboliser les médicaments. À l’exception de certains médicaments comme le rémifentanil, ces tissus ont un rôle limité dans l’élimination des anesthésiques.
Effet de premier passage pulmonaire
Lorsqu’un médicament est administré par voie intraveineuse, il doit traverser le filtre pulmonaire avant d’atteindre la circulation artérielle systémique. Le poumon doté de fonctions métaboliques intervient dans le métabolisme de substances endogènes comme l’angiotensine et les catécholamines. Son rôle dans le métabolisme des anesthésiques est plus limité. En revanche, il capte certains médicaments et les relargue secondairement dans la circulation systémique par les veines pulmonaires. Cette captation transitoire réalise un véritable effet de premier passage pulmonaire. Ce phénomène qui a été identifié pour les opiacés et les anesthésiques locaux modifie la cinétique initiale de cesmédicaments. De plus, ce captage pulmonaire transitoire limite la toxicité systémique en cas d’injection intravasculaire accidentelle d’anesthésiques locaux [21–25].
Clairance plasmatique totale et aire sous la courbe
La clairance (Cl) plasmatique totale peut être calculée par la méthode de l’aire sous la courbe (ASC) (area under the curve [AUC]) qui utilise l’aire sous la courbe de la concentration du médicament au cours du temps. L’aire sous la courbe correspond à la mesure de l’intégrale des concentrations instantanées pendant un intervalle de temps, par exemple de 0 à l’∞. Pour un modèle monocompartimental, l’équation est :
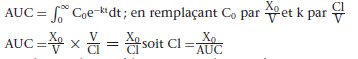
x0 = dose de médicament administrée au temps 0 ; C0 = concentration au temps 0 ; V = volume de distribution initial ; k = constante d’élimination.
Le calcul de l’aire sous la courbe s’applique aussi aux modèles multicompartimentaux pour les médicaments dont l’élimination est d’ordre 1, c’est-à-dire dont la clairance est constante. Le calcul de l’aire sous la courbe est indispensable pour définir la biodisponibilité d’un médicament administré par voie orale.
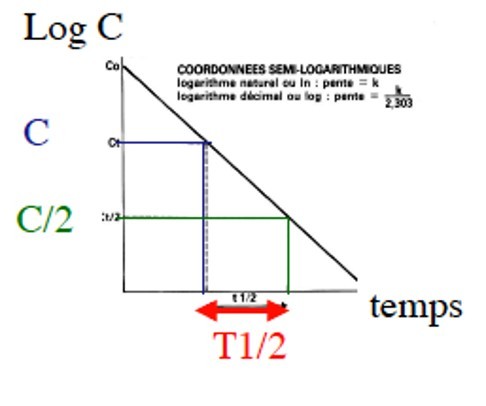
Demi-vie d’élimination
La partie terminale de la courbe de décroissance de la concentration plasmatique est linéaire et elle définit la demi-vie d’élimination (t1/2 ß ou t1/2 γ selon que le modèle est à deux ou trois compartiments) qui est le paramètre pharmacocinétique couramment utilisé pour préciser la vitesse d’élimination du médicament. La demi-vie est le temps nécessaire pour que la quantité de médicament présente dans l’organisme diminue de 50 %. Les variations de la demi-vie d’élimination sont dépendantes non seulement des processus d’élimination, mais aussi du volume de distribution selon la formule :
t1/2 = 0, 693 × Vd/Cl
Vd = volume de distribution ; Cl = clairance plasmatique totale.
En anesthésie, cette demi-vie d’élimination a moins d’intérêt puisqu’elle ne décrit pas la dissipation de l’effet pharmacologique.
Ainsi, la demi-vie d’élimination d’un bolus de propofol est de plusieurs heures alors que son effet clinique n’est que de quelques minutes.
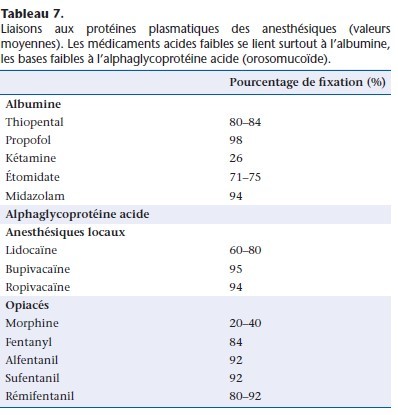
Fixation aux protéines
La plupart des anesthésiques se lient peu ou prou aux protéines plasmatiques (Tableau 7). L’albumine lie les molécules faiblement acides (thiopental, midazolam, propofol) et l’α1-glycoprotéine acide lie les molécules basiques (anesthésiques locaux, fentanyl et dérivés). D’autres constituants plasmatiques (lipoprotéines) et cellulaires (globules rouges) fixent à un moindre degré les médicaments [20, 26–28]. Dans la période périopératoire, les concentrations plasmatiques de ces deux protéines évoluent de fac¸on indépendante et souvent opposée, l’albumine baisse alors que l’α1-glycoprotéine, protéine de l’inflammation, augmente. La concentration plasmatique de l’albumine (35 à 50 g l−1) est plus élevée que celle de l’α1-glycoprotéine acide (0,4 à 1 g l−1) et donc ses capacités de fixation sont plus importantes. Dans une même situation clinique, on peut donc observer une augmentation de la fraction libre des anesthésiques fixés par l’albumine et une diminution de la fraction libre de ceux fixés par l’α1-glycoprotéine.
Effets sur la pharmacocinétique
Un effet bien identifié de la liaison aux protéines est la modification des paramètres pharmacocinétiques calculés, volume de distribution, clairance et demi-vie d’élimination. Si la fraction libre augmente, le gradient de diffusion du médicament entre le sang et les tissus augmente. La quantité de médicament captée par les tissus augmente et il en résulte une augmentation apparente du volume de distribution si celui-ci est calculé avec la concentration plasmatique totale du médicament et non sa
fraction libre (fu, u pour unbound). L’augmentation du volume de distribution calculé est surtout nette si la distribution tissulaire est importante, c’est-à-dire si le Vdss est élevé, ce qui est le cas des anesthésiques intraveineux.
Vdss = fu p / [fu tiss] × Vtiss + Vp
fu p = forme libre plasmatique ; fu tiss = forme libre tissulaire ; Vtiss = volume des tissus ; VP = volume plasmatique.
Si le volume tissulaire est nettement plus élevé que le volume plasmatique, la formule montre que toute variation de fu p entraîne une variation du Vdss.
En revanche, le volume de distribution de la forme libre (fu p) reste stable :
Vd (fu) = Vd (total) /fu p
fu p = fraction libre plasmatique ; Vd(fu) = volume de distribution de la forme libre ; Vd(total) = volume de distribution de la forme totale (libre et liée).
Par exemple, pour le thiopental, chez des patients en insuffisance rénale chronique avec hypoalbuminémie, la fu augmente de 15,7 à 28 %. Le volume de distribution calculé est de 3,0 l kg−1 si le calcul utilise la concentration plasmatique totale, mais de 1,5 l kg−1 si on utilise la fu, c’est-à-dire un Vd identique aux sujets à fonction rénale normale [29].
La variation de la fraction fixée aux protéines influence aussi la clairance calculée. Si le coefficient d’extraction hépatique est élevé, la fraction libre n’a pas d’influence sur le captage du médicament par le foie. En effet dans ce cas : Clint u × fu p >>> Qh (Clint u = clairance intrinsèque de la forme libre ; fu p = fraction plasmatique libre) et la Clh ≈Qh.
Si le CE est bas (Qh >>> Clint u × fu p) la relation est : Clh = fu p × Clint ; c’est-à-dire que la clairance dépend de la fu p et de la capacité intrinsèque du foie à métaboliser le médicament. Si la fu p augmente, la clairance augmente (médicaments dits « capacité-dépendants » et clairance restrictive).
Les variations de Vd et de la clairance se répercutent sur la demivie d’élimination. Pour les médicaments à CE élevé et si le volume de distribution tissulaire est important, la t1/2 dépend de la fu p selon l’équation : t1/2 ≈ [0,693 (fu p/fu tiss) × Vtiss]/Qh
Pour les médicaments à CE bas, la t1/2 est indépendante de fu p : t1/2 ≈ [0, 693 (Vtiss/fu tiss)] /Clint
Effets sur la pharmacodynamie
En théorie, l’augmentation de la forme libre s’accompagne d’un effet clinique augmenté. Néanmoins, pour les anesthésiques dont l’effet pharmacologique est surtout lié à la phase initiale de distribution, cette influence est limitée en raison de la dissociation rapide de la forme liée selon la loi d’action de masse :
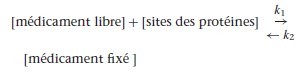
k1 et k2 sont les constantes de dissociation. Lorsque la concentration du médicament libre diminue, la réaction se déplace de la droite vers la gauche, c’est-à-dire dans le sens de la dissociation de la forme liée, et ainsi alimente le pool de la forme libre.
Un effet pharmacodynamique peut être observé pour les médicaments fortement fixés aux protéines, ayant un CE élevé et une équilibration pharmacocinétique/pharmacodynamique rapide comme c’est le cas des anesthésiques (propofol par exemple). Dans les modèles PK/PD intégrés dans les seringues
électriques pour l’administration des anesthésiques sur le mode AIVOC, les équations pharmacocinétiques devraient utiliser les concentrations sanguines libres et non les concentrationstotales. Peu de travaux ont évalué la précision améliorée de tels modèles.
Concepts pharmacocinétiques
Processus d’ordre zéro et d’ordre 1
Lorsque la variation d’un processus est constante en fonction du temps, le processus est dit « d’ordre zéro » (par exemple métabolisme de l’alcool éthylique). La dénomination « ordre zéro » signifie que la variation est proportionnelle à la puissance zéro de la variable, c’est-à-dire que la variation est constante : dx/dt = kx0 = k. La quantité de médicament éliminée est constante et ne dépend pas de la concentration.
La plupart des médicaments anesthésiques sont soumis à un processus d’ordre 1, ce qui signifie qu’une fraction constante du médicament est éliminée pendant une période déterminée et ceci indépendamment de la dose ou de la concentration du médicament. Un processus d’ordre 1 indique que les enzymes du métabolisme ne sont pas saturées. La fraction de médicament éliminée étant proportionnelle à la concentration plasmatique, la quantité éliminée est élevée quand la concentration est élevée et
plus faible lorsque la concentration est basse. La fraction éliminée est équivalente à la constante de vitesse d’élimination (rate constant) du processus. Les constantes d’élimination sont indiquées par la lettre k et ont comme unité l’inverse du temps, min−1 ou h−1. Ainsi, si 10 % du médicament sont éliminés par minute, la constante d’élimination k est égale à 0,1 min−1.
La valeur de la concentration x au temps t, x(t), est une intégrale du temps 0 au temps t :
x (t) = x0 × e–kt
xo = valeur de x au temps zéro.
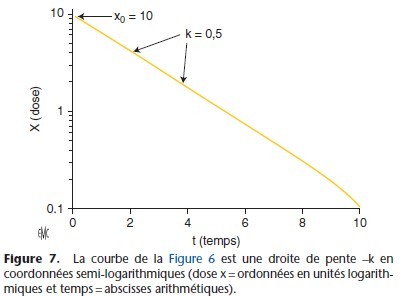
Si k est supérieur à zéro, x(t) augmente exponentiellement, si k est inférieur à zéro, x(t) diminue exponentiellement. En pharmacocinétique, k est négatif car la concentration diminue (Fig. 6, 7).
En coordonnées semi-logarithmiques, la courbe est une droite dont la pente est –k. Le temps nécessaire pour que la concentration xo diminue de 50 % est la demi-vie. En utilisant les logarithmes naturels, l’équation x(t) = xo × e–kt permet d’obtenir la relation : t1/2 = 0,693/k
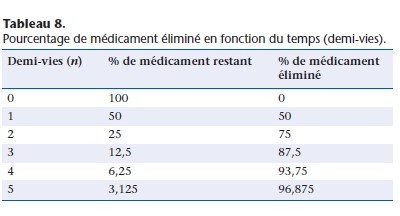
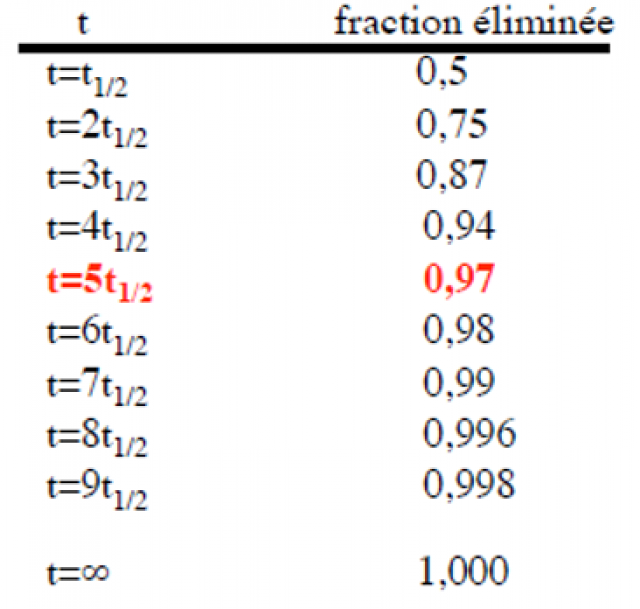
Pour les processus d’ordre 1, la décroissance de la concentration plasmatique du médicament étant exponentielle, l’élimination atteint 97 % de la dose administrée en cinq demi-vies (Tableau 8).
Les phénomènes de distribution entre les compartiments obéissent aussi aux lois des processus d’ordre 1 et le concept des constantes de distribution et de demi-vie s’appliquent avec les mêmes équations.
Modèles pharmacocinétiques
L’objectif des modèles pharmacocinétiques est de prédire chez un patient donné le plus précisément possible l’évolution des concentrations du médicament dans l’organisme en fonction de la dose et du mode d’administration. Même si les modèles pharmacocinétiques sont établis à partir d’études réalisées chez des patients représentatifs d’une population chirurgicale courante, il existe une discordance d’importance variable selon le modèle entre les concentrations prédites et celles réellement
mesurées [10, 11, 14, 15]. Néanmoins, les modèles décrits ci-dessous ont une précision acceptable en clinique pour le calcul de la dose (en bolus ou en perfusion) nécessaire pour atteindre et maintenir une concentration plasmatique prédéfinie. La prédiction de la cinétique des concentrations plasmatiques et au site d’action est encore améliorée par des ajustements appliqués aux modèles pharmacocinétiques classiques (cf. infra).
Modèles physiologiques
La pharmacocinétique peut être décrite en utilisant un modèle anatomique et physiologique basé sur la distribution du débit cardiaque vers les différents organes périphériques. Il est ainsi possible d’analyser les volumes et les clairances pour chaque organe et de construire un modèle pharmacocinétique pour l’organisme entier en associant les différents organes [3, 5]. Ces modèles sont complexes et difficiles à mettre en oeuvre car les mesures de tous les débits sanguins régionaux et des concentrations afférentes et efférentes ne sont pas réalisables chez l’homme [2, 5]. De plus, il a été montré que la précision de ces modèles physiologiques n’était pas
plus grande que celle des modèles compartimentaux. Un modèle physiologique simplifié est décrit (cf. supra) (Fig. 2).
Modèles pharmacocinétiques des compartiments
Les modèles compartimentaux simplifient les modèles physiologiques.
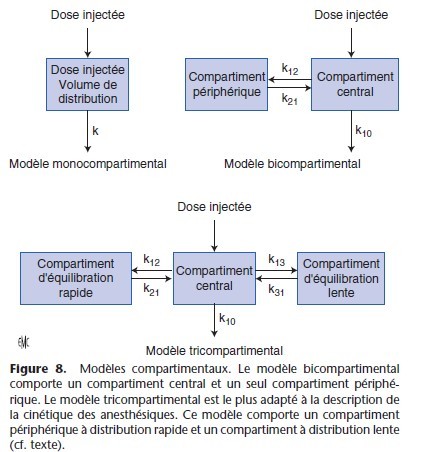
Dans ces modèles, les compartiments n’ont pas d’équivalents anatomiques stricts. Le modèle le plus simple est monocompartimental (Fig. 8) et contient un seul volume et une seule clairance. Pour les médicaments anesthésiques, le modèle bi ou tricompartimental est plus adapté (Fig. 8). Ces modèles multicompartimentaux, appelés modèles mamillaires, comportent un volume central sur lequel sont branchés des volumes périphériques.
La somme des volumes est le volume de distribution à l’état stable, Vdss.
Modèle monocompartimental
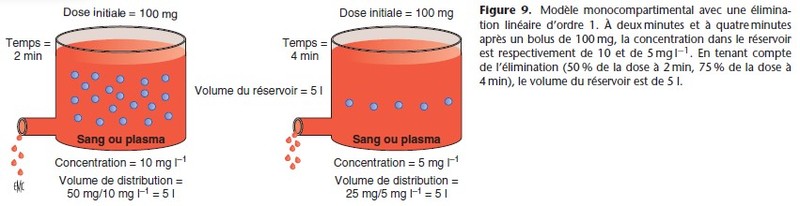
L’organisme est représenté par un réservoir unique et homogène dans lequel est injecté en bolus une quantité de substance xo (x au temps zéro) (Fig. 3). La concentration initiale est xo/V (V est le volume du réservoir). Si l’on veut obtenir la concentration cible
Ct (target), la dose à administrer est : dose = Ct × V
Si la substance est éliminée du réservoir à un taux constant (clairance), on a l’équation suivante :
dx / dt = x/V * Cl
dx/dt est le taux d’élimination de la substance en fonction du temps, x est la quantité de médicament présente dans l’organisme et Cl est la clairance.
Le processus d’élimination étant d’ordre 1 (Fig. 9), la pharmacocinétique est linéaire et le volume et la clairance sont constants :
Cl/V = k
k = constante de vitesse d’élimination.
En introduisant la demi-vie (équation t1/2 = 0,693/k), on obtient la relation :
t1/2 = 0, 693* V / Cl soit t1/2 ≈ V / Cl
Modèles multicompartimentaux
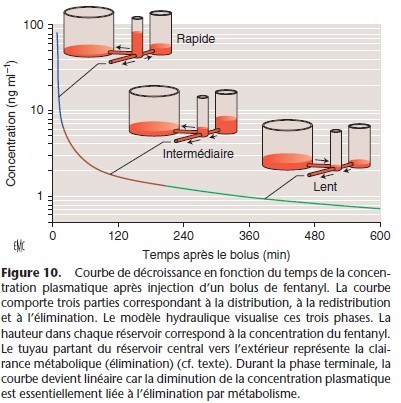
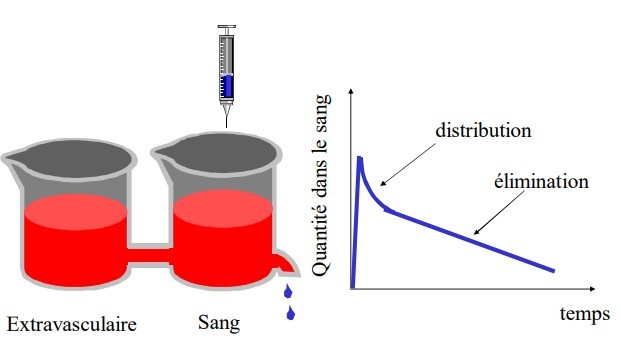
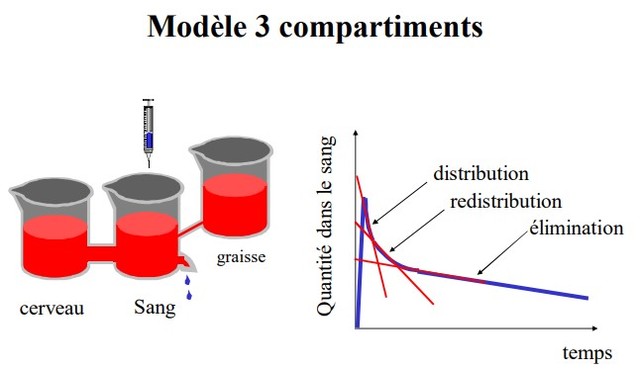
La pharmacocinétique des anesthésiques nécessite un modèle plus complexe que le modèle à un compartiment. La courbe exponentielle qui décrit l’évolution de la concentration plasmatique après l’administration d’un bolus comporte trois parties dont la pente diminue en fonction du temps (Fig. 10, 11). Les trois phases correspondent schématiquement à une phase de distribution rapide, une phase intermédiaire et une phase terminale.
La phase initiale correspond à la distribution à partir du compartiment central (volume sanguin circulant et premier passage pulmonaire) vers les tissus périphériques richement vascularisés.
La phase intermédiaire correspond à la distribution plus lente vers les tissus moyennement vascularisés et au retour du médicament à partir des tissus à équilibration rapide (début de la redistribution). La phase terminale est essentiellement la phase d’élimination, mais la redistribution a aussi lieu lors de cette phase. Durant cette phase d’élimination, la concentration plasmatique est inférieure à la concentration tissulaire, le médicament est transféré des tissus vers le plasma et du plasma il est éliminé
par le métabolisme et l’excrétion.
Le modèle tricompartimental peut être décrit par un modèle hydraulique à trois réservoirs (Fig. 10). Ce modèle, très didactique, a été développé par Mapleson pour les anesthésiques halogénés [30, 31]. Il visualise l’évolution des concentrations et les directions des flux entre les compartiments au cours du temps, la taille des réservoirs et le diamètre des tuyaux de connexion étant proportionnels, respectivement aux volumes des compartiments et aux débits sanguins régionaux.
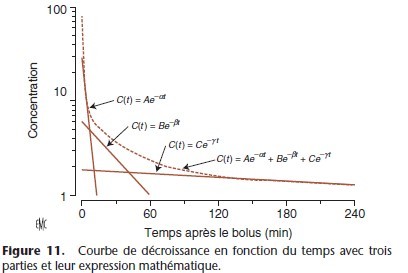
Dans le modèle tricompartimental, la courbe de décroissance de la concentration plasmatique en fonction du temps est décrite par la somme de trois exponentielles :
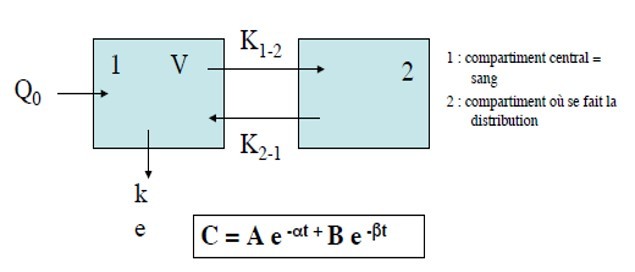
C(t) = Ae–αt + Be–ßt + Ce–γt
t = temps depuis le bolus ; C(t) = concentration au temps t après une dose bolus ; et A, α, B, ß, C, γ sont les paramètres du modèle pharmacocinétique.
Au temps 0 (t0) l’équation se simplifie : C0 = A + B + C
La somme des coefficients A, B et C est égale à la concentration immédiatement après l’injection d’un bolus.
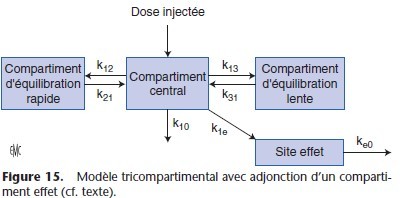
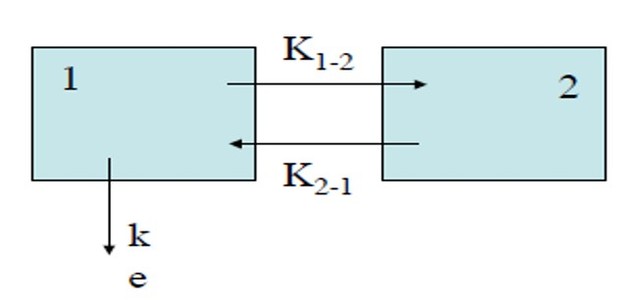
Dans sa représentation figurée, ce modèle comporte des microconstantes de transfert qui définissent le taux de transfert entre les différents compartiments (Fig. 8). Le compartiment 0 est en dehors du modèle et correspond à l’élimination : k10 est la microconstante de transfert qui définit l’élimination, c’est-à-dire la sortie définitive du médicament de l’organisme. Les microconstantes k12 et k21, k13 et k31 décrivent les transferts entre les compartiments périphériques et le compartiment central. Dans
le modèle hydraulique, les microconstantes de transfert correspondent aux tuyaux qui relient les réservoirs.
La raison principale de l’utilisation en clinique de l’équation triexponentielle est qu’elle décrit assez exactement l’évolution temporelle de la concentration plasmatique du médicament administré en bolus. Cependant, ce modèle tricompartimental est peu précis dans sa prévision de la concentration plasmatique au tout début de l’injection (bolus ou perfusion). Durant cette phase initiale, la concentration plasmatique varie rapidement et le concept de cinétique précoce (front-end kinetics) introduit lesphénomènes de recirculation précoce et décrit la pharmacocinétique dans les premières minutes, période essentielle puisque c’est la phase d’installation de l’effet pharmacologique [32]. Le modèle classique admet que le médicament introduit dans le volume central (Vc) est dilué presque instantanément et de fac¸on homogène dans ce volume. Si initialement le volume central peut être assimilé au volume sanguin circulant, dans la réalité il varie dans le temps et augmente en fonction des conditions physiologiques et des propriétés physicochimiques du médicament. Ceci explique que plus la mesure de la concentration sanguine est précoce, plus petit est le volume central calculé. La plupart des modèles pharmacocinétiques surestiment le Vc car ils ne prennent pas en compte la complexité de la mixique initiale. Si ces modèles où le Vc est surestimé sont utilisés dans les logiciels de l’AIVOC, la concentration sanguine réelle dépasse la concentration cible au début de la mise en route, mais aussi ultérieurement. Les modèles pharmacocinétiques qui tiennent compte de la recirculation précoce se sont révélés plus précis pour une utilisation en mode AIVOC [32].
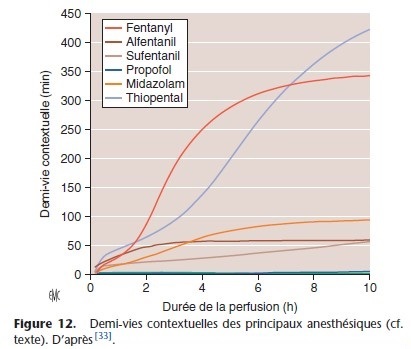
Cinétique terminale et demi-vie contextuelle
En clinique, il est intéressant de connaître la cinétique de décroissance de la concentration plasmatique à l’arrêt d’une perfusion continue car elle permet de prédire le délai de réveil. Cette cinétique terminale (back-end kinetics) est représentée par le temps de décroissance ou temps nécessaire pour que la concentration plasmatique atteigne une certaine valeur, par exemple pour le propofol, la concentration pour laquelle le sujet répond aux ordres simples. Le temps de décroissance dépend de la durée de perfusion
et s’allonge avec celle-ci. Cet allongement est le témoin d’une accumulation du médicament dans les tissus périphériques.
Le temps de décroissance de 50 %, temps nécessaire pour que la concentration plasmatique au moment de l’arrêt de la perfusion diminue de moitié, est la demi-vie contextuelle (Fig. 12) [33]. Plus la demi-vie contextuelle est courte, plus rapide est le réveil. En pratique, il est souvent plus intéressant de connaître le temps de
décroissance à 90 %, concentration plus proche de celle nécessaire à la dissipation de l’effet clinique.
Pharmacocinétique de population
Un des objectifs des modèles pharmacocinétiques est l’utilisation optimale des anesthésiques selon leurs diverses modalités d’administration (bolus unique, bolus itératifs, perfusionintraveineuse avec ou sans objectif de concentration). Les modèles pharmacocinétiques et leurs équations d’application décrits ci-dessus sont dérivés de mesures réalisées chez des sujets sains ou chez des groupes de patients définis. Lorsque ces modèles sont appliqués à tous les patients chirurgicaux, on constate unécart entre les paramètres prédits et ceux réellement mesurés, une variation de près de 100 % n’étant pas rare. La variabilité pharmacodynamique est même plus importante puisqu’il est
fréquent d’observer que pour un effet donné, la concentration plasmatique nécessaire varie de 1 à 5, voire plus chez certains sujets [14, 15]. Cette variabilité n’est pas gênante pour les anesthésiques ayant une marge de sécurité importante. En revanche, lorsque l’anesthésique a des effets secondaires (dépression cardiovasculaire, dépression ventilatoire), une titration plus précise est nécessaire. Diverses solutions sont proposées pour améliorer la prévision statistique des modèles pharmacocinétiques.
Parmi celles-ci, il y a la pharmacocinétique de population et la méthode bayésienne [34–36]. L’analyse de population a pour objectif d’intégrer les variations inter-individuelles des paramètres pharmacocinétiques et des effets pharmacodynamiques.
L’approche bayésienne (Bayes 1702–1761) est une méthode statistique qui pondère la contribution de chaque individu à l’estimation des paramètres de la population globale. La méthode bayésienne utilise un modèle de régression non linéaire, dont un logiciel d’application, dénommé par l’acronyme NONMEM (non-linear mixed effects modeling), a été introduit par Sheiner et Beal en 1979 [37]. Cette méthode, très largement utilisée, analyse une population comportant un nombre important de sujets et a pour avantage de ne nécessiter qu’un nombre réduit de mesures de la concentration sanguine du médicament chez un sujet donné. En revanche, son inconvénient est de recourir à des calculs complexes. Néanmoins, cette méthode est très utilisée pour l’analyse des études pharmacocinétiques et leurs applications cliniques.
Pharmacodynamie
Ce qui intéresse le clinicien, c’est le profil cinétique de l’action pharmacodynamique de l’anesthésique, c’est-à-dire le délai d’installation, l’intensité de l’effet et sa durée. En grande partie ce profil cinétique dépend de l’évolution de la concentration efficace (CE ou EC effective concentration) de l’anesthésique au site d’action. Cette concentration n’étant pas mesurable en pratique, elle est assimilée à la concentration plasmatique.
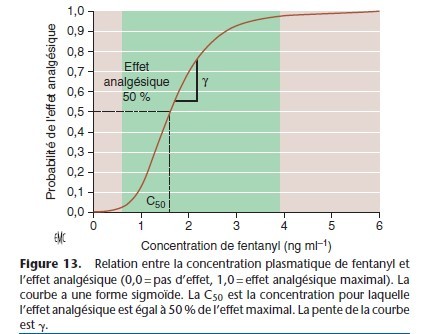
Pour la plupart des médicaments, dont les anesthésiques, la relation entre la concentration plasmatique et l’intensité de l’effet est décrite par une courbe sigmoïde (Fig. 13). L’équation standard qui décrit cette relation est l’équation de Hill :
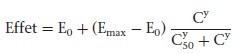
E0 = effet en l’absence du médicament ; Emax = effet maximal ; C est la concentration ou la dose ; γ est le coefficient de Hill qui représente la pente de la courbe dans sa partie dynamique ; C50 est la concentration pour laquelle l’effet est égal à 50 % de l’effet maximal.
À la phase initiale de l’administration d’un anesthésique (en bolus ou en perfusion continue), il y a un délai dans l’installation de l’effet clinique qui est lié à la distribution de l’agent, à sa pénétration tissulaire, sa fixation au récepteur et à l’induction des processus intracellulaires qui déclenchent l’effet pharmacologique.
Ce décalage entre concentration plasmatique (Cp) et effet est aussi observé dans la phase de régression de l’effet clinique.
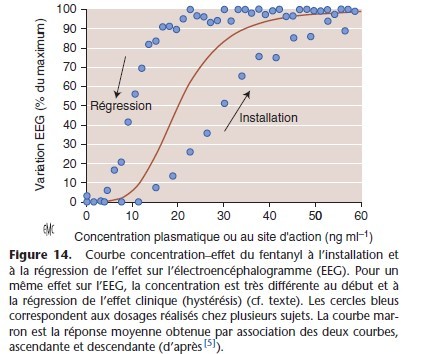
Ce décalage entre Cp et effet clinique se traduit sur la courbe concentration–effet par un hystérisis, c’est-à-dire que pour une même concentration plasmatique, l’effet est plus important au moment de la décroissance de la concentration plasmatique (Fig. 14).
Le site d’action, le plus souvent un récepteur, est situé dans la biophase qui est en dehors des compartiments du modèle pharmacocinétique standard.
Pour décrire la relation PK/PD, il est nécessaire d’adjoindre au modèle tricompartimental un compartiment supplémentaire appelé compartiment « site effet » (Fig. 15). Les transferts de l’anesthésique entre le compartiment « site effet » et le compartiment central sont décrits avec des microconstantes de transfert k1e (transfert du volume central vers le site effet) et ke0 (élimination du site effet). La concentration au site d’action (Ce) est une concentration théorique car le compartiment « site effet » n’a pas de volume estimé et la quantité de médicament transférée du volume central vers le site effet est négligeable. L’équation qui relie la concentration plasmatique à la concentration au site d’action est :
dCe / dt = ke0 × ( Cp − Ce)
Ce = concentration au site d’action ; Cp = concentration plasmatique, ke0 = constante d’élimination du site d’action.
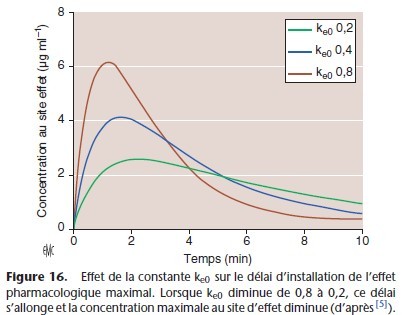
La demi-vie d’équilibration entre le plasma et le site d’action est 0,693/ke0. Ainsi, la constante ke0 influence de fac¸on importante la cinétique d’installation de l’effet clinique, la dose requise pour un certain effet clinique et le délai de dissipation de l’effet (Fig. 16).
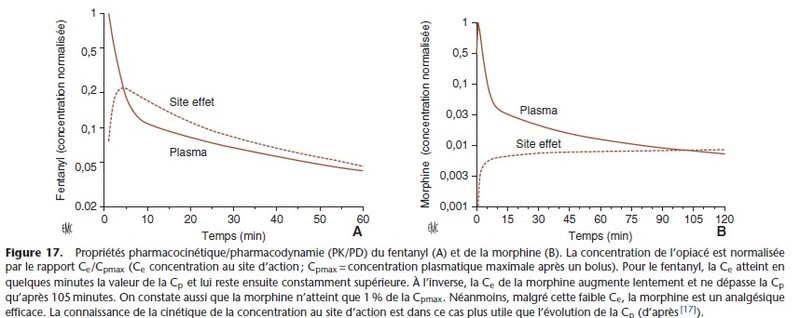
L’évolution des concentrations plasmatiques et des concentrations au site d’action du fentanyl et de la morphine objective les propriétés PK/PD très différentes des deux opioïdes (Fig. 17).
Interactions pharmacologiques des agents anesthésiques
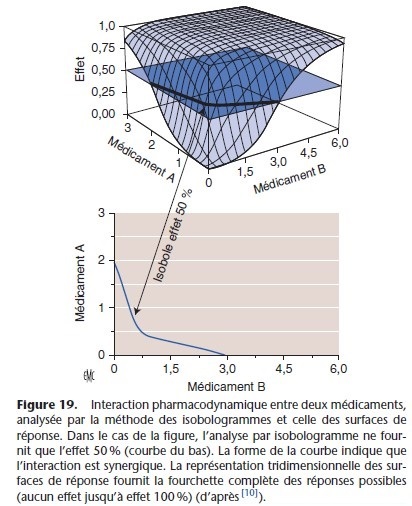
L’interaction entre deux anesthésiques, habituellement de classes pharmacologiques différentes, en fonction de leur dose est illustrée de fac¸on graphique par la méthode isobolographique.
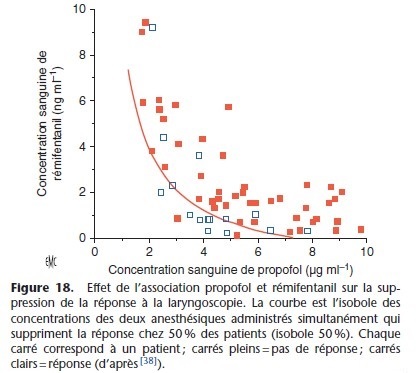
Les isobologrammes sont les courbes des isoboles qui représentent l’évolution de l’effet pharmacologique en fonction desconcentrations plasmatiques (par exemple les CE50, concentration efficace 50 %) des deux anesthésiques. L’isobole représente les différentes doses (ou concentrations) des deux anesthésiques qui lorsqu’ils sont associés aboutissent au même effet (Fig. 18) [38].
La forme de la courbe isobole identifie la nature de l’interaction entre les deux anesthésiques : interaction additive si la relation est une droite et synergique si la courbe est une hyperbole.
L’association propofol–rémifentanil est synergique comme le montre la Figure 18.
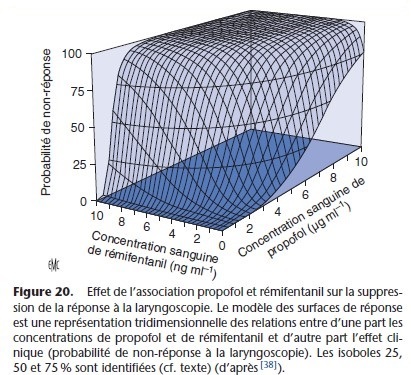
La représentation tridimensionnelle du concept des isoboles est la méthode des surfaces de réponse (response surface). Celle-ci en regroupant différentes isoboles objective la relation entre une variable dépendante (effet pharmacodynamique) et deux entrées (concentrations plasmatiques de deux anesthésiques administrés simultanément). Cette représentation graphique précise les concentrations plasmatiques de deux anesthésiques, qui lorsqu’ils sont administrés simultanément, permettent d’obtenir l’effet
pharmacologique souhaité (Fig. 19, 20). Ce modèle est appliqué à l’administration de deux anesthésiques en mode AIVOC. Il permet d’adapter les doses aux différents temps opératoires (intubation, incision, maintenance et réveil) en évitant les sous- ou surdosages.
Ce modèle est très pratique pour utiliser l’association optimale permettant un réveil rapide [9, 13, 38].
Pharmacogénétique
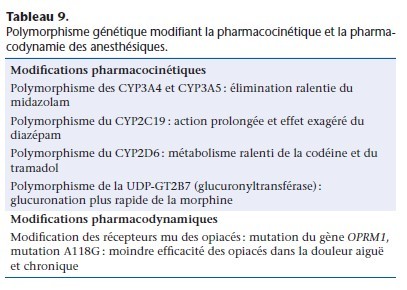
La variabilité interindividuelle de l’action des médicaments est expliquée par de nombreux facteurs, pharmacocinétiques et pharmacodynamiques. Dans certains cas, cette variabilité est liée au polymorphisme génétique des enzymes du métabolisme ou des protéines régulant l’activité des récepteurs (Tableau 9) [39–41].
Les variations des pseudocholinestérases plasmatiques ou butyrylcholinestérases, responsables de curarisations prolongées lors de l’administration de succinylcholine, sont connues depuis 1956.
En anesthésie, les variations génétiques ayant un impact pratique sont surtout celles qui modifient l’activité du système des CYP, dont le CYP3A4. Celui-ci est le CYP le plus abondant dans le foie et l’intestin et il intervient dans le métabolisme de nombreuxanesthésiques (opiacés, benzodiazépines, anesthésiques locaux).
Parmi les nombreuses mutations du CYP3A4, seule la mutation CYP3A4*18 qui diminue le métabolisme et le CYP3A4*19 qui augmente le métabolisme ont une importance clinique. Des variants génétiques ont été décrits pour le CYP2C19 et le CYP2D6 (aussi appelé débrisoquine hydroxylase). Environ 10 % des sujets sont
homozygotes pour un variant inactif du CYP2D6. Chez ces individus, la codéine, l’oxycodone et l’hydrocodone n’ont pas d’action analgésique du fait de l’absence de transformation en métabolite actif par O-méthylation. Une autre mutation du CYP2D6 accélère le métabolisme (métaboliseurs rapides) de ces opiacés, aboutissant
à une concentration plasmatique augmentée et à un risque de surdosage.
Conclusion
Les modèles pharmacocinétiques et leur application pratique permettent l’utilisation optimale des anesthésiques administrés en bolus ou en perfusion continue. L’introduction de diverses modifications dont la pharmacocinétique des populations et l’application du concept PK/PD a amélioré la précision des techniques d’administration, notamment selon le mode AIVOC
Références
[1] Gupta DK, Henthorn TK. Pharmacologic principles. In: Barash PG, Cullen BF, Stoelting RK, Cahalan MK, editors. Clinical Anesthesia. Philadelphia PA: Wolters Kluwers, Lippincott-Williams and Wilkins; 2009, p. 137–64.
[2] Shafer SL, Flood P, Schwinn DA. Basic principles of pharmacology. In: Miller RD, Eriksson LI, Fleisher LA, Wiener-Kronish JP, Young WL, editors. Miller’s Anesthesia. Philadelphia: Churchill Livingstone- Elsevier; 2010, p. 479–513.
[3] Schnider TW, Minto CF. Principles of drug action. Principles of pharmacokinetics. In: Evers AS, Maze M, Kharasch ED, editors. Anesthetic pharmacology. Basic principles and clinical practice. Cambridge: Cambridge University Press; 2011, p. 57–71.
[4] Servin F, Sear JW. Essential drugs in anesthetic practice. Pharmacokinetics of intravenous anesthetics. In: Evers AS, Maze M, Kharasch ED, editors. Anesthetic pharmacology. Basic principles and clinical practice. Cambridge: Cambridge University Press; 2011, p. 420–43.[5] Kim TK, Obara S, Johnson KB. Basic principles of pharmacology. In: Miller RD, Neal NH, Eriksson LI, Fleisher LA, Wiener-Kronish JP, Young WL, editors. Miller’s Anesthesia. Philadelphia: Saunders Elsevier; 2015, p. 590–613.
[6] Forman SA. Principles of drug action. Pharmacodynamic principles of drug action. In: Evers AS, Maze M, Kharasch ED, editors. Anesthetic pharmacology. Basic principles and clinical practice. Cambridge: Cambridge University Press; 2011, p. 1–16.
[7] Egan TD, Minto CF. Principles of drug action. Pharmacodynamic drug interactions in anesthesia. In: Evers AS, Maze M, Kharasch ED, editors. Anesthetic pharmacology. Basic principles and clinical practice. Cambridge: Cambridge University Press; 2011, p. 147–65.
[8] Shafer SL, Gregg KM. Algorithms to rapidly achieve and maintain stable drug concentrations at the site of drug effect with a computer-controlled infusion pump. J Pharmacokinet Biopharm 1992;20:147–69.
[9] Struys MM. Optimizing iv. drug administration by applying pharmacokinetic/pharmacodynamic concepts. Br J Anaesth 2011;107: 38–47.
[10] Struys MM, Absalom AR, Shafer SL. Intravenous drug delivery systems. In: Miller RD, Neal NH, Eriksson LI, Fleisher LA, Wiener-Kronish JP, Young WL, editors. Miller’s Anesthesia. Philadelphia: Saunders Elsevier; 2015, p. 920–57.
[11] Vuyk J, Sitsen E, Reekers M. Intravenous anesthetics. In: Miller RD, Neal NH, Eriksson LI, Fleisher LA, Wiener-Kronish JP, Young WL, editors. Miller’s Anesthesia. Philadelphia: Saunders Elsevier; 2015, p.821–63.
[12] Price HL. A dynamic concept of the distribution of thiopental in the human body. Anesthesiology 1960;21:40–5.
[13] Shafer SL, Varvel JR. Pharmacokinetics, pharmacodynamics, and rational opioid selection. Anesthesiology 1991;74:53–63.
[14] Minto CF, Schnider TW, Egan TD, Youngs E, Lemmens HJ, Gambus PL, et al. Influence of age and gender on the pharmacokinetics and pharmacodynamics
of remifentanil. I. Model development. Anesthesiology 1997;86:10–23.
[15] Minto CF, Schnider TW, Shafer SL. Pharmacokinetics and pharmacodynamics of remifentanil. II. Model application. Anesthesiology 1997;86:24–33.
[16] Kharasch ED. Principles of drug action. Principles of drug biotransformation. In: Evers AS, Maze M, Kharasch ED, editors. Anesthetic pharmacology. Basic principles and clinical practice. Cambridge: Cambridge University Press; 2011, p. 72–89.
[17] Gupta DK, Krejcie TC, Avram MJ. Essential drugs in anesthetic practice. Pharmacokinetics of opioids. In: Evers AS, Maze M, Kharasch ED, editors. Anesthetic pharmacology. Basic principles and clinical practice. Cambridge: Cambridge University Press; 2011, p. 509–30.
[18] Wilkinson GR, Shand DG. A physiologic approach to hepatic drug clearance. Clin Pharmacol Ther 1975;18:377–90.
[19] Nies AS, Shand DG, Wilkinson GR. Altered hepatic blood flow and drug disposition. Clin Pharmacokinet 1976;1:135–55.
[20] Blaschke TF. Protein binding and kinetics of drugs in liver diseases. Clin Pharmacokinet 1977;2:32–44.
[21] Tucker GT, Boas RA. Pharmacokinetic aspects of intravenous regional anesthesia. Anesthesiology 1971;34:538–49.
[22] Löfström JB. Tissue distribution of local anesthetics with special reference to the lung. Int Anesthesiol Clin 1978;16:53–71.
[23] Jorfeldt L. Lung uptake of lidocaine in healthy volunteers. Acta Anaesthesiol Scand 1979;23:567–74.
[24] Roerig DL, Kotrly KJ, Vucins EJ, Ahlf SB, Dawson CA, Kampine JP. First pass uptake of fentanyl, meperidine and morphine in the human lung. Anesthesiology 1987;67:466–72.
[25] Boer F. Drug handling by the lungs. Br J Anaesth 2003;91:50–60.
[26] Wood M. Plasma drug binding: implications for anesthesiologists. Anesth Analg 1986;65:786–804.
[27] Benet LZ, Hoener BA. Changes in plasma protein binding have little clinical relevance. Clin Pharmacol Ther 2002;71:115–21.
[28] Schmidt S, Gonzalez D, Derendorf H. Significance of protein binding in pharmacokinetics and pharmacodynamics. J Pharm Sci 2010;99:1107–22.
[29] Burch PG, Stanski DR. Decresased protein binding and thiopental kinetics. Clin Pharmacol Ther 1981;30:636–43.
[30] Mapleson WW. Circulation-time models of the uptake of inhaled anaesthetics and data for quantifying them. Br J Anaesth 1973;45:319–34.
[31] Davis NR, Mapleson WW. Structure and quantification of a physiological model of the distribution of injected agents and inhaled anaesthetics. Br J Anaesth 1981;53:399–406.
[32] Avram MJ, Krejcie TC. Using front-end kinetics to optimize targetcontrolled drug infusions. Anesthesiology 2003;99:1078–86.
[33] Hughes M, Glass P, Jacobs R. Context-sensitive half time in multicompartment pharmacokinetic models for intravenous anesthetic drugs. Anesthesiology 1992;76:334–41.
[34] Maitre PO, Stanski DR. Bayesian forecasting improves the prediction of intraoperative plasma concentrations of alfentanil. Anesthesiology 1988;69:652–9.
[35] Minto CF, Schnider TW. Expanding clinical applications of population pharmacodynamic modeling. Br J Clin Pharmacol 1998;46:321–33.
[36] Wright PM. Population based pharmacokinetic analysis: why do we need it; what it is; and what it has told us about anaesthetics. Br J Anaesth 1998;80:488–501.
[37] Sheiner LB, Beal S, Rosenberg B, Marathe VV. Forecasting individual pharmacokinetics. Clin Pharmacol Ther 1979;26:294–305.
[38] Mertens MJ, Olofsen E, Engbers FH, Burm AG, Bovill JG, Vuyk J. Propofol reduces perioperative remifentanil requirements in a synergistic manner: response surface modeling of perioperative remifentanilpropofol interactions. Anesthesiology 2003;99:347–59.
[39] Hogan K. Principles of drug action. Principles of pharmacogenetics. In: Evers AS, Maze M, Kharasch ED, editors. Anesthetic pharmacology. Basic principles and clinical practice. Cambridge: Cambridge University Press; 2011, p. 132–46.
[40] Landau R, Bollag LA, Kraft JC. Pharmacogenetics and anaesthesia: the value of genetic profiling. Anaesthesia 2012;67:165–79.
[41] Vuilleumier PH, Stamer UM, Landau R. Pharmacogenomic considerations in opioid analgesia. Pharmacogenomics Pers Med 2012;5:73–87.
Bases pharmacocinétiques de la voie IV
Dr. Karine TITIER Laboratoire de Pharmacologie, CHU Bordeaux- Arrangement BMS
Rappel
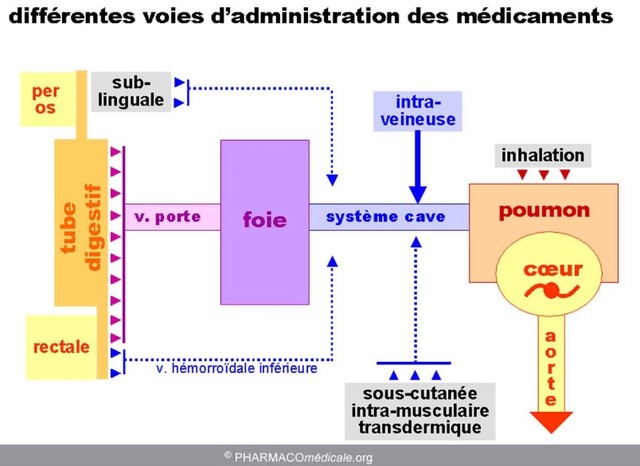
Lorsqu'un médicament est administré, il doit parvenir à la circulation centrale (système sanguin) pour être distribué à travers le corps et atteindre son site d'action. Il existe différentes voies d'administration des médicaments qui permettent d'atteindre cet objectif. Voici pour rappel les principales voies d'administration :
Voie orale : C'est la voie d'administration la plus courante. Les médicaments sont pris par la bouche sous forme de comprimés, de gélules, de sirops, etc. Ils passent ensuite par l'estomac et l'intestin, où ils sont absorbés dans la circulation sanguine à travers la paroi intestinale.
Voie sublinguale : Certains médicaments peuvent être placés sous la langue, où ils se dissolvent et sont absorbés à travers les vaisseaux sanguins de la muqueuse sublinguale. Cette voie permet d'éviter le passage par le système digestif, ce qui peut entraîner une absorption plus rapide du médicament.
Voie rectale : Les médicaments peuvent être administrés par voie rectale sous forme de suppositoires ou d'onguents rectaux. Ils sont absorbés à travers la muqueuse rectale et atteignent la circulation systémique.
Voie transdermique : Certains médicaments sont formulés sous forme de patchs ou de gels qui sont appliqués sur la peau. Les principes actifs traversent la barrière cutanée et pénètrent dans les vaisseaux sanguins situés dans le derme, atteignant ainsi la circulation sanguine.
Voie respiratoire : Certains médicaments peuvent être inhalés sous forme de gaz, de poudres ou d'aérosols. Ils pénètrent dans les poumons, où ils sont absorbés à travers les parois des alvéoles pulmonaires et atteignent la circulation sanguine.
Voie intraveineuse (IV) : Les médicaments administrés par voie intraveineuse sont injectés directement dans une veine à l'aide d'une aiguille ou d'un cathéter. Cela permet une administration rapide et précise du médicament, qui atteint immédiatement la circulation sanguine.
Voie intramusculaire (IM) : Les médicaments administrés par voie intramusculaire sont injectés dans un muscle à l'aide d'une seringue et d'une aiguille. Le médicament est ensuite absorbé à travers les vaisseaux sanguins présents dans le muscle et atteint la circulation systémique.
Voie sous-cutanée (SC) : Les médicaments administrés par voie sous-cutanée sont injectés dans le tissu situé sous la peau, généralement dans la région du bras, de l'abdomen ou de la cuisse. Le médicament est progressivement absorbé à travers les vaisseaux sanguins et atteint la circulation sanguine.
Ces différentes voies d'administration des médicaments offrent des avantages et des inconvénients selon les médicaments et les situations cliniques. Le choix de la voie d'administration dépendra de plusieurs facteurs, tels que la nature du médicament, la vitesse d'action souhaitée, la condition du patient etc...
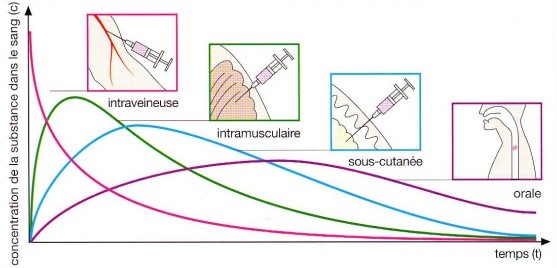
La concentration des substances dans le sang varie en fonction de la voie d'administration utilisée pour administrer un médicament. Les voies d'administration courantes telles que l'administration intraveineuse (IV), sous-cutanée (SC), intramusculaire (IM) et orale présentent des profils de concentration sanguine distincts :
Voie intraveineuse (IV) : Lorsqu'un médicament est administré par voie intraveineuse, il est injecté directement dans une veine, ce qui permet une absorption immédiate dans la circulation sanguine. En conséquence, la concentration sanguine atteint rapidement un pic élevé, offrant un contrôle précis de la dose administrée. Cette voie permet également de contourner les barrières digestives et d'obtenir une biodisponibilité maximale du médicament.
Voie intramusculaire (IM) : Lorsqu'un médicament est administré par voie intramusculaire, il est injecté directement dans un muscle. L'absorption se produit à partir des vaisseaux sanguins présents dans le muscle, ce qui peut entraîner une augmentation plus lente de la concentration sanguine par rapport à l'administration intraveineuse. Cependant, la concentration sanguine peut rester élevée pendant une période prolongée, en fonction des caractéristiques spécifiques du médicament.
Voie sous-cutanée (SC) : Lorsqu'un médicament est administré par voie sous-cutanée, il est injecté dans le tissu situé sous la peau. L'absorption se fait progressivement à travers les vaisseaux sanguins présents dans cette zone, entraînant une augmentation lente de la concentration sanguine. Cependant, une fois absorbé, le médicament peut maintenir une concentration sanguine relativement stable sur une période prolongée.
Voie orale : L'administration orale est la voie d'administration la plus courante. Les médicaments sont pris par la bouche et traversent le système digestif. La vitesse et le degré d'absorption peuvent varier en fonction de nombreux facteurs, tels que la formulation du médicament et la présence de nourriture dans l'estomac. La concentration sanguine du médicament atteint généralement un pic plus lentement par rapport aux voies d'administration injectables, en raison du processus de digestion et d'absorption. Cependant, l'administration orale permet une administration pratique et une biodisponibilité variable selon les médicaments.
En conclusion, la voie d'administration d'un médicament influence la concentration des substances dans le sang. L'administration intraveineuse offre une absorption rapide et un contrôle précis, tandis que les voies sous-cutanée, intramusculaire et orale entraînent des profils de concentration sanguine plus progressifs. Il est important de noter que les caractéristiques spécifiques du médicament, telles que sa solubilité, sa biodisponibilité et son métabolisme, peuvent également influencer la concentration sanguine après l'administration
Flux sanguin tissulaire adulte
|
Débit cardiaque |
5 400 ml/mn |
|
Foie |
1 700 ml/mn |
|
Rein |
1 000 ml/mn |
|
SNC |
800 ml/mn |
|
Graisse |
250 ml/mn |
PHARMACOCINÉTIQUE
Etude descriptive et quantitative du devenir des médicaments dans l’organisme
Evolution des concentrations en fonction du temps
ADME ⇒ Paramètres PK
But : Etablissement et adaptation de la posologie (dose + rythme)
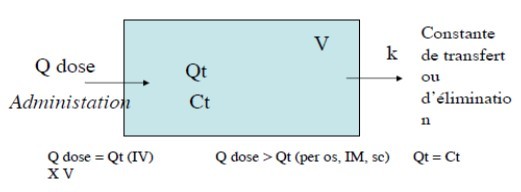
Principe
Paramètres PK sont calculés à partir d’un modèle mathématique composé de compartiments dans lesquels le médicament se distribue et diffuse de l’un à l’autre.
- Modèle monocompartimental
- Modèles à 2 compartiments
A chaque instant Qt évolue (élimination, échange avec d’autres compartiments) : dQ/dt
En PK, on suit à chaque instant dQ/dt
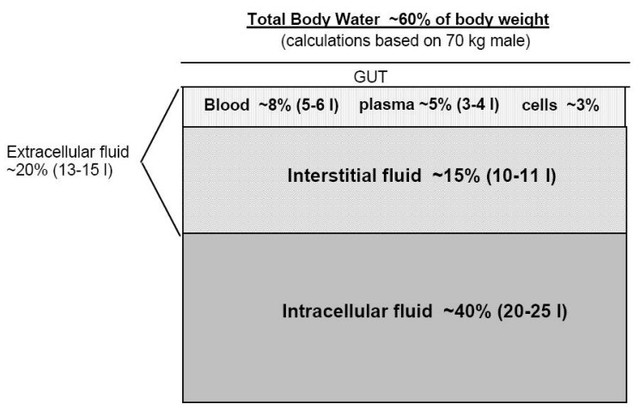
L’état d’ionisation
L’eau est un solvant polaire, et les molécules dissoutes dans l’eau sont ionisées. Seule la forme non ionisée d’un médicament (si elle est suffisamment liposoluble) est capable de passer la membrane cellulaire.
L’état d’ionisation dépend du pKA de la molécule et du pH du milieu.
Le pKA est défini comme le pH pour lequel un acide se présente à 50% sous forme non ionisée et 50% sous forme ionisée.
Le rapport forme ionisée/non ionisée est défini par les équations d’Henderson-Hasselbach.
Base faible : pH = pKa + log [B]/[BH+]
Acide faible : pH = pKa + log [A-]/[AH]
Pour un acide faible :
- à pH alcalin : l’ionisation est importante, d’où une fraction ionisée plus grande, ce qui limitera le passage transmembranaire de cette substance,
- à pH acide : l’ionisation est faible, la fraction non ionisée plus importante, le médicament passera mieux les membranes cellulaires.
Pour une base faible on observera l’inverse :
- à pH alcalin : l’ionisation est faible, le médicament passera bien les membranes cellulaires,
- à pH acide : l’ionisation sera plus importante, d’où une fraction ionisée plus grande, le médicament passera mal les membranes cellulaires.
La diffusion
La diffusion du médicament à travers une membrane biologique répond à une équation de type exponentielle
Equations qui décrivent la PK des médicaments dans l’organisme sont des sommes d’exponentielles dans lesquelles les constantes représentent et quantifient les vitesses de résorption, de transfert entre compartiment et d’élimination du médicament.
Nombre d’exponentielles = nombre de compartiments
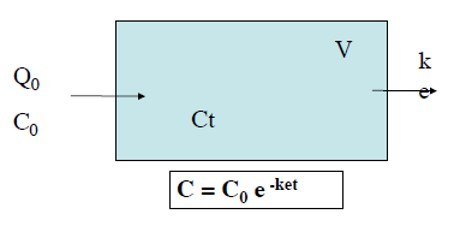
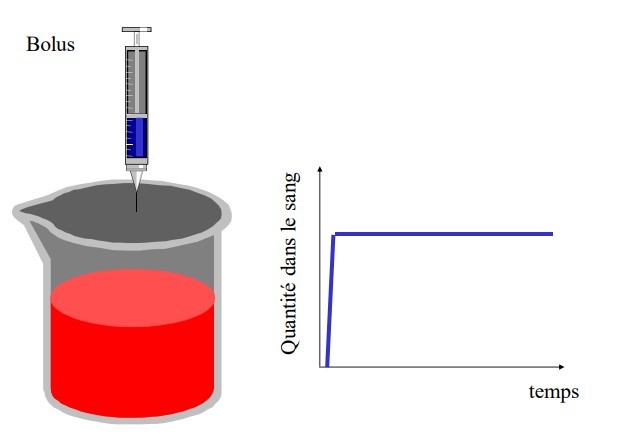
Administration à dose unique en I.V.
Modèle ouvert à un compartiment
Par conséquent, selon le pH du milieu où se trouve le médicament, (plasma : pH 7,4 ; estomac : pH 2,0 ; jéjunum : pH 8,0) son rapport fraction ionisée / fraction non ionisée varie.
C0 se répartit dans V de façon homogène à chaque instant t on peut mesurer Ct
Ex. Voie IV
Papier décimal difficile à exploiter ⇒ Graphique semi-log
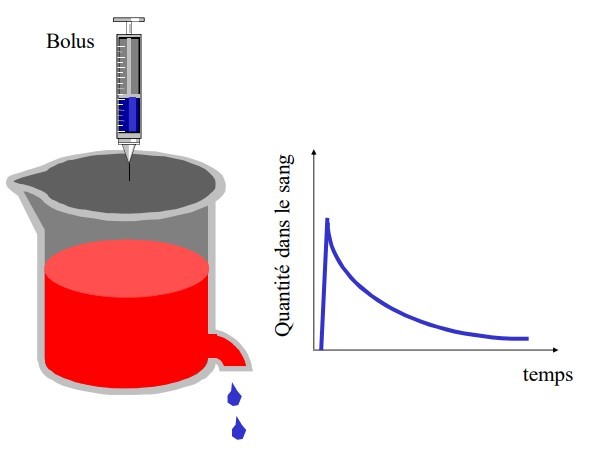
Modèle ouvert à 2 compartiments
2 exponentielles :
- distribution A et α
- élimination B et β
Modèle tricompartimental
Le volume du flux sanguin tissulaire dans différents organes peut varier en fonction de leur fonction et de leurs besoins métaboliques.
Dans le cas du foie, il est remarquablement élevé, atteignant environ 1700 ml par minute chez l'adulte. Cela s'explique par le rôle essentiel du foie dans de nombreuses fonctions métaboliques, y compris le métabolisme des médicaments, la détoxification des substances toxiques, la synthèse des protéines et le stockage des nutriments. Le foie nécessite donc une perfusion sanguine importante pour soutenir ces processus métaboliques cruciaux.
En ce qui concerne le cerveau, bien qu'il représente seulement environ 2% de la masse corporelle totale, il bénéficie également d'un flux sanguin relativement important. Le cerveau reçoit environ 800 ml de sang par minute, ce qui est considérable compte tenu de sa taille. Cette perfusion sanguine élevée est nécessaire pour répondre aux besoins métaboliques importants du cerveau, notamment pour assurer un apport constant en oxygène et en glucose, qui sont essentiels à son fonctionnement.
Le cerveau est un organe très actif sur le plan métabolique, nécessitant un approvisionnement constant en nutriments et en oxygène pour soutenir les processus neurologiques et la transmission des signaux électriques. Une diminution du flux sanguin cérébral peut entraîner des conséquences graves, telles que des dommages cérébraux et des déficits neurologiques.
Pharmacocinétique
Etude descriptive et quantitative du devenir des médicaments dans l’organisme
Evolution des concentrations en fonction du temps
ADME ⇒ Paramètres PK (pharmacokinetics)
But : Etablissement et adaptation de la posologie (dose + rythme)
Principe
Paramètres PK sont calculés à partir d’un modèle mathématique composé de compartiments dans lesquels le médicament se distribue et diffuse de l’un à l’autre.
Modèle monocompartimental
Modèles à 2 compartiments
Chaque compartiment est caractérisé par un V et une constante d’échange avec l’extérieur ou un autre compartiment selon les vitesses de transferts ou d’élimination k
L’état d’ionisation
L’eau est un solvant polaire, et les molécules dissoutes dans l’eau sont ionisées. Seule la forme non ionisée d’un médicament (si elle est suffisamment liposoluble) est capable de passer la membrane cellulaire.
L’état d’ionisation dépend du pKA de la molécule et du pH du milieu.
Le pKA est défini comme le pH pour lequel un acide se présente à 50% sous forme non ionisée et 50% sous forme ionisée.
Cas des anesthésiques généraux :
distribution rapide vers les SNC puis redistribution du SNC vers autres tissus plus profonds
Plasma
Organes très vascularisés (cœur foie rein cerveau) équilibre rapide
Organes peu vascularisés (graisse, tendons cartilage) équilibre lent
PARAMÈTRES PHARMACOCINÉTIQUES
Biodisponibilité = F
Quantité de principe actif qui atteint la circulation générale et la vitesse à laquelle elle l’atteint
2 types
Biodisponibilité absolue
Biodisponibilité relative
Biodisponibilité absolue
La biodisponibilité absolue mesure la disponibilité de la substance active dans la circulation systémique après une administration autre qu'intraveineuse (i.e rectale, transdermique, sous-cutanée, etc.).
Afin de déterminer la biodisponibilité absolue d'un médicament, une étude pharmacocinétique doit être menée pour obtenir une courbe représentant la concentration plasmatique de la substance active en fonction du temps.
Ceci doit être réalisé deux fois : la première en intraveineuse (IV) et la deuxième selon la modalité de prise souhaitée. La biodisponibilité absolue est ainsi le rapport de la seconde sur la première, soit de l'aire sous la courbe (ASC) de la substance active dans la prise souhaitée (i.e rectale, transdermique, sous-cutanée, perlinguale, etc.) sur l'ASC de référence de la substance active en IV.
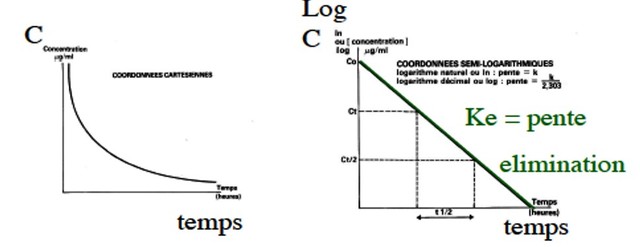
Demi-vie T1/2
Phénomène de décroissance exponentielle
Peut être déterminée pour chaque phase :
T1/2 élimination, T1/2 distribution
Sur pente terminale ou sur pente unique (modèle à 1 compartiment)
= temps de séjour dans l’organisme
Détermination du rythme d’administration pour éviter les accumulations
|
T1/2= 0,693xVd/Cl |
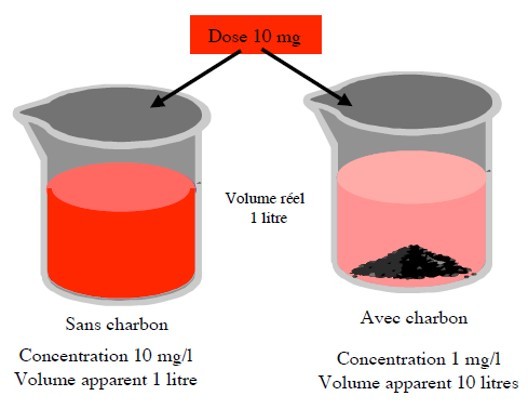
Volume de distribution
Volume théorique dans lequel le médicament devrait se répartir pour être à la même concentration que celle du plasma
Ex. voie IV
T1/2 temps nécessaire pour que la concentration plasmatique diminue de moitié
La demi-vie dépend de la clairance et du volume de distribution
Vd petit le plus petit 0,04 l/kg
Vd grand concentration tissulaires élevée/plasma
fixation tissulaire importante
distribution non homogène
40 000 l : Vd le plus grand
Le Vd traduit l’intensité de la diffusion du médicament dans l’organisme. Il peut varier de 0.06 L.kg-1 (médicament hydrosoluble ou de poids moléculaire élevé, confiné au seul volume plasmatique, à plus de 500 L.kg-1 (médicament lipophile ou ayant un tropisme particulier pour un tissu donné, donc très fortement concentré dans les tissus.
Clairance corporelle totale
Somme des clairances rénales, hépatiques…
Capacité de l’organisme à s’auto-épurer
Volume de plasma ou de sang totalement épuré du médicament par unité de temps (ml/min, l/h)
Clairance totale Cl = somme des clairances= (dose/AUC)
Clairance rénale = fraction de clairance= fe x clairance totale
(fe = quantité cumulative dans les urines/quantité administré)
Clairance hépatique = clairance biliaire + clairance métabolique
Facteurs de variation de la clairance
Fonction rénale ou hépatique
Flux sanguin dans l’organe
Fraction libre
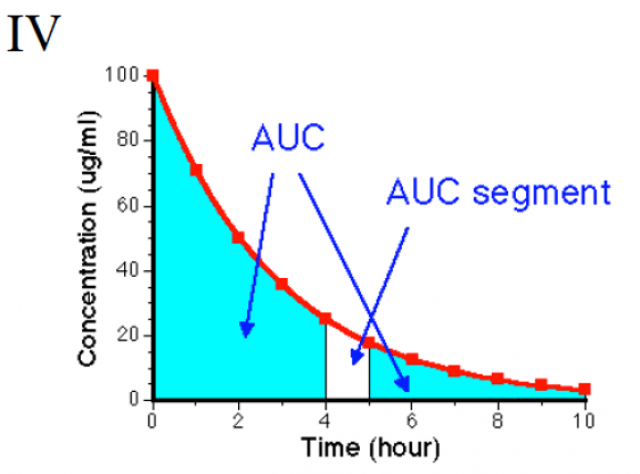
AUC (area under curve) ou ASC (aire sous la courbe)
AUC proportionnelle à la Q de médicament qui a circulé dans l’organisme, car cinétique linéaire
Intervalle de temps dans lequel la concentration a diminuée de moitié
T1/2 élimination la plus utilisée
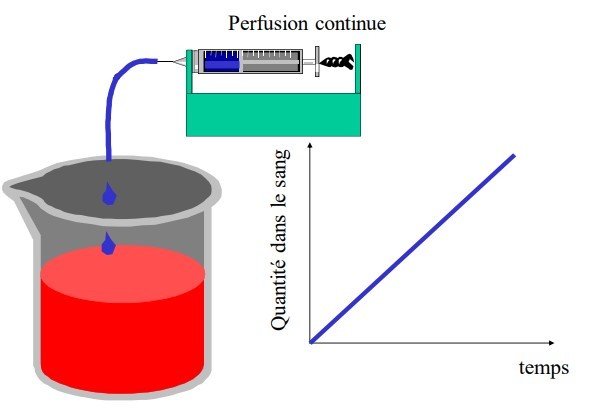
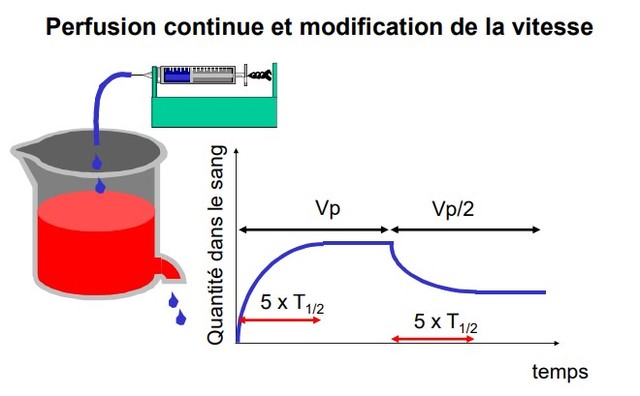
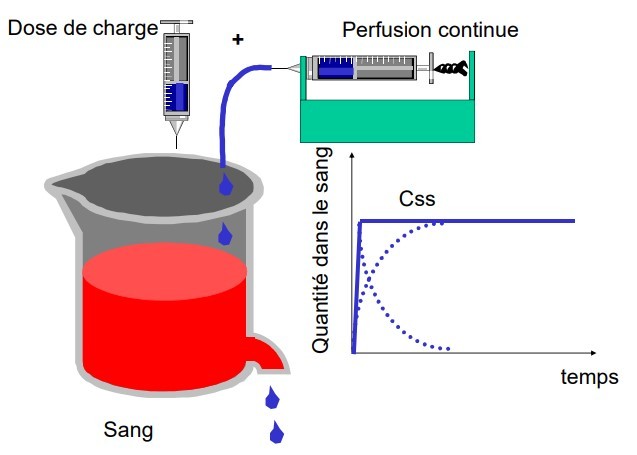
ADMINISTRATION EN PERFUSION CONTINUE
Les concentrations augmentent progressivement jusqu’à un plateau. Le débit d'entrée (Vp : vitesse de perfusion) est > à la vitesse d’élimination
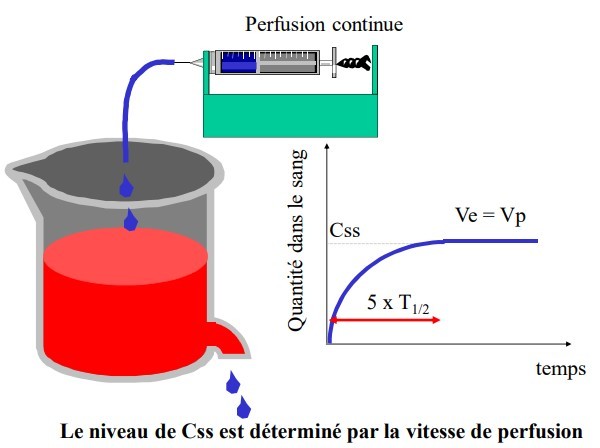
Plateau : v perfusion (Vp) = v élimination (Qss x ke = V x Css x Ke=Cl x Css)
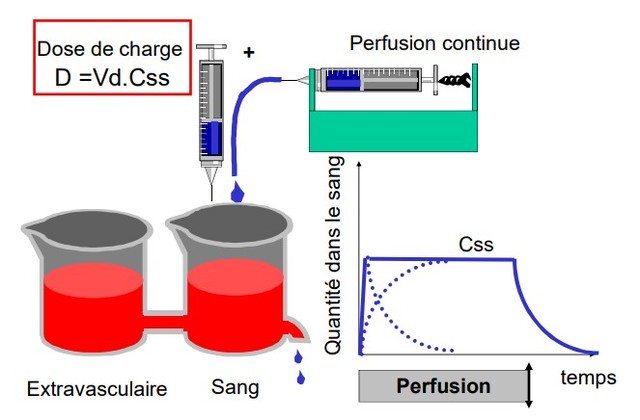
Dose de charge
Dose de charge D = V x Css : administration d'un bolus IV qui arrive d'emblée à Css. relayée par une perfusion qui compense les pertes
Evite l’attente et la progression des concentration jusqu’à Css
Atteinte des concentrations efficaces rapidement
Niveau du plateau fonction du débit et de la clairance :
•Css=D/Vd= D x Ke/Cl
•Css↑ : si D ↑ ou si Cl ↓ (ex IR)
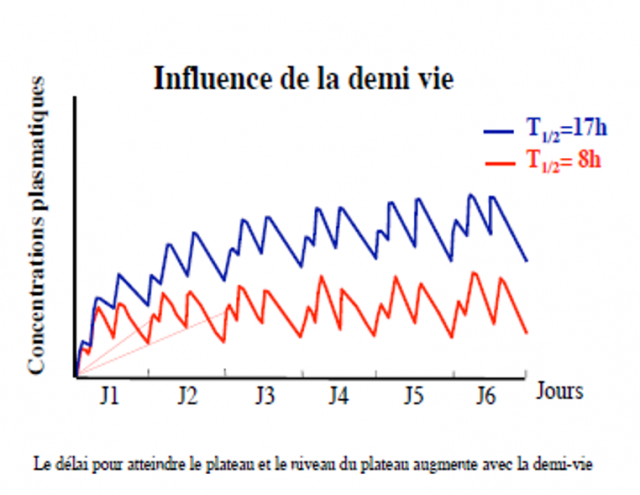
Temps pour atteindre le plateau = 5 T1/2
A Css : concentration dans la zone thérapeutique
Avant Css on est sous les concentrations efficaces
Si T1/2 longue : temps très long avant efficacité
Temps nécessaire pour atteindre le plateau : C moy = 5 T1/2
Puis dose d’entretien
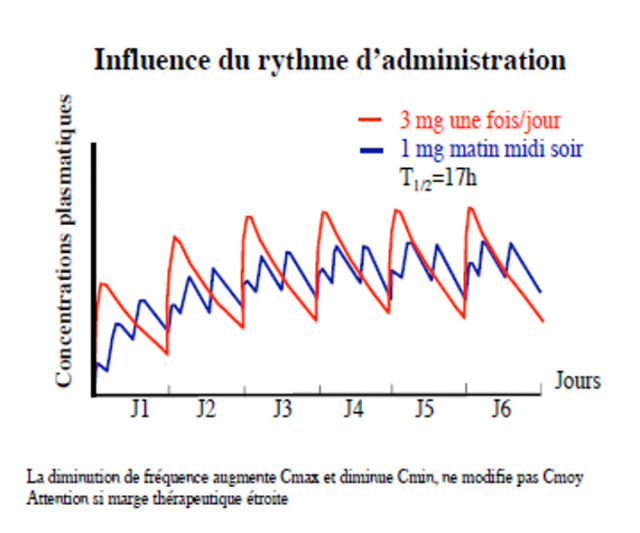
Rythme d’administration D/t
- t = intervalle
- D = Dose
A l’équilibre
- entrées = sorties
- D/ t = Cl.Cmoy
Schéma idéal t = T1/2
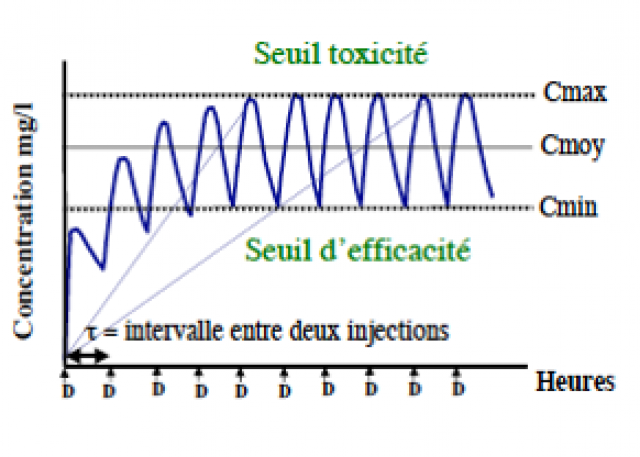
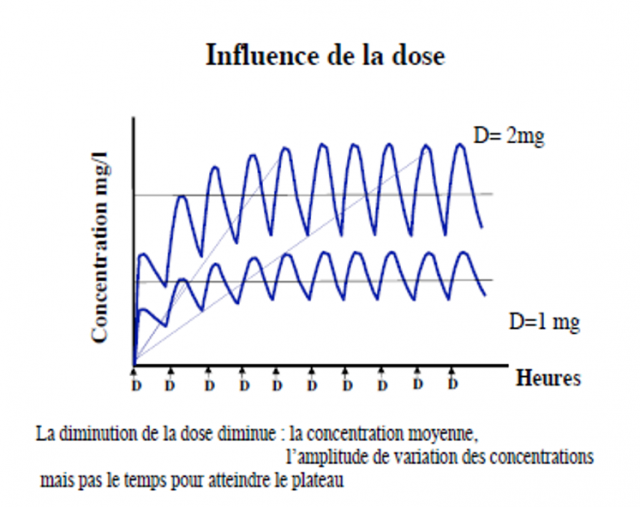
ADMINISTRATION REPETEE PAR VOIE I.V
•Si posologie bien adaptée C moy dans la zone thérapeutique
•Choix d’une dose avec la bonne fréquence pour éviter de dépasse le seuil toxique
Biodisponibilité relative
La biodisponibilité relative, permettant de comparer entre elles deux formes du médicament administrées par la même voie (ex. comprimé vs sirop). La comparaison porte alors sur les 3 paramètres : F, Cmax et Tmax.
La démonstration que ces paramètres sont comparables permet de définir la bioéquivalence des deux formes.
La bioéquivalence des formes sera un critère essentiel pour la reconnaissance d’un médicament générique
Adaptation posologique
Un des objectifs de la PK est d’optimiser le schémas thérapeutique en fonction du mode d’administration et de l’individu
Justifications Suivi Thérapeutique Pharmacologique (STP) et prérequis
Le STP d’un médicament est justifié si:
Relation concentration-effet meilleur que la relation dose-effet
Relation dose-concentration présente une grande variabilité interindividuelle
Zone thérapeutique étroite
Réponse pharmacologique difficilement accessible par une mesure de l’effet
Interactions médicamenteuses avec médicament susceptibles de modifier la PK
Notion de Zones thérapeutique (Notion statistique)
Zone de concentration où le plus grand nombre de malades est traités efficacement et présente le minimum d’effets indésirables
Indice de prédiction d’activité et de sécurité MAIS ce ne peut être un critère absolu d’efficacité et d’innocuité.
Indications du Suivi Thérapeutique Pharmacologique (STP)
Traitement prophylaxique: réponse pharmacologique difficilement accessible par une mesure de l'effet.
•Ex. immunosuppresseurs
Evaluation du traitement : l’objectif a t-il été atteint?
•médicaments avec mauvaise relation dose-concentration et bonne relation concentration-effet
Modification du traitement : dose, associations, voie d’administration.
Echec thérapeutique: origine de l’échec
•traitement inefficace, sous-dosage ou non observance?
Suspicion de toxicité
Observance
Date de dernière mise à jour : 05/06/2023
Ajouter un commentaire