- Accueil
- Modules 1ére année
- 2. PHARMACOLOGIE (Vh : 100 h , Coef : 3)
- 4) Hypnotiques barbituriques et non barbituriques
4) Hypnotiques barbituriques et non barbituriques
Principes de pharmacocinétique appliqués à l’anesthésie
J.-P. Haberer
Introduction
La pharmacocinétique est l’étude quantifiée du devenir des médicaments dans l’organisme depuis leur administration jusqu’à leur élimination [1–5]. Ainsi, elle s’intéresse directement à la relation entre la dose administrée et la concentration du médicament dans le sang et au site d’action. La pharmacodynamie décrit la relation entre la dose administrée ou la concentration plasmatique du médicament et son effet pharmacologique [6].
L’intensité et la durée de cet effet dépendent de la concentration du médicament au site d’action et de son évolution dans le temps. L’objectif de la pharmacocinétique est d’améliorer l’administration des agents anesthésiques en adaptant les doses et les modalités d’administration (bolus, perfusion continue) aux nécessités de la procédure chirurgicale (profondeur de l’anesthésie, de la myorelaxation, de l’analgésie). Les modèles pharmacocinétiques sont une aide à l’ajustement des doses des anesthésiques, permettant de réduire les risques de sousdosage ou de surdosage et les effets secondaires qui y sont liés. En anesthésie, du fait de l’administration des médicaments
pendant une durée limitée et de la nécessité de modifier souvent la concentration plasmatique, les modèles pharmacocinétiques conventionnels ont certaines limites. Pour optimiser l’administration des anesthésiques, la pharmacocinétique et la pharmacodynamie sont intégrées dans des modèles dits « pharmacocinétique/pharmacodynamie » (PK/PD) qui décrivent la relation temporelle entre la dose, la concentration plasmatique ou au site d’action et l’effet pharmacologique [7]. Ces modèles sont indispensables lorsque les anesthésiques sont administrés selon la technique à objectif de concentration (target-controled infusion [TCI], anesthésie intraveineuse à objectif de concentration, [AIVOC]) [8–10].
Pharmacocinétique descriptive
En anesthésie, les médicaments sont pour la plupart administrés par voie intraveineuse, ce qui supprime la phase d’absorption et s’accompagne d’une biodisponibilité proche de 100 %. L’évolution de la concentration plasmatique en fonction du temps est le résultat de la distribution et de l’élimination du médicament. Ces phénomènes de distribution et d’élimination sont décrits par les concepts de volume de distribution et de clairance [3, 5].
Distribution
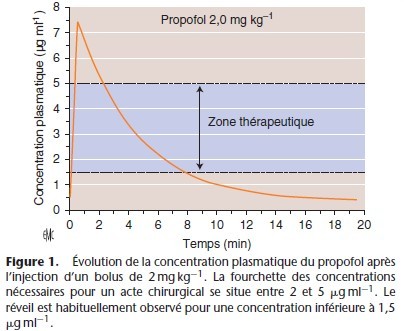
Après l’injection intraveineuse d’un anesthésique, la concentration plasmatique décroît selon une courbe exponentielle [11] (Fig. 1). Injecté dans le sang circulant, le médicament quitte la circulation pour être fixé par les organes périphériques. Les principaux facteurs qui régissent cette distribution tissulaire sont résumés dans les Tableaux 1, 2. Pour atteindre son site d’action, l’agent anesthésique doit traverser les membranes cellulaires, endothélium vasculaire et membrane de la cellule cible, par
exemple neurones du système nerveux central. Le transport à travers les membranes cellulaires peut se faire par trois mécanismes, passif, actif, et facilité (intervention d’une protéine de transport sans nécessité d’énergie).
Pour les agents anesthésiques c’est essentiellement le transport passif qui est en jeu et il dépend du gradient de concentration entre le sang circulant et les organes périphériques.
Pour les médicaments hydrosolubles, la diffusion passive selon le gradient de concentration se fait par des canaux protéiques hydrophiles (par exemple, curares et canal ionique des récepteurs cholinergiques).
En anesthésie, cette étape de distribution a une importance particulière : c’est elle qui est à l’origine des variations les plus rapides de la concentration plasmatique de l’agent, et donc de la quantité d’agent qui est présentée à chaque instant devant les sites d’action.
Les variations de la concentration plasmatique modulent directement la cinétique d’action du médicament. Ainsi, deux agents dont la vitesse d’élimination est proche, par exemple le fentanyl et le sufentanil, ont une cinétique d’action très différente par le simple fait de leur distribution : le sufentanil distribué rapidement et de facon extensive voit sa concentration plasmatique décroître très vite au-dessous du seuil de concentration efficace, alors que la concentration plasmatique du fentanyl distribué plus lentement reste plus longtemps dans la zone thérapeutique, même si secondairement les concentrations résiduelles des deux agents diminuent à la même vitesse du fait d’une élimination comparable.
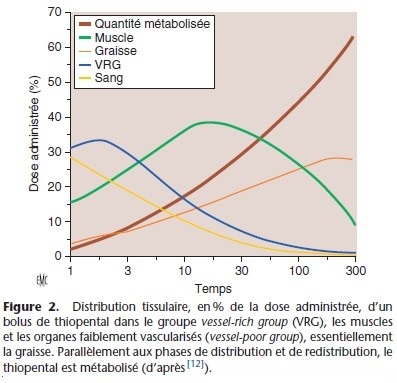
Après un temps variable, en fonction du médicament, de la dose et du mode d’administration (injection unique, perfusion), la concentration tissulaire dépasse la concentration plasmatique, le gradient de diffusion s’inverse et le médicament quitte les organes périphériques. Dans les années 1960, la cinétique de la distribution vers les organes périphériques a été décrite pour le thiopental en regroupant les organes en trois groupes selon l’importance de leur débit sanguin et de leur capacité de captage
du médicament (Fig. 2) : organes richement vascularisés (vessel-rich group [VRG] : cerveau, poumons, reins), groupe des muscles et circulation splanchnique, et organes faiblement vascularisés (vessel-poor group [VPG] : tissu adipeux, os) [2, 11, 12]. Très rapidement, c’est-à-dire quelques minutes après l’injection intraveineuse, les phénomènes de distribution et de redistribution se déroulent simultanément. Après une injection unique, la redistribution se fait essentiellement vers les muscles, le tissu adipeux captant une fraction plus faible du médicament. En revanche, lors des réinjections ou d’une perfusion continue, l’accumulation périphérique du médicament touche aussi le tissu adipeux. Certains médicaments, par exemple le fentanyl qui est une base faible, subissent un cycle entérohépatique, cette réabsorption digestive pouvant s’accompagner d’une remontée de la concentration plasmatique.
Volumes de distribution
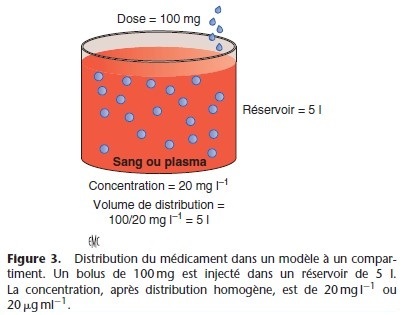
Le volume de distribution se définit comme le volume apparent d’un réservoir dans lequel se dilue le médicament, le volume du réservoir étant celui pour lequel la concentration est identique à la concentration plasmatique (Fig. 3). La concentration dans le réservoir est la quantité de médicament injecté divisée par le volume. Si le volume est inconnu, mais que la concentration (C) peut être mesurée, le volume (Vd) est calculé selon la formule : volume = quantité (dose)/concentration :
Vd = dose/C
Volume de distribution central
C’est le volume dans lequel se dilue le médicament au tout début de son injection. Le volume central est calculé en extrapolant la courbe de concentration en fonction du temps et en appliquant la concentration plasmatique qui serait mesurée si la circulation avait une vitesse infinie, c’est-à-dire si le mélange était instantané. En pratique, cette dernière hypothèse n’est pas vérifiée puisque le médicament n’apparaît dans le sang artériel que 30 à 40 secondes après son injection intraveineuse. La notion de volume central est utile au plan didactique, mais sa mesure précise est difficile. Ceci explique les limites du volume central (Vc) lorsqu’il est utilisé pour le calcul de la dose à administrer pour atteindre une concentration plasmatique donnée selon l’équation :
Dose de charge = Vc × concentration cible
Cette relation est une approximation car le volume qui permet le calcul de la dose de charge avec le plus de précision est le volume de distribution au pic de l’effet clinique (Vd peak-effect [Vdpe]).
Au moment du pic de l’effet clinique, on observe un pseudoéquilibre avec une égalité entre la concentration plasmatique et la concentration au site effet (cf. infra) [8, 10, 13–15].
Volumes de distribution périphériques
Le médicament injecté dans le volume sanguin circulant est distribué aux organes périphériques. Cette distribution est décrite par l’adjonction au volume central de compartiments périphériques.
La liaison du volume central aux volumes périphériques est représentée par un modèle dénommé modèle mamillaire (à l’image d’un système central de canalisation alimentant en dérivation d’autres tuyaux et par analogie avec les mamelles d’une femelle allaitante). La distribution du débit cardiaque détermine la vitesse à laquelle les différents organes sont exposés au médicament. Les VRG sont les organes qui s’équilibrent le plus rapidement avec la concentration plasmatique. Puis, l’équilibre se fait avec les organes comme les muscles et le foie, et en dernier avec les VPG. L’équilibre avec le VRG se fait en minutes, avec les muscles en heures et avec le VPG en jours.
Le volume des compartiments périphériques reflète la solubilité tissulaire du médicament. Plus un médicament est liposoluble, plus important est son volume de distribution dans les tissus.
En pratique, la solubilité tissulaire exacte n’est pas connue et elle est assimilée à la solubilité dans le sang. Une telle extrapolation explique que le volume de distribution périphérique des médicaments liposolubles est très élevé et sans rapport avec la réalité physiologique (par exemple 5000 l pour le propofol). Un volume de distribution tissulaire très élevé s’explique aussi par la fixation sur les protéines tissulaires. Il faut se rappeler que le volume de distribution périphérique calculé est le volume virtuel dans lequel le médicament devrait être dilué pour y être à la même concentration que dans le plasma. À l’inverse, pour un médicament hydrosoluble, curares par exemple, le volume de distribution est proche des volumes extracellulaires.
Au cours d’une perfusion intraveineuse, lorsque la concentration plasmatique reste constante, un état stable est atteint. À l’état stable, la quantité de médicament administrée est égale à la quantité éliminée. Le volume de distribution à l’état stable (Vdss) est le volume qui relie la concentration plasmatique à l’état stable
à la quantité totale de médicament présente dans l’organisme.
Vdss = Qss/Cp
Qss = quantité de médicament présente dans l’organisme à l’état stable ; Cp = concentration plasmatique.
Vdss est égal au volume central plus les volumes périphériques.
En anesthésie, la durée d’administration est relativement brève par rapport au temps nécessaire à l’obtention de l’état stable, ce qui nécessite le recours à une approximation pour définir un état pseudostable.
Élimination des médicaments
L’élimination désigne l’ensemble des processus qui aboutissent à la disparition du médicament de l’organisme [1, 16]. Le médicament peut être éliminé sous forme inchangée ou après métabolisme. Le foie et les reins sont les organes principaux de l’élimination. Néanmoins, d’autres organes et tissus participent au métabolisme (poumons, globules rouges, intestin).
Pour la plupart des anesthésiques, le métabolisme aboutit à des métabolites inactifs. Le métabolisme peut aussi aboutir à des métabolites qui conservent une activité pharmacologique proche de la molécule mère (hydroxymidazolam, morphine-6-glucuronide).
Enfin, le métabolisme peut transformer une prodrogue en médicament actif (déméthylation de la codéine en morphine).
Réactions de biotransformation
La plupart des médicaments anesthésiques sont lipophiles et nécessitent leur transformation pour être éliminés. Les réactions enzymatiques qui transforment les médicaments sont classées en réactions de phases I et II (Tableau 3). La phase I transforme le médicament en un ou plusieurs composés polaires, plus faciles à éliminer. La phase II rend le métabolite encore plus hydrophile en conjuguant les sites polaires avec divers composés endogènes. La plupart des médicaments subissent successivement les réactions de phase I, puis de phase II. Néanmoins, certains médicaments ne sont soumis qu’à un type de réaction, soit de type I, soit de type II [16].
Réactions de type I
Les principales réactions de type I sont l’hydrolyse, l’oxydation ou la réduction de la molécule mère. L’hydrolyse qui dégrade la molécule en deux métabolites par adjonction d’une molécule d’eau est le mode de métabolisme des esters comme les anesthésiques locaux, la succinylcholine et le rémifentanil. L’oxydation, réaction la plus fréquente, introduit un groupe OH dans la molécule. L’hydroxylation initiale précède souvent une seconde réaction qui est une désalkylation (suppression d’un radical carboné), une désamination (suppression d’un radical azoté), une oxydation d’un radical azoté, une désulfuration, une déshalogénation ou une déshydrogénation.
Cytochrome P450. Le cytochrome P450 (CYP) est une superfamille d’enzymes qui catalysent la plupart des réactions de type I [16]. Le CYP est aussi appelé oxydases à fonction mixte ou mono-oxygénases. Le CYP est intégré au réticulum endoplasmique lisse (microsomes) des hépatocytes et à la membrane des entérocytes de l’intestin grêle. Il existe aussi au niveau des poumons, des reins et de la peau. Les isoenzymes du CYP oxydent leur substrat essentiellement par insertion d’un atome d’oxygène
sous forme de radical hydroxyle. La réaction d’oxydation typique implique une hydroxylation initiale, le nicotinamide adénine dinucléotide phosphate (NADPH) fournissant deux électrons pour réduire un atome d’oxygène moléculaire en eau et insérer un autre électron dans le substrat selon la réaction suivante :
RH + O2 + NADPH + H+ → ROH + H2O + NADP+
RH = substrat ; ROH = métabolite oxydé.
Plus de 50 isoformes du CYP ont été identifiées, mais seules quelques-unes sont responsables du métabolisme de la majorité des médicaments. Les CYP ont une plus ou moins grande spécificité vis-à-vis de leurs substrats. Dans le métabolisme des anesthésiques, les CYP les plus importants sont les CYP2B6, 2D6, 2E1 et 3A. Le CYP3A4 est l’enzyme quantitativement la plus importante, elle représente 40 à 45 % du métabolisme médié par le CYP. Le CYP3A4 métabolise un large éventail de médicaments
dont plusieurs anesthésiques (Tableau 4). Chez certains sujets, c’est le CYP3A5 qui assure une grande partie des fonctions du CYP3A4.
Certaines enzymes (CYP3A4 et CYP2B6) subissent une induction ou une inhibition par divers xénobiotiques, dont des médicaments (Tableau 5). Ces phénomènes d’induction ou d’inhibition peuvent influencer la pharmacocinétique des anesthésiques.
Ainsi, la troléandomycine diminue la clairance de l’alfentanil de près de 88 %[16, 17]. Néanmoins, dans la plupart des cas, l’incidence clinique de ces modifications n’est pas majeure car c’est la phase terminale d’élimination qui est prolongée alors que l’effet pharmacologique est surtout observé durant la phase initiale de distribution. De plus, ces modifications sont en partie masquées par les variations inter-individuelles de la pharmacocinétique.
Autres enzymes. D’autres enzymes interviennent dans les réactions de type I. Ce sont les estérases, carboxylestérases et cholinestérases. Les carboxylestérases sont des enzymes microsomiales présentes dans de nombreux tissus, dont le foie. Elles comportent deux types principaux, hCE-1 et hCE-2. La hCE-1 métabolise la cocaïne, la mépéridine et l’héroïne. La hCE-2 hydrolyse l’héroïne en 6-monoacétylmorphine puis en morphine.
Les cholinestérases comportent l’acétylcholinestérase (AchE) et la butyrylcholinestérase ou pseudocholinestérase plasmatique.
Cette dernière intervient dans le métabolisme de la succinylcholine, du mivacurium, des anesthésiques locaux de type esters dont la cocaïne et l’héroïne. Le rémifentanil est hydrolysé par des estérases plasmatiques et surtout tissulaires, non spécifiques.
Réactions de type II
Les réactions de type I introduisent des groupes polaires dans la molécule, ce qui permet les réactions de conjugaison.
La morphine comporte d’emblée des groupes polaires et elle subit une conjugaison directe. Les principales enzymes de conjugaison sont les méthyltransférases, les sulfotransférases, les acétyltransférases, les acyltransférases, les glucuronosyltransférases ou glucuronyltransférases et les glutathion-S-transférases (Tableau 3). Les métabolites conjugués sont hydrosolubles et peuvent être éliminés par le rein et la bile.
Clairance
La clairance quantifie l’élimination du médicament du sang circulant.
Deux processus participent à cette clairance : la clairance systémique et la clairance intercompartimentale. La clairance systémique correspond à l’élimination définitive du médicament de l’organisme, soit sous forme inchangée, soit sous forme demétabolites. La clairance intercompartimentale représente les transferts du médicament entre le sang et les organes périphériques.
La clairance systémique ou plasmatique totale, définie en unité de flux, est le volume totalement épuré du médicament par unité de temps (l min–1). La quantité de médicament réellement éliminée par unité de temps est obtenue en multipliant la clairance plasmatique totale par la concentration plasmatique. La clairance plasmatique totale est souvent indexée au poids ou à la surface corporelle (ml min−1 kg−1 ou ml min−1m−2). Cette clairance est la somme de toutes les clairances des différents organes périphériques. Pour la plupart des médicaments anesthésiques, le foie est l’organe d’élimination principal, d’où l’importance de la clairance hépatique.
Clairance hépatique
Le foie est le principal organe d’élimination des médicaments, les exceptions notables étant les agents métabolisés par des enzymes plasmatiques ou tissulaires (succinylcholine, rémifentanil, curares benzylisoquinolines) et ceux excrétés par le rein (rocuronium, néostigmine). Pour la plupart des anesthésiques, le taux de métabolisme hépatique est proportionnel à la concentration du médicament dans le sang afférent (concentration qui est la moyenne des concentrations dans l’artère hépatique et dans la veine porte). Ceci veut dire que la clairance métabolique est habituellement constante et indépendante de la dose, c’est-à-dire qu’il n’y a pas de saturation des sites de métabolisme (cf. infra).
Cette hypothèse est vraie pour la plupart des situations et des anesthésiques.
La quantité (R) d’un médicament éliminée par le foie correspond au débit sanguin hépatique multiplié par la différence de concentration entre le flux d’entrée (concentration afférente) et de sortie (concentration efférente) [18–20] :
R = Qh (Caff − Ceff)
Qh = débit hépatique afférent (somme des débits de l’artère hépatique et de la veine porte), valeur moyenne chez l’adulte : 1,4 l min−1 ; Caff = moyenne de la concentration dans l’artère hépatique et la veine porte ; Ceff = concentration dans les veines sus-hépatiques.
Si tout le médicament était capté par le foie lors d’un seul passage, la clairance hépatique serait égale au débit sanguin hépatique.
Mais le plus souvent, une certaine fraction du médicament n’est pas captée et quitte le foie par les veines sus-hépatiques.
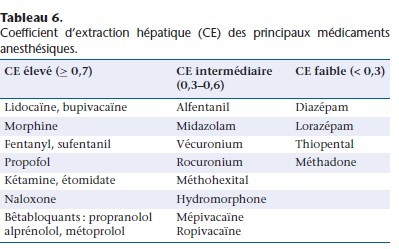
La fraction captée par le foie est exprimée par le coefficient d’extraction (CE) qui est le rapport :
CE = Caff −Ceff/Caff
La clairance hépatique est :
Clh = Qh × CE = Qh ( Caff − Ceff/Caff)
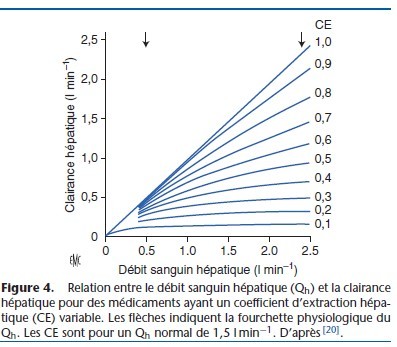
Le CE des anesthésiques est résumé dans le Tableau 6. La relation entre la clairance, le débit hépatique et le coefficient d’extraction est décrite dans la Figure 4 [18]. Si le CE est élévé (> 0,7) (proche de 1 pour le propofol), la clairance est proportionnelle au Qh (médicament à métabolisme débit-dépendant). Si le CE est inférieur à 0,3 (thiopental) ou intermédiaire (alfentanil), la clairance est peu dépendante du Qh, mais elle dépend des capacités métaboliques des hépatocytes (métabolisme capacité-dépendant). Les médicaments capacité-dépendants sont divisés en deux catégories selon leur taux de fixation aux protéines. Si la fixation aux protéines est importante (fraction libre faible), leur métabolisme hépatique est sensible aux variations de la fixation aux protéines (capacité-dépendant et fixation sensible). Les médicaments
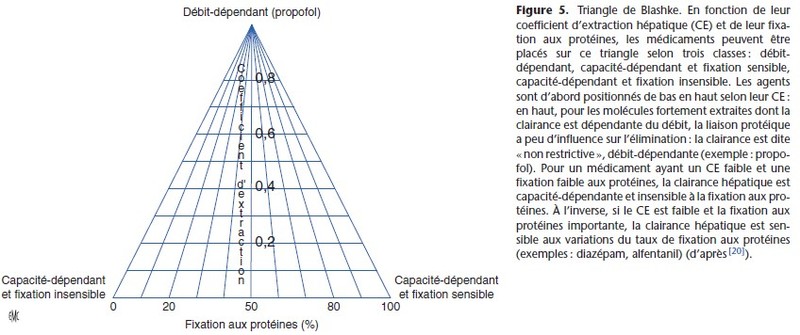
capacité-dépendants, mais peu fixés aux protéines, ne sont pas sensibles aux variations de la fixation aux protéines. Le triangle de Blashke [20] permet de situer les anesthésiques selon leur CE et leur taux de fixation aux protéines (Fig. 5).
Clairance rénale
Le rein élimine la forme inchangée des médicaments hydrosolubles (vécuronium, rocuronium) et les métabolites hydrosolubles des médicaments liposolubles. L’élimination se fait par filtration glomérulaire et par sécrétion tubulaire. La pharmacocinétique de la plupart des anesthésiques est peu influencée par une modification
de la fonction rénale. Seuls les curares non dépolarisants stéroïdes sont partiellement éliminés par le rein. Certains médicaments comme le midazolam et la morphine ont des métabolites conjugués (α-hydroxymidazolam, morphine-6-glucuronide) qui sont éliminés plus lentement en cas d’insuffisance rénale et dont l’accumulation peut induire des effets secondaires.
Le rein contient de nombreuses enzymes dont le CYP (CYP3A4, CYP3A5), la glutathion-S-transférase, les estérases et les glucuronyltransférases.
Le rein contribue pour près de 30 % au métabolisme du propofol par glucuronoconjugaison.
Clairance tissulaire
D’autres tissus tels le sang, les muscles, le poumon et l’intestin possèdent les différentes enzymes (CYP, estérases, glucuronyltransférases, sulfotransférases, glutathion-S-transférases) capables de métaboliser les médicaments. À l’exception de certains médicaments comme le rémifentanil, ces tissus ont un rôle limité dans l’élimination des anesthésiques.
Effet de premier passage pulmonaire
Lorsqu’un médicament est administré par voie intraveineuse, il doit traverser le filtre pulmonaire avant d’atteindre la circulation artérielle systémique. Le poumon doté de fonctions métaboliques intervient dans le métabolisme de substances endogènes comme l’angiotensine et les catécholamines. Son rôle dans le métabolisme des anesthésiques est plus limité. En revanche, il capte certains médicaments et les relargue secondairement dans la circulation systémique par les veines pulmonaires. Cette captation transitoire réalise un véritable effet de premier passage pulmonaire. Ce phénomène qui a été identifié pour les opiacés et les anesthésiques locaux modifie la cinétique initiale de cesmédicaments. De plus, ce captage pulmonaire transitoire limite la toxicité systémique en cas d’injection intravasculaire accidentelle d’anesthésiques locaux [21–25].
Clairance plasmatique totale et aire sous la courbe
La clairance (Cl) plasmatique totale peut être calculée par la méthode de l’aire sous la courbe (ASC) (area under the curve [AUC]) qui utilise l’aire sous la courbe de la concentration du médicament au cours du temps. L’aire sous la courbe correspond à la mesure de l’intégrale des concentrations instantanées pendant un intervalle de temps, par exemple de 0 à l’∞. Pour un modèle monocompartimental, l’équation est :
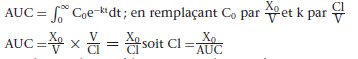
x0 = dose de médicament administrée au temps 0 ; C0 = concentration au temps 0 ; V = volume de distribution initial ; k = constante d’élimination.
Le calcul de l’aire sous la courbe s’applique aussi aux modèles multicompartimentaux pour les médicaments dont l’élimination est d’ordre 1, c’est-à-dire dont la clairance est constante. Le calcul de l’aire sous la courbe est indispensable pour définir la biodisponibilité d’un médicament administré par voie orale.
Demi-vie d’élimination
La partie terminale de la courbe de décroissance de la concentration plasmatique est linéaire et elle définit la demi-vie d’élimination (t1/2 ß ou t1/2 γ selon que le modèle est à deux ou trois compartiments) qui est le paramètre pharmacocinétique couramment utilisé pour préciser la vitesse d’élimination du médicament. La demi-vie est le temps nécessaire pour que la quantité de médicament présente dans l’organisme diminue de 50 %. Les variations de la demi-vie d’élimination sont dépendantes non seulement des processus d’élimination, mais aussi du volume de distribution selon la formule :
t1/2 = 0, 693 × Vd/Cl
Vd = volume de distribution ; Cl = clairance plasmatique totale.
En anesthésie, cette demi-vie d’élimination a moins d’intérêt puisqu’elle ne décrit pas la dissipation de l’effet pharmacologique.
Ainsi, la demi-vie d’élimination d’un bolus de propofol est de plusieurs heures alors que son effet clinique n’est que de quelques minutes.
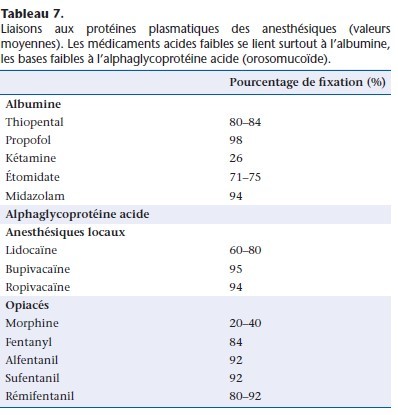
Fixation aux protéines
La plupart des anesthésiques se lient peu ou prou aux protéines plasmatiques (Tableau 7). L’albumine lie les molécules faiblement acides (thiopental, midazolam, propofol) et l’α1-glycoprotéine acide lie les molécules basiques (anesthésiques locaux, fentanyl et dérivés). D’autres constituants plasmatiques (lipoprotéines) et cellulaires (globules rouges) fixent à un moindre degré les médicaments [20, 26–28]. Dans la période périopératoire, les concentrations plasmatiques de ces deux protéines évoluent de fac¸on indépendante et souvent opposée, l’albumine baisse alors que l’α1-glycoprotéine, protéine de l’inflammation, augmente. La concentration plasmatique de l’albumine (35 à 50 g l−1) est plus élevée que celle de l’α1-glycoprotéine acide (0,4 à 1 g l−1) et donc ses capacités de fixation sont plus importantes. Dans une même situation clinique, on peut donc observer une augmentation de la fraction libre des anesthésiques fixés par l’albumine et une diminution de la fraction libre de ceux fixés par l’α1-glycoprotéine.
Effets sur la pharmacocinétique
Un effet bien identifié de la liaison aux protéines est la modification des paramètres pharmacocinétiques calculés, volume de distribution, clairance et demi-vie d’élimination. Si la fraction libre augmente, le gradient de diffusion du médicament entre le sang et les tissus augmente. La quantité de médicament captée par les tissus augmente et il en résulte une augmentation apparente du volume de distribution si celui-ci est calculé avec la concentration plasmatique totale du médicament et non sa
fraction libre (fu, u pour unbound). L’augmentation du volume de distribution calculé est surtout nette si la distribution tissulaire est importante, c’est-à-dire si le Vdss est élevé, ce qui est le cas des anesthésiques intraveineux.
Vdss = fu p / [fu tiss] × Vtiss + Vp
fu p = forme libre plasmatique ; fu tiss = forme libre tissulaire ; Vtiss = volume des tissus ; VP = volume plasmatique.
Si le volume tissulaire est nettement plus élevé que le volume plasmatique, la formule montre que toute variation de fu p entraîne une variation du Vdss.
En revanche, le volume de distribution de la forme libre (fu p) reste stable :
Vd (fu) = Vd (total) /fu p
fu p = fraction libre plasmatique ; Vd(fu) = volume de distribution de la forme libre ; Vd(total) = volume de distribution de la forme totale (libre et liée).
Par exemple, pour le thiopental, chez des patients en insuffisance rénale chronique avec hypoalbuminémie, la fu augmente de 15,7 à 28 %. Le volume de distribution calculé est de 3,0 l kg−1 si le calcul utilise la concentration plasmatique totale, mais de 1,5 l kg−1 si on utilise la fu, c’est-à-dire un Vd identique aux sujets à fonction rénale normale [29].
La variation de la fraction fixée aux protéines influence aussi la clairance calculée. Si le coefficient d’extraction hépatique est élevé, la fraction libre n’a pas d’influence sur le captage du médicament par le foie. En effet dans ce cas : Clint u × fu p >>> Qh (Clint u = clairance intrinsèque de la forme libre ; fu p = fraction plasmatique libre) et la Clh ≈Qh.
Si le CE est bas (Qh >>> Clint u × fu p) la relation est : Clh = fu p × Clint ; c’est-à-dire que la clairance dépend de la fu p et de la capacité intrinsèque du foie à métaboliser le médicament. Si la fu p augmente, la clairance augmente (médicaments dits « capacité-dépendants » et clairance restrictive).
Les variations de Vd et de la clairance se répercutent sur la demivie d’élimination. Pour les médicaments à CE élevé et si le volume de distribution tissulaire est important, la t1/2 dépend de la fu p selon l’équation : t1/2 ≈ [0,693 (fu p/fu tiss) × Vtiss]/Qh
Pour les médicaments à CE bas, la t1/2 est indépendante de fu p : t1/2 ≈ [0, 693 (Vtiss/fu tiss)] /Clint
Effets sur la pharmacodynamie
En théorie, l’augmentation de la forme libre s’accompagne d’un effet clinique augmenté. Néanmoins, pour les anesthésiques dont l’effet pharmacologique est surtout lié à la phase initiale de distribution, cette influence est limitée en raison de la dissociation rapide de la forme liée selon la loi d’action de masse :
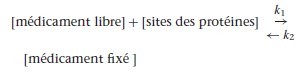
k1 et k2 sont les constantes de dissociation. Lorsque la concentration du médicament libre diminue, la réaction se déplace de la droite vers la gauche, c’est-à-dire dans le sens de la dissociation de la forme liée, et ainsi alimente le pool de la forme libre.
Un effet pharmacodynamique peut être observé pour les médicaments fortement fixés aux protéines, ayant un CE élevé et une équilibration pharmacocinétique/pharmacodynamique rapide comme c’est le cas des anesthésiques (propofol par exemple). Dans les modèles PK/PD intégrés dans les seringues
électriques pour l’administration des anesthésiques sur le mode AIVOC, les équations pharmacocinétiques devraient utiliser les concentrations sanguines libres et non les concentrationstotales. Peu de travaux ont évalué la précision améliorée de tels modèles.
Concepts pharmacocinétiques
Processus d’ordre zéro et d’ordre 1
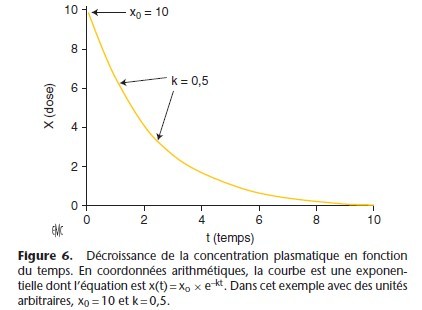
Lorsque la variation d’un processus est constante en fonction du temps, le processus est dit « d’ordre zéro » (par exemple métabolisme de l’alcool éthylique). La dénomination « ordre zéro » signifie que la variation est proportionnelle à la puissance zéro de la variable, c’est-à-dire que la variation est constante : dx/dt = kx0 = k. La quantité de médicament éliminée est constante et ne dépend pas de la concentration.
La plupart des médicaments anesthésiques sont soumis à un processus d’ordre 1, ce qui signifie qu’une fraction constante du médicament est éliminée pendant une période déterminée et ceci indépendamment de la dose ou de la concentration du médicament. Un processus d’ordre 1 indique que les enzymes du métabolisme ne sont pas saturées. La fraction de médicament éliminée étant proportionnelle à la concentration plasmatique, la quantité éliminée est élevée quand la concentration est élevée et
plus faible lorsque la concentration est basse. La fraction éliminée est équivalente à la constante de vitesse d’élimination (rate constant) du processus. Les constantes d’élimination sont indiquées par la lettre k et ont comme unité l’inverse du temps, min−1 ou h−1. Ainsi, si 10 % du médicament sont éliminés par minute, la constante d’élimination k est égale à 0,1 min−1.
La valeur de la concentration x au temps t, x(t), est une intégrale du temps 0 au temps t :
x (t) = x0 × e–kt
xo = valeur de x au temps zéro.
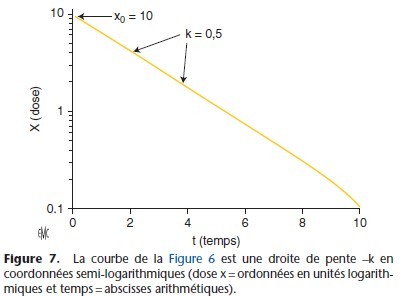
Si k est supérieur à zéro, x(t) augmente exponentiellement, si k est inférieur à zéro, x(t) diminue exponentiellement. En pharmacocinétique, k est négatif car la concentration diminue (Fig. 6, 7).
En coordonnées semi-logarithmiques, la courbe est une droite dont la pente est –k. Le temps nécessaire pour que la concentration xo diminue de 50 % est la demi-vie. En utilisant les logarithmes naturels, l’équation x(t) = xo × e–kt permet d’obtenir la relation : t1/2 = 0,693/k
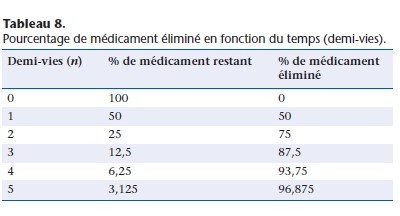
Pour les processus d’ordre 1, la décroissance de la concentration plasmatique du médicament étant exponentielle, l’élimination atteint 97 % de la dose administrée en cinq demi-vies (Tableau 8).
Les phénomènes de distribution entre les compartiments obéissent aussi aux lois des processus d’ordre 1 et le concept des constantes de distribution et de demi-vie s’appliquent avec les mêmes équations.
Modèles pharmacocinétiques
L’objectif des modèles pharmacocinétiques est de prédire chez un patient donné le plus précisément possible l’évolution des concentrations du médicament dans l’organisme en fonction de la dose et du mode d’administration. Même si les modèles pharmacocinétiques sont établis à partir d’études réalisées chez des patients représentatifs d’une population chirurgicale courante, il existe une discordance d’importance variable selon le modèle entre les concentrations prédites et celles réellement
mesurées [10, 11, 14, 15]. Néanmoins, les modèles décrits ci-dessous ont une précision acceptable en clinique pour le calcul de la dose (en bolus ou en perfusion) nécessaire pour atteindre et maintenir une concentration plasmatique prédéfinie. La prédiction de la cinétique des concentrations plasmatiques et au site d’action est encore améliorée par des ajustements appliqués aux modèles pharmacocinétiques classiques (cf. infra).
Modèles physiologiques
La pharmacocinétique peut être décrite en utilisant un modèle anatomique et physiologique basé sur la distribution du débit cardiaque vers les différents organes périphériques. Il est ainsi possible d’analyser les volumes et les clairances pour chaque organe et de construire un modèle pharmacocinétique pour l’organisme entier en associant les différents organes [3, 5]. Ces modèles sont complexes et difficiles à mettre en oeuvre car les mesures de tous les débits sanguins régionaux et des concentrations afférentes et efférentes ne sont pas réalisables chez l’homme [2, 5]. De plus, il a été montré que la précision de ces modèles physiologiques n’était pas
plus grande que celle des modèles compartimentaux. Un modèle physiologique simplifié est décrit (cf. supra) (Fig. 2).
Modèles pharmacocinétiques des compartiments
Les modèles compartimentaux simplifient les modèles physiologiques.
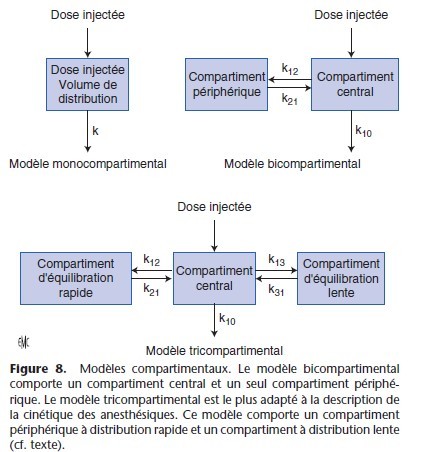
Dans ces modèles, les compartiments n’ont pas d’équivalents anatomiques stricts. Le modèle le plus simple est monocompartimental (Fig. 8) et contient un seul volume et une seule clairance. Pour les médicaments anesthésiques, le modèle bi ou tricompartimental est plus adapté (Fig. 8). Ces modèles multicompartimentaux, appelés modèles mamillaires, comportent un volume central sur lequel sont branchés des volumes périphériques.
La somme des volumes est le volume de distribution à l’état stable, Vdss.
Modèle monocompartimental
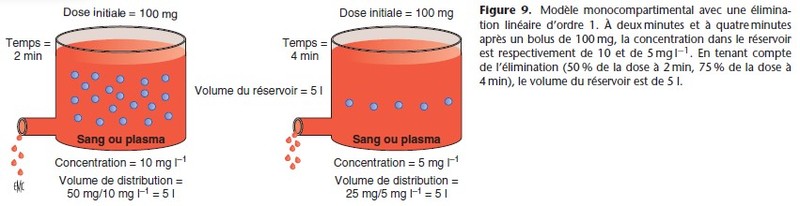
L’organisme est représenté par un réservoir unique et homogène dans lequel est injecté en bolus une quantité de substance xo (x au temps zéro) (Fig. 3). La concentration initiale est xo/V (V est le volume du réservoir). Si l’on veut obtenir la concentration cible
Ct (target), la dose à administrer est : dose = Ct × V
Si la substance est éliminée du réservoir à un taux constant (clairance), on a l’équation suivante :
dx / dt = x/V * Cl
dx/dt est le taux d’élimination de la substance en fonction du temps, x est la quantité de médicament présente dans l’organisme et Cl est la clairance.
Le processus d’élimination étant d’ordre 1 (Fig. 9), la pharmacocinétique est linéaire et le volume et la clairance sont constants :
Cl/V = k
k = constante de vitesse d’élimination.
En introduisant la demi-vie (équation t1/2 = 0,693/k), on obtient la relation :
t1/2 = 0, 693* V / Cl soit t1/2 ≈ V / Cl
Modèles multicompartimentaux
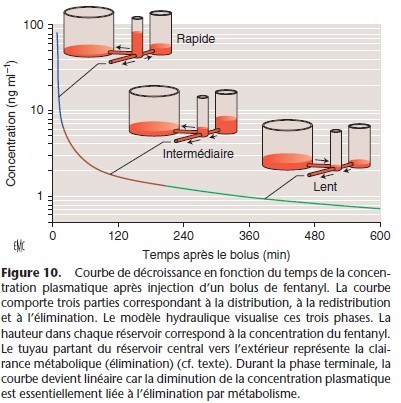
La pharmacocinétique des anesthésiques nécessite un modèle plus complexe que le modèle à un compartiment. La courbe exponentielle qui décrit l’évolution de la concentration plasmatique après l’administration d’un bolus comporte trois parties dont la pente diminue en fonction du temps (Fig. 10, 11). Les trois phases correspondent schématiquement à une phase de distribution rapide, une phase intermédiaire et une phase terminale.
La phase initiale correspond à la distribution à partir du compartiment central (volume sanguin circulant et premier passage pulmonaire) vers les tissus périphériques richement vascularisés.
La phase intermédiaire correspond à la distribution plus lente vers les tissus moyennement vascularisés et au retour du médicament à partir des tissus à équilibration rapide (début de la redistribution). La phase terminale est essentiellement la phase d’élimination, mais la redistribution a aussi lieu lors de cette phase. Durant cette phase d’élimination, la concentration plasmatique est inférieure à la concentration tissulaire, le médicament est transféré des tissus vers le plasma et du plasma il est éliminé
par le métabolisme et l’excrétion.
Le modèle tricompartimental peut être décrit par un modèle hydraulique à trois réservoirs (Fig. 10). Ce modèle, très didactique, a été développé par Mapleson pour les anesthésiques halogénés [30, 31]. Il visualise l’évolution des concentrations et les directions des flux entre les compartiments au cours du temps, la taille des réservoirs et le diamètre des tuyaux de connexion étant proportionnels, respectivement aux volumes des compartiments et aux débits sanguins régionaux.
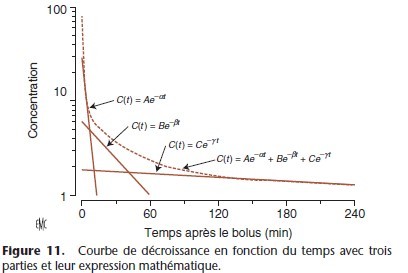
Dans le modèle tricompartimental, la courbe de décroissance de la concentration plasmatique en fonction du temps est décrite par la somme de trois exponentielles :
C(t) = Ae–αt + Be–ßt + Ce–γt
t = temps depuis le bolus ; C(t) = concentration au temps t après une dose bolus ; et A, α, B, ß, C, γ sont les paramètres du modèle pharmacocinétique.
Au temps 0 (t0) l’équation se simplifie : C0 = A + B + C
La somme des coefficients A, B et C est égale à la concentration immédiatement après l’injection d’un bolus.
Dans sa représentation figurée, ce modèle comporte des microconstantes de transfert qui définissent le taux de transfert entre les différents compartiments (Fig. 8). Le compartiment 0 est en dehors du modèle et correspond à l’élimination : k10 est la microconstante de transfert qui définit l’élimination, c’est-à-dire la sortie définitive du médicament de l’organisme. Les microconstantes k12 et k21, k13 et k31 décrivent les transferts entre les compartiments périphériques et le compartiment central. Dans
le modèle hydraulique, les microconstantes de transfert correspondent aux tuyaux qui relient les réservoirs.
La raison principale de l’utilisation en clinique de l’équation triexponentielle est qu’elle décrit assez exactement l’évolution temporelle de la concentration plasmatique du médicament administré en bolus. Cependant, ce modèle tricompartimental est peu précis dans sa prévision de la concentration plasmatique au tout début de l’injection (bolus ou perfusion). Durant cette phase initiale, la concentration plasmatique varie rapidement et le concept de cinétique précoce (front-end kinetics) introduit lesphénomènes de recirculation précoce et décrit la pharmacocinétique dans les premières minutes, période essentielle puisque c’est la phase d’installation de l’effet pharmacologique [32]. Le modèle classique admet que le médicament introduit dans le volume central (Vc) est dilué presque instantanément et de fac¸on homogène dans ce volume. Si initialement le volume central peut être assimilé au volume sanguin circulant, dans la réalité il varie dans le temps et augmente en fonction des conditions physiologiques et des propriétés physicochimiques du médicament. Ceci explique que plus la mesure de la concentration sanguine est précoce, plus petit est le volume central calculé. La plupart des modèles pharmacocinétiques surestiment le Vc car ils ne prennent pas en compte la complexité de la mixique initiale. Si ces modèles où le Vc est surestimé sont utilisés dans les logiciels de l’AIVOC, la concentration sanguine réelle dépasse la concentration cible au début de la mise en route, mais aussi ultérieurement. Les modèles pharmacocinétiques qui tiennent compte de la recirculation précoce se sont révélés plus précis pour une utilisation en mode AIVOC [32].
Cinétique terminale et demi-vie contextuelle
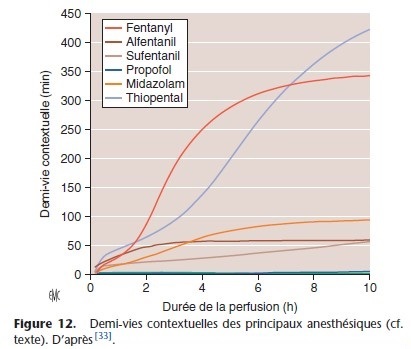
En clinique, il est intéressant de connaître la cinétique de décroissance de la concentration plasmatique à l’arrêt d’une perfusion continue car elle permet de prédire le délai de réveil. Cette cinétique terminale (back-end kinetics) est représentée par le temps de décroissance ou temps nécessaire pour que la concentration plasmatique atteigne une certaine valeur, par exemple pour le propofol, la concentration pour laquelle le sujet répond aux ordres simples. Le temps de décroissance dépend de la durée de perfusion
et s’allonge avec celle-ci. Cet allongement est le témoin d’une accumulation du médicament dans les tissus périphériques.
Le temps de décroissance de 50 %, temps nécessaire pour que la concentration plasmatique au moment de l’arrêt de la perfusion diminue de moitié, est la demi-vie contextuelle (Fig. 12) [33]. Plus la demi-vie contextuelle est courte, plus rapide est le réveil. En pratique, il est souvent plus intéressant de connaître le temps de
décroissance à 90 %, concentration plus proche de celle nécessaire à la dissipation de l’effet clinique.
Pharmacocinétique de population
Un des objectifs des modèles pharmacocinétiques est l’utilisation optimale des anesthésiques selon leurs diverses modalités d’administration (bolus unique, bolus itératifs, perfusionintraveineuse avec ou sans objectif de concentration). Les modèles pharmacocinétiques et leurs équations d’application décrits ci-dessus sont dérivés de mesures réalisées chez des sujets sains ou chez des groupes de patients définis. Lorsque ces modèles sont appliqués à tous les patients chirurgicaux, on constate unécart entre les paramètres prédits et ceux réellement mesurés, une variation de près de 100 % n’étant pas rare. La variabilité pharmacodynamique est même plus importante puisqu’il est
fréquent d’observer que pour un effet donné, la concentration plasmatique nécessaire varie de 1 à 5, voire plus chez certains sujets [14, 15]. Cette variabilité n’est pas gênante pour les anesthésiques ayant une marge de sécurité importante. En revanche, lorsque l’anesthésique a des effets secondaires (dépression cardiovasculaire, dépression ventilatoire), une titration plus précise est nécessaire. Diverses solutions sont proposées pour améliorer la prévision statistique des modèles pharmacocinétiques.
Parmi celles-ci, il y a la pharmacocinétique de population et la méthode bayésienne [34–36]. L’analyse de population a pour objectif d’intégrer les variations inter-individuelles des paramètres pharmacocinétiques et des effets pharmacodynamiques.
L’approche bayésienne (Bayes 1702–1761) est une méthode statistique qui pondère la contribution de chaque individu à l’estimation des paramètres de la population globale. La méthode bayésienne utilise un modèle de régression non linéaire, dont un logiciel d’application, dénommé par l’acronyme NONMEM (non-linear mixed effects modeling), a été introduit par Sheiner et Beal en 1979 [37]. Cette méthode, très largement utilisée, analyse une population comportant un nombre important de sujets et a pour avantage de ne nécessiter qu’un nombre réduit de mesures de la concentration sanguine du médicament chez un sujet donné. En revanche, son inconvénient est de recourir à des calculs complexes. Néanmoins, cette méthode est très utilisée pour l’analyse des études pharmacocinétiques et leurs applications cliniques.
Pharmacodynamie
Ce qui intéresse le clinicien, c’est le profil cinétique de l’action pharmacodynamique de l’anesthésique, c’est-à-dire le délai d’installation, l’intensité de l’effet et sa durée. En grande partie ce profil cinétique dépend de l’évolution de la concentration efficace (CE ou EC effective concentration) de l’anesthésique au site d’action. Cette concentration n’étant pas mesurable en pratique, elle est assimilée à la concentration plasmatique.
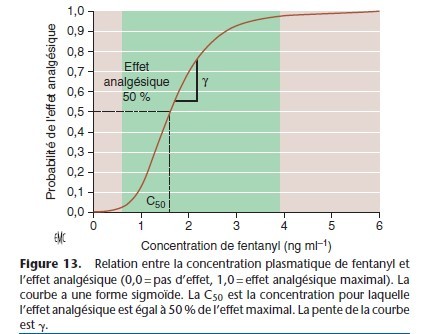
Pour la plupart des médicaments, dont les anesthésiques, la relation entre la concentration plasmatique et l’intensité de l’effet est décrite par une courbe sigmoïde (Fig. 13). L’équation standard qui décrit cette relation est l’équation de Hill :
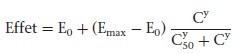
E0 = effet en l’absence du médicament ; Emax = effet maximal ; C est la concentration ou la dose ; γ est le coefficient de Hill qui représente la pente de la courbe dans sa partie dynamique ; C50 est la concentration pour laquelle l’effet est égal à 50 % de l’effet maximal.
À la phase initiale de l’administration d’un anesthésique (en bolus ou en perfusion continue), il y a un délai dans l’installation de l’effet clinique qui est lié à la distribution de l’agent, à sa pénétration tissulaire, sa fixation au récepteur et à l’induction des processus intracellulaires qui déclenchent l’effet pharmacologique.
Ce décalage entre concentration plasmatique (Cp) et effet est aussi observé dans la phase de régression de l’effet clinique.
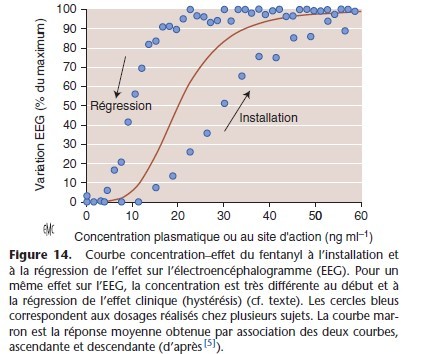
Ce décalage entre Cp et effet clinique se traduit sur la courbe concentration–effet par un hystérisis, c’est-à-dire que pour une même concentration plasmatique, l’effet est plus important au moment de la décroissance de la concentration plasmatique (Fig. 14).
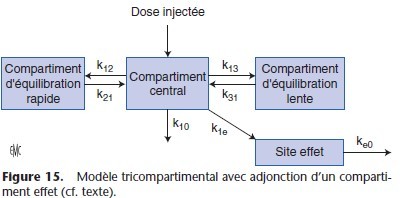
Le site d’action, le plus souvent un récepteur, est situé dans la biophase qui est en dehors des compartiments du modèle pharmacocinétique standard.
Pour décrire la relation PK/PD, il est nécessaire d’adjoindre au modèle tricompartimental un compartiment supplémentaire appelé compartiment « site effet » (Fig. 15). Les transferts de l’anesthésique entre le compartiment « site effet » et le compartiment central sont décrits avec des microconstantes de transfert k1e (transfert du volume central vers le site effet) et ke0 (élimination du site effet). La concentration au site d’action (Ce) est une concentration théorique car le compartiment « site effet » n’a pas de volume estimé et la quantité de médicament transférée du volume central vers le site effet est négligeable. L’équation qui relie la concentration plasmatique à la concentration au site d’action est :
dCe / dt = ke0 × ( Cp − Ce)
Ce = concentration au site d’action ; Cp = concentration plasmatique, ke0 = constante d’élimination du site d’action.
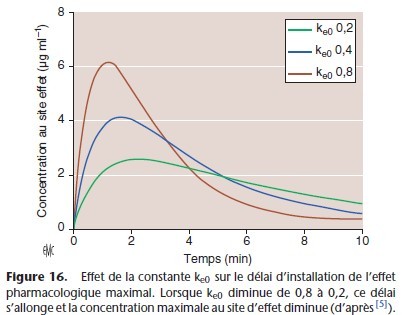
La demi-vie d’équilibration entre le plasma et le site d’action est 0,693/ke0. Ainsi, la constante ke0 influence de fac¸on importante la cinétique d’installation de l’effet clinique, la dose requise pour un certain effet clinique et le délai de dissipation de l’effet (Fig. 16).
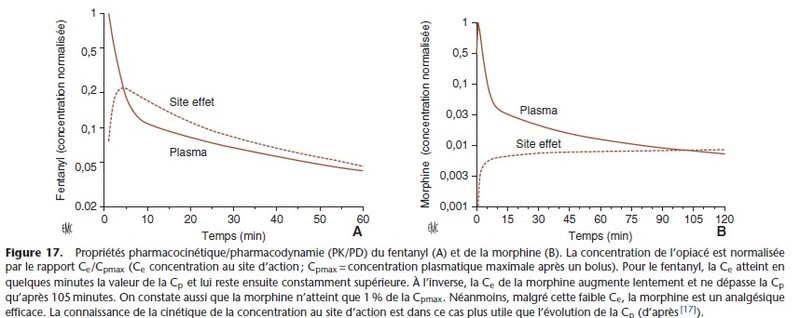
L’évolution des concentrations plasmatiques et des concentrations au site d’action du fentanyl et de la morphine objective les propriétés PK/PD très différentes des deux opioïdes (Fig. 17).
Interactions pharmacologiques des agents anesthésiques
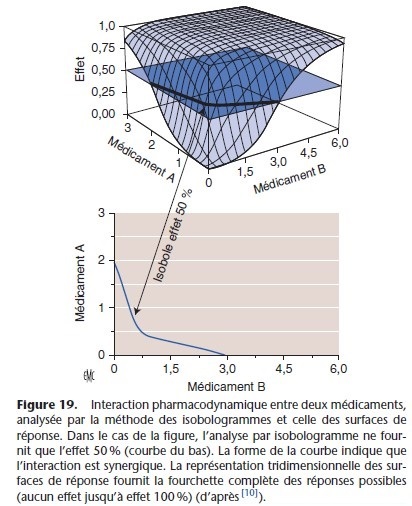
L’interaction entre deux anesthésiques, habituellement de classes pharmacologiques différentes, en fonction de leur dose est illustrée de fac¸on graphique par la méthode isobolographique.
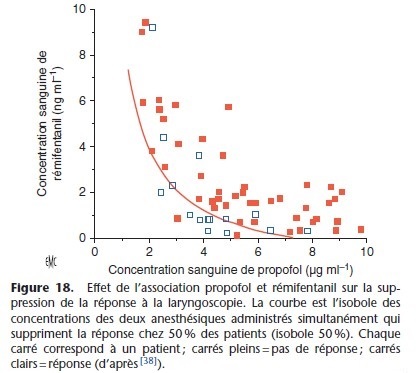
Les isobologrammes sont les courbes des isoboles qui représentent l’évolution de l’effet pharmacologique en fonction desconcentrations plasmatiques (par exemple les CE50, concentration efficace 50 %) des deux anesthésiques. L’isobole représente les différentes doses (ou concentrations) des deux anesthésiques qui lorsqu’ils sont associés aboutissent au même effet (Fig. 18) [38].
La forme de la courbe isobole identifie la nature de l’interaction entre les deux anesthésiques : interaction additive si la relation est une droite et synergique si la courbe est une hyperbole.
L’association propofol–rémifentanil est synergique comme le montre la Figure 18.
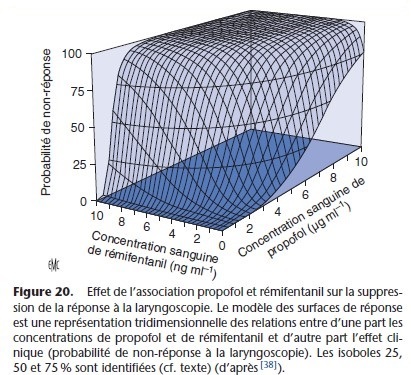
La représentation tridimensionnelle du concept des isoboles est la méthode des surfaces de réponse (response surface). Celle-ci en regroupant différentes isoboles objective la relation entre une variable dépendante (effet pharmacodynamique) et deux entrées (concentrations plasmatiques de deux anesthésiques administrés simultanément). Cette représentation graphique précise les concentrations plasmatiques de deux anesthésiques, qui lorsqu’ils sont administrés simultanément, permettent d’obtenir l’effet
pharmacologique souhaité (Fig. 19, 20). Ce modèle est appliqué à l’administration de deux anesthésiques en mode AIVOC. Il permet d’adapter les doses aux différents temps opératoires (intubation, incision, maintenance et réveil) en évitant les sous- ou surdosages.
Ce modèle est très pratique pour utiliser l’association optimale permettant un réveil rapide [9, 13, 38].
Pharmacogénétique
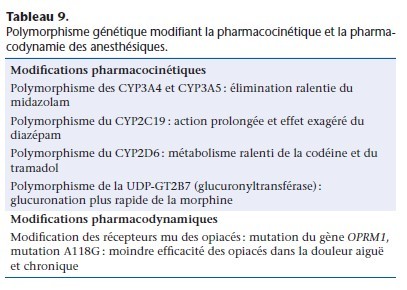
La variabilité interindividuelle de l’action des médicaments est expliquée par de nombreux facteurs, pharmacocinétiques et pharmacodynamiques. Dans certains cas, cette variabilité est liée au polymorphisme génétique des enzymes du métabolisme ou des protéines régulant l’activité des récepteurs (Tableau 9) [39–41].
Les variations des pseudocholinestérases plasmatiques ou butyrylcholinestérases, responsables de curarisations prolongées lors de l’administration de succinylcholine, sont connues depuis 1956.
En anesthésie, les variations génétiques ayant un impact pratique sont surtout celles qui modifient l’activité du système des CYP, dont le CYP3A4. Celui-ci est le CYP le plus abondant dans le foie et l’intestin et il intervient dans le métabolisme de nombreuxanesthésiques (opiacés, benzodiazépines, anesthésiques locaux).
Parmi les nombreuses mutations du CYP3A4, seule la mutation CYP3A4*18 qui diminue le métabolisme et le CYP3A4*19 qui augmente le métabolisme ont une importance clinique. Des variants génétiques ont été décrits pour le CYP2C19 et le CYP2D6 (aussi appelé débrisoquine hydroxylase). Environ 10 % des sujets sont
homozygotes pour un variant inactif du CYP2D6. Chez ces individus, la codéine, l’oxycodone et l’hydrocodone n’ont pas d’action analgésique du fait de l’absence de transformation en métabolite actif par O-méthylation. Une autre mutation du CYP2D6 accélère le métabolisme (métaboliseurs rapides) de ces opiacés, aboutissant
à une concentration plasmatique augmentée et à un risque de surdosage.
Conclusion
Les modèles pharmacocinétiques et leur application pratique permettent l’utilisation optimale des anesthésiques administrés en bolus ou en perfusion continue. L’introduction de diverses modifications dont la pharmacocinétique des populations et l’application du concept PK/PD a amélioré la précision des techniques d’administration, notamment selon le mode AIVOC
Références
[1] Gupta DK, Henthorn TK. Pharmacologic principles. In: Barash PG, Cullen BF, Stoelting RK, Cahalan MK, editors. Clinical Anesthesia. Philadelphia PA: Wolters Kluwers, Lippincott-Williams and Wilkins; 2009, p. 137–64.
[2] Shafer SL, Flood P, Schwinn DA. Basic principles of pharmacology. In: Miller RD, Eriksson LI, Fleisher LA, Wiener-Kronish JP, Young WL, editors. Miller’s Anesthesia. Philadelphia: Churchill Livingstone- Elsevier; 2010, p. 479–513.
[3] Schnider TW, Minto CF. Principles of drug action. Principles of pharmacokinetics. In: Evers AS, Maze M, Kharasch ED, editors. Anesthetic pharmacology. Basic principles and clinical practice. Cambridge: Cambridge University Press; 2011, p. 57–71.
[4] Servin F, Sear JW. Essential drugs in anesthetic practice. Pharmacokinetics of intravenous anesthetics. In: Evers AS, Maze M, Kharasch ED, editors. Anesthetic pharmacology. Basic principles and clinical practice. Cambridge: Cambridge University Press; 2011, p. 420–43.[5] Kim TK, Obara S, Johnson KB. Basic principles of pharmacology. In: Miller RD, Neal NH, Eriksson LI, Fleisher LA, Wiener-Kronish JP, Young WL, editors. Miller’s Anesthesia. Philadelphia: Saunders Elsevier; 2015, p. 590–613.
[6] Forman SA. Principles of drug action. Pharmacodynamic principles of drug action. In: Evers AS, Maze M, Kharasch ED, editors. Anesthetic pharmacology. Basic principles and clinical practice. Cambridge: Cambridge University Press; 2011, p. 1–16.
[7] Egan TD, Minto CF. Principles of drug action. Pharmacodynamic drug interactions in anesthesia. In: Evers AS, Maze M, Kharasch ED, editors. Anesthetic pharmacology. Basic principles and clinical practice. Cambridge: Cambridge University Press; 2011, p. 147–65.
[8] Shafer SL, Gregg KM. Algorithms to rapidly achieve and maintain stable drug concentrations at the site of drug effect with a computer-controlled infusion pump. J Pharmacokinet Biopharm 1992;20:147–69.
[9] Struys MM. Optimizing iv. drug administration by applying pharmacokinetic/pharmacodynamic concepts. Br J Anaesth 2011;107: 38–47.
[10] Struys MM, Absalom AR, Shafer SL. Intravenous drug delivery systems. In: Miller RD, Neal NH, Eriksson LI, Fleisher LA, Wiener-Kronish JP, Young WL, editors. Miller’s Anesthesia. Philadelphia: Saunders Elsevier; 2015, p. 920–57.
[11] Vuyk J, Sitsen E, Reekers M. Intravenous anesthetics. In: Miller RD, Neal NH, Eriksson LI, Fleisher LA, Wiener-Kronish JP, Young WL, editors. Miller’s Anesthesia. Philadelphia: Saunders Elsevier; 2015, p.821–63.
[12] Price HL. A dynamic concept of the distribution of thiopental in the human body. Anesthesiology 1960;21:40–5.
[13] Shafer SL, Varvel JR. Pharmacokinetics, pharmacodynamics, and rational opioid selection. Anesthesiology 1991;74:53–63.
[14] Minto CF, Schnider TW, Egan TD, Youngs E, Lemmens HJ, Gambus PL, et al. Influence of age and gender on the pharmacokinetics and pharmacodynamics
of remifentanil. I. Model development. Anesthesiology 1997;86:10–23.
[15] Minto CF, Schnider TW, Shafer SL. Pharmacokinetics and pharmacodynamics of remifentanil. II. Model application. Anesthesiology 1997;86:24–33.
[16] Kharasch ED. Principles of drug action. Principles of drug biotransformation. In: Evers AS, Maze M, Kharasch ED, editors. Anesthetic pharmacology. Basic principles and clinical practice. Cambridge: Cambridge University Press; 2011, p. 72–89.
[17] Gupta DK, Krejcie TC, Avram MJ. Essential drugs in anesthetic practice. Pharmacokinetics of opioids. In: Evers AS, Maze M, Kharasch ED, editors. Anesthetic pharmacology. Basic principles and clinical practice. Cambridge: Cambridge University Press; 2011, p. 509–30.
[18] Wilkinson GR, Shand DG. A physiologic approach to hepatic drug clearance. Clin Pharmacol Ther 1975;18:377–90.
[19] Nies AS, Shand DG, Wilkinson GR. Altered hepatic blood flow and drug disposition. Clin Pharmacokinet 1976;1:135–55.
[20] Blaschke TF. Protein binding and kinetics of drugs in liver diseases. Clin Pharmacokinet 1977;2:32–44.
[21] Tucker GT, Boas RA. Pharmacokinetic aspects of intravenous regional anesthesia. Anesthesiology 1971;34:538–49.
[22] Löfström JB. Tissue distribution of local anesthetics with special reference to the lung. Int Anesthesiol Clin 1978;16:53–71.
[23] Jorfeldt L. Lung uptake of lidocaine in healthy volunteers. Acta Anaesthesiol Scand 1979;23:567–74.
[24] Roerig DL, Kotrly KJ, Vucins EJ, Ahlf SB, Dawson CA, Kampine JP. First pass uptake of fentanyl, meperidine and morphine in the human lung. Anesthesiology 1987;67:466–72.
[25] Boer F. Drug handling by the lungs. Br J Anaesth 2003;91:50–60.
[26] Wood M. Plasma drug binding: implications for anesthesiologists. Anesth Analg 1986;65:786–804.
[27] Benet LZ, Hoener BA. Changes in plasma protein binding have little clinical relevance. Clin Pharmacol Ther 2002;71:115–21.
[28] Schmidt S, Gonzalez D, Derendorf H. Significance of protein binding in pharmacokinetics and pharmacodynamics. J Pharm Sci 2010;99:1107–22.
[29] Burch PG, Stanski DR. Decresased protein binding and thiopental kinetics. Clin Pharmacol Ther 1981;30:636–43.
[30] Mapleson WW. Circulation-time models of the uptake of inhaled anaesthetics and data for quantifying them. Br J Anaesth 1973;45:319–34.
[31] Davis NR, Mapleson WW. Structure and quantification of a physiological model of the distribution of injected agents and inhaled anaesthetics. Br J Anaesth 1981;53:399–406.
[32] Avram MJ, Krejcie TC. Using front-end kinetics to optimize targetcontrolled drug infusions. Anesthesiology 2003;99:1078–86.
[33] Hughes M, Glass P, Jacobs R. Context-sensitive half time in multicompartment pharmacokinetic models for intravenous anesthetic drugs. Anesthesiology 1992;76:334–41.
[34] Maitre PO, Stanski DR. Bayesian forecasting improves the prediction of intraoperative plasma concentrations of alfentanil. Anesthesiology 1988;69:652–9.
[35] Minto CF, Schnider TW. Expanding clinical applications of population pharmacodynamic modeling. Br J Clin Pharmacol 1998;46:321–33.
[36] Wright PM. Population based pharmacokinetic analysis: why do we need it; what it is; and what it has told us about anaesthetics. Br J Anaesth 1998;80:488–501.
[37] Sheiner LB, Beal S, Rosenberg B, Marathe VV. Forecasting individual pharmacokinetics. Clin Pharmacol Ther 1979;26:294–305.
[38] Mertens MJ, Olofsen E, Engbers FH, Burm AG, Bovill JG, Vuyk J. Propofol reduces perioperative remifentanil requirements in a synergistic manner: response surface modeling of perioperative remifentanilpropofol interactions. Anesthesiology 2003;99:347–59.
[39] Hogan K. Principles of drug action. Principles of pharmacogenetics. In: Evers AS, Maze M, Kharasch ED, editors. Anesthetic pharmacology. Basic principles and clinical practice. Cambridge: Cambridge University Press; 2011, p. 132–46.
[40] Landau R, Bollag LA, Kraft JC. Pharmacogenetics and anaesthesia: the value of genetic profiling. Anaesthesia 2012;67:165–79.
[41] Vuilleumier PH, Stamer UM, Landau R. Pharmacogenomic considerations in opioid analgesia. Pharmacogenomics Pers Med 2012;5:73–87.
a) Thiopental sodique (Nesdonal®, Penthotal®)
Traité d’anesthésie générale Bernard DALENS
GÉNÉRALITÉS
Le thiopental est un barbiturique soufré commercialisé sous forme de sel de sodium.
Il est conditionné en flacon de….
- 1 g de lyophilisat
- à diluer dans 20 ml d’EPI = solution à 5 % soit 50 mg/ml (déconseillé)
- ou à diluer dans 40 ml d’EPI = solution à 2,5 %, soit 25 mg/ml, (très fortement recommandé)
- ou en flacon de 0,5 g
- à diluer dans 20 ml d’EPI = solution à 2,5 %, soit 25 mg/ml
- ou à diluer dans 50 ml d’EPI = solution à 1 %, soit 10 mg/ml.
Les solutions obtenues sont stables et stériles pendant Plus d’une semaine ; normalement destinées à la voie intraveineuse,
Ces solutions peuvent s’administrer par voie rectale.
PROPRIÉTÉS PHYSICOCHIMIQUES
Le poids moléculaire du thiopental est de 264,3 Da, son pKa de 7,6 et sa liaison protéique (albumine) est proche de 90 %.
Il est très liposoluble (coefficient de partage huile/eau de 99).
PHARMACOCINÉTIQUE
Après une injection unique, les effets hypnotiques du thiopental disparaissent par redistribution vers les tissus périphériques.
Initialement, ses concentrations cérébrales sont élevées, en raison de l’importance du débit sanguin cérébral et de sa liposolubilité.
L’équilibre entre sang et site d’action est donc rapide, ce qui explique le court délai d’action.
Dans un deuxième temps, le thiopental se redistribue vers les territoires moins vascularisés ou dont le volume de distribution est plus grand (muscles, viscères, graisse).
La concentration dans ces territoires continue à monter alors qu’elle est déjà redescendue dans le cerveau à des valeurs infracliniques.
Cette redistribution explique la brève durée d’action du thiopental en injection unique malgré sa longue demie vie d’élimination et son accumulation importante en cas de perfusion continue.
Plus l’injection est rapide, plus la distribution initiale se fait vers les tissus richement vascularisés (cerveau), plus la fraction libre du thiopental est élevée et donc plus l’induction est rapide.
En cas d’hypovolémie, les concentrations intracérébrales sont plus élevées à dose équivalente, car la redistribution préférentielle du débit sanguin vers le cerveau augmente.
Chez le patient obèse, l’intensité de l’effet initial est peu modifiée car la fraction de la dose dérivée vers la graisse est faible (le débit de perfusion de la graisse est de 1 à 2 % du débit cardiaque).
BIOTRANSFORMATION
Siège du métabolisme : fraction enzymatique microsomiale du foie (cytochrome P450).
Étapes : métabolisme en acide thiobarbiturique par l’action des mono-oxygénases hépatiques et des désulfurases, puis glucuroconjugaison ; une faible fraction (2 à 3 %) est métabolisée en pentobarbital.
Élimination : urinaire (70 % sous forme métabolisée, 30 % sous forme inchangée).
PHARMACODYNAMIQUE
Mode d’action
Différents mécanismes ont été proposés pour expliquer les effets du thiopental, comme
- une activation des récepteurs alpha-aminobutyrique de type A du système nerveux central,
- une diminution de la fréquence d’ouverture des canaux chlores,
- une inhibition des canaux calciques voltage-dépendants ou une diminution de la libération des acides aminés excitateurs .
Système nerveux central
Après une phase de désinhibition avec parfois agitation à doses infrahypnotiques, le thiopental est un hypnotique et un anticonvulsivant dépourvu d’effet analgésique, sauf à concentrations subanesthésiques.
Il est faiblement amnésiant.
À fortes doses, il déprime les centres respiratoires, vasomoteurs et thermorégulateurs mais faiblement le centre du vomissement.
Il diminue le débit sanguin cérébral, la pression intracrânienne et la consommation cérébrale d’oxygène.
À l’EEG, il fait apparaître des ondes lentes de grande amplitude qui se ralentissent progressivement puis apparaissent de manière épisodique au sein de silences électriques (« burst suppression »).
Système cardiovasculaire
Le thiopental diminue la pression artérielle.
La tachycardie, assez fréquente, augmente la consommation d’oxygène myocardique et donc le débit sanguin coronaire (risque d’ischémie myocardique chez le coronarien).
Par dépression myocardique directe et diminution du tonus sympathique (baroréflexe), le thiopental abaisse le débit cardiaque.
Ces effets sont habituellement bien tolérés chez le sujet normovolémique à cœur sain, mais très mal chez le sujet hypovolémique ou souffrant de cardiopathie décompensée
Système respiratoire
Initialement, le thiopental provoque quelques mouvements d’hyperpnée puis, après une apnée transitoire, s’installe une dépression respiratoire avec diminution de la fréquence et du volume courant.
Le thiopental n’est pas à proprement parler bronchoconstricteur, mais il peut parfois provoquer un bronchospasme par stimulation cholinergique.
Autres systèmes
Le thiopental diminue le débit sanguin rénal de façon parallèle à la baisse du débit cardiaque.
Il traverse la barrière placentaire, puis se redistribue très rapidement chez la mère, ne provoquant donc pas de dépression fœtale à la dose de 3 mg/kg pour une césarienne.
Enfin, il diminue la pression intra-oculaire.
| Terrain |
Vdss (L/kg) |
Clairance (mL/min/kg) |
Demi-vie (h) |
Élimination Sous forme Inchangée (%) |
Concentration plasmatique Effective (μg/L) |
|
Adulte |
3.-6 | 3 | 8-4 | 30 | 40 |
|
Enfant |
- | 6 | ➘ | 30 | - |
|
N-né |
- | ➚ | ➚ | - | - |
|
Grossesse |
➚ | - | ➚ | - | - |
|
Ins. rénale* |
➚ | ➚ | ➚ | - | - |
|
Cirrhose* |
➚ | - | - | - | - |
|
Alcoolisme** |
➚ | ➚ | - | - | - |
|
Obésité*** |
- | - | - | - |
(-) : pas de modification de la cinétique ;
(*) : l’augmentation de la fraction libre du thiopental augmente le volume total apparent de distribution
(**) : une augmentation du volume initial de distribution diminue la concentration plasmatique initiale pour une dose unique, ce qui explique en partie les phénomènes de résistance au thiopental chez l’alcoolique ;
(***) : après une dose unique, le délai et la durée d’action sont les mêmes chez le sujet obèse et le sujet maigre.
UTILISATION CLINIQUE
| Indication | Posologie |
|---|---|
| Induction |
Adulte (IV directe lente) : 3-5 mg/kg Enfant (IV directe lente) 1-3 ans : 8-10 mg/kg 4-10 ans : 5-6 mg/kg Voie rectale : 20-25 mg/kg |
| Entretien |
Bolus IV : doses décroissantes selon signes de réveil (déconseillé +++) |
|
État de mal épileptique |
Induction : 4-5 mg/kg Entretien : 15-30 mg/kg |
|
Protection cérébrale |
15-30 mg/kg/24 h ; bolus de 4-5 mg/kg en fonction des à-coups de pression intracrânienne |
Pharmacologie clinique après une injection unique
| Voie |
Délai d’action |
Effet maximal |
Durée d’action |
|---|---|---|---|
| IV | 20-40 s | 60 s | 7à 15 mn |
| Rectale | 8-10 mn | 15 mn | 20-40 mn |
Indications
Le thiopental est un agent d’induction anesthésique.
Toutes anesthésies (sauf ambulatoire) chez le sujet ASA I et II sont ses indications privilégiées.
En réanimation, l’agent est utilisé dans le traitement de l’état de mal convulsif (après échec des autres thérapeutiques), et comme protecteur cérébral lors de poussées d’hypertension intracrânienne.
Contre-indications
Absolues : porphyrie aiguë intermittente, anesthésie ambulatoire, état de mal asthmatique, allergie aux barbituriques, obstruction respiratoire, défaillance cardiocirculatoire.
Relatives : insuffisance hépatique ou rénale, hypovolémie non compensée, insuffisance cardiaque sévère, insuffisance surrénalienne (maladie d’Addison), anémie sévère, myasthénie.
Restriction d’AMM (AMM française) : aucune. Grossesse : catégorie C de risque de la FDA. Liste II en France.
Limites et précautions d’emploi
Le thiopental fait courir un risque d’ischémie myocardique chez le coronarien mal équilibré, et de collapsus cardiovasculaire en cas de cardiopathie décompensée.
L’hypovolémie augmente l’effet initial, la durée d’action et le risque de dépression cardiocirculatoire.
En raison de son élimination lente, le thiopental risque de s’accumuler, ce qui le contre-indique pour l’entretien de l’anesthésie.
Il est préférable d’utiliser la concentration à 2,5 % afin de limiter les conséquences d’une injection extraveineuse accidentelle et d’obtenir un retour veineux franc et rapide.
Schémas pratiques d’utilisation du thiopental
Le thiopental reste l’anesthésique de référence pour l’induction chez le sujet non choqué à l’estomac plein.
INTERACTIONS MÉDICAMENTEUSES
Le thiopental peut interférer avec des traitements cardiotropes en cours (bêtabloquants, antiarythmiques et inhibiteurs calciques).
| Médicaments | Effets pharmacologiques | Type d’interaction |
|
Neuroleptiques, alcool,benzodiazépines, antihistaminiques, IMAO |
Majoration des effets hypnotiques |
Interactions pharmacodynamiques (effets additifs au niveau du SNC) |
|
Bêtabloquants, ganglioplégiques |
Potentialisation des effets dépresseurs cardiocirculatoires |
Interactions pharmacodynamiques (effets additifs) |
| Kétamine, curares, péthidine, chlorpromazine | Précipitation | Incompatibilité physicochimique |
EFFETS SECONDAIRES ET SURDOSAGE
- Excitations et tremblements à l’induction ;
- Nécroses tissulaires en cas d’injection extraveineuse,
- Ischémie du membre en cas d’injection intra-artérielle (spasme artériel) ;
- Histaminolibération (rash cutané fréquent, choc anaphylactique plus rare) ;
- Thrombophlébite locale ;
- Laryngo- et bronchospasme possibles ;
- Nausées et vomissements postopératoires,
- Toux,
- Hoquet
Le thiopental peut provoquer une histaminolibération, exceptionnellement grave quand il est utilisé seul.
Un surdosage en thiopental entraîne une dépression cardiorespiratoire nécessitant une ventilation assistée et un traitement symptomatique.
b) Ɣ-hydroxy butyrate de Na ou Acide gamma-hydroxy butyrique (GAMMA-OH®)
Xavier Sauvageon Pierre Viard In « les produits de l’anesthésie » aux Ed ARNETTE 2001
Liste I (Tableau)
PRESENTATION
-
Ampoules de 10 ml dosées à 2 g (200 mg/ml) -
Apport de 80 mg de sodium / g de Gamma-OH®).
INDICATIONS
-
Anesthésie de longue durée (supérieure à 1 - 1,5 heures), -
Utilisation associée à un analgésique, un neuroleptique, éventuellement un curare, dans le cadre d'une anesthésie balancée ou d'une neuroleptanalgésie, -
Obstétrique dystocie, épreuve du travail, césarienne. -
Neurochirurgie, sous couverture barbiturique. -
Brûlés. -
Hyperkaliémie -
Sédation (transport, tétanos, adaptation à la ventilation assistée). -
Intérêt particulier : insuffisant respiratoire, hépatique ou rénal et états de choc hémorragique.
POSOLOGIE
-
Délai d'action : 4 à 10 min -
Durée d'action : 90 min
ADMINISTRATION ITERATIVE
-
Dose d'induction : 50 - 70 mg/kg IVD - Dose d'entretien : 25 - 35 mg/kg IVD
ADMINISTRATION CONTINUE
-
Dose d'induction : 40 mg/kg IVD -
Dose d'entretien : 15 - 30 mg/kg/heure
ENFANT : induction 60 mg/kg + 2 mg/kg de thiopental dans la même seringue
CONTRE-INDICATIONS
ABSOLUES
-
Absence de matériel de réanimation. -
Bradycardie par troubles de conduction sévères.
RELATIVES
-
Ethylisme aigu. -
Anesthésie générale de courte durée -
HTA sévère non traitée -
Eclampsie -
Epilepsie non traitée -
Hypokaliémie
INTERACTIONS MEDICAMENTEUSES
-
Potentialisation du Gamma-OH® par barbituriques, neuroleptiques, halogènes (bradycardie) -
Potentialisation des curares par le Gamma-OH® -
Incompatibilité physico-chimique dextromoramide, prométhazine, thiopental.
PHARMACOCINETIQUE
-
Cinétique incomplètement étudiée -
Liaison protéique pas de fixation -
Passe la barrière foeto-placentaire -
Métabolisme : hépatique (alcoolo-déshydrogénase) -
Le catabolisme du Gamma-OH® s'intègre dans le cycle de Krebs par l’acide succinique.
Activité pharmacologique rattachée à la formation do 2 métabolites, le GABA et la butyrolactone
-
Elimination -
urinaire -
respiratoire (2/3 de la dose en 6 heures sous forme do C02),
PHARMACOLOGIE
SYSTEME NERVEUX CENTRAL
-
Hypnotique pur entraînant un sommeil physiologique, -
Effet analgésique nul -
Diminution du seuil épileptogène ; action convulsivante possible à forte dose -
Dépression des centres vasomoteurs et thermorégulateurs, -
Diminution des réflexes pharyngé, laryngé et glottique. -
Abolition du réflexe palpébral ; réflexe cornéen présent, -
Réveil rapide, calme et agréable. -
Pression intra-crânienne, débit sanguin cérébral et consommation d'oxygène cérébral diminués, -
EEG : apparition d'un rythme théta, puis des ondes lentes, et tracé plat accompagné de bouffées polyrythmiques.
CARDIO-VASCULAIRE
-
Diminution de la pression artérielle à l'induction, puis retour à la normale (toute augmentation correspond à un défaut d'analgésie). -
Dépression myocardique modérée. -
Bradycardie sinusale. -
Diminution du débit cardiaque, en raison de la bradycardie et de la diminution du volume d'éjection systolique. -
Augmentation de l'excitabilité myocardique.
PULMONAIRE
-
Bradypnée avec augmentation de l'amplitude respiratoire et du volume courant -
Pas de dépression respiratoire (ventilation par minute inchangée). -
Conservation de la réflectivité des centres respiratoires au C02. -
Diminution des sécrétions bronchiques. -
Augmentation de la compliance thoraco-pulmonaire.
DIVERS
-
Utérus : augmentation du tonus, de l'amplitude et de la fréquence des contractions utérines ; hypertonie en association avec les ocytociques. -
Diminution de la pression intra-oculaire, mydriase. -
Hypotonie musculaire (par action dépressive médullaire), chirurgicalement insuffisante, hypotonie des masséters. -
Légère hypothermie.
EFFETS INDESIRABLES
-
Myoclonies à l'induction. -
Somnolence prolongée après le réveil. -
Respiration de type Cheyne-Stockes au réveil. -
Bradycardie sinusale marquée. -
Hypokaliémie (trouble de l'excitabilité myocardique) -
Hypersialorrhée à l'induction.
SURDOSAGE
-
Somnolence prolongée.
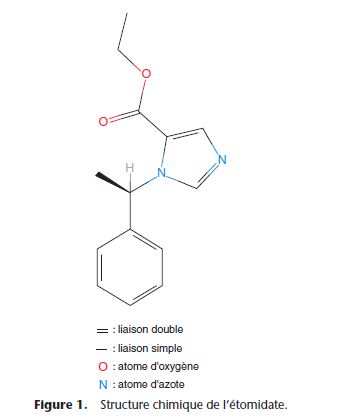
c) Étomidate (Hypnomidate®)
F. d'Athis: Professeur des universités, praticien hospitalier.Département d'anesthésie-réanimation A, hôpital Lapeyronie, route de Ganges, 34059 Montpellier , cedex France .36-305-B-35 (1991)
Introduction
Synthétisé en 1964 par Janssen et al. , l’étomidate est utilisé en pratique clinique depuis 1972.
Sa forme galénique la plus ancienne (Hypnomidate®) est aujourd’hui retirée du marché aux États-Unis, en Australie, au Canada et en République d’Irlande et remplacée par une nouvelle spécialité (Étomidate Lipuro®).
Avantage:
- Discrétion du retentissement hémodynamique (agent de choix chez le sujet à mauvais risque CVX).
- Absence de libération d'histamine .
- Grande marge de sécurité
DE 50/DL 50 étomidate = 26,
DE 50/DL 50 Thiopental = 4,6
Inconvénients:
- Mouvements anormaux,
- Nausées et vomissements
- Inhibition de la sécrétion de cortisol contre-indique son emploi en perfusion de longue durée.
Propriétés physico-chimique
L'étomidate (Hypnomidate®) est un dérivé imidazolé
PM= 244,29.
Très lipophile
Base faible : pKa = 4,24 ⇒ au pH physiologique de 7,40 elle n’est pratiquement pas ionisée (1 %).
Liaison aux protéines modérée = 76,5 % (en majorité avec l'albumine ; 2,5 % aux gammaglobulines).
Présentation
Conditionné sous deux formes: d'induction et de perfusion.
- Induction : ampoules de 10 ml(20 mg d'étomidate base+ 3,5 ml de solvant, le propylène glycol).
- Perfusion : ampoules de 1 ml (143 mg de chlorhydrate d'étomidate ,soit 125 mg d'étomidate base dans 1 ml d'éthanol.) L'ampoule est diluée extemporanément dans un soluté salé à 0,9 % ou glucosé à 5 ou 10 %
Propriétés pharmacocinétiques
| Paramètre |
Valeur (moy ± DS) |
|---|---|
|
T 1/2α demi-vie initiale (min) T 1/2β demi-vie intermédiaire (min) T1/2δ demi-vie d’élimination (h) Vdc Volume du compartiment central (l) Vdss volume de distribution apparent (l kg–1) Fraction dans le compartiment central (%) Concentration plasmatique efficace (μg ml–1) Clairance plasmatique totale (ml min–1) Clairance hépatique (ml min–1) |
2,6 ± 1,3 28,7 ± 14,0 4,6 ± 2,6 23,2 ± 11,4 4,5 ± 2,21 7 > 0,2 860 ± 230 739 |
Distribution
Après une dose unique en IV, cinétique triexponentielle.
La distribution initiale =2 à 3 min (se fait dans un compartiment central incluant le sang et le cerveau).
Redistribution = 20 à 25 min (se fait rapidement vers un compartiment périphérique, (deuxième phase de décroissance plasmatique,)
Un équilibre plus lent s'établit ensuite entre le compartiment central et un compartiment profond.
Cette dernière phase dure 4 à 5 h et correspond à l'élimination du produit.
VD est élevé 4,5 l/kg car la molécule est très lipophile; le volume du compartiment central ne représente que 7 % du VDss.
Répartition dans le sang total: 38 % dans les hématies, 48 % protéines plasmatiques et 14 % sous forme libre.
Le produit étant très liposoluble et sa fraction libre étant presque totalement non ionisée (99 %), la traversée des barrières hémato encéphalique et placentaire est rapide.
La concentration chez le fœtus est modérée : rapport fœto-maternel de 0,51 ± 0,3
Biotransformation et élimination
Rapidement hydrolysé par les estérases hépatiques.
Clairance plasmatique totale (Clp) ≈ clairance hépatique (le classe parmi les molécules à coefficient d'extraction hépatique élevé : 0,8.)
Toute diminution du débit sanguin hépatique ( Q ° h) abaissera donc la Clp.
Malgré la petite fraction de produit présente dans le compartiment central, le coefficient d'extraction élevé permet une élimination rapide : 90 % en 24 h, principalement par voie urinaire (78 %).
Seuls 2 % de cette élimination se font sous forme inchangée, le reste est représenté par des métabolites inactifs, essentiellement l'acide carboxylique
Cinétique de l'étomidate en perfusion
La rapidité de sa distribution initiale et de sa redistribution périphérique destinent l'étomidate à une utilisation en perfusion.
Un bolus de 0,3 mg/kg permet de remplir le volume initial de distribution (Vdc).
L'entretien est alors assuré par une dose destinée à compenser la perte due à l'élimination du produit, donc calculée d'après la clairance.
Pour des perfusions d'une durée n'excédant par 2 h, l'équilibre de distribution n'est pas encore achevé à la fin de la perfusion.
Lors de son arrêt, la concentration minimale hypnotique se situe dans la phase rapide de la courbe de décroissance plasmatique et le réveil est précoce : 10 à 15 minutes.
Pour des durées de perfusion supérieures à 2 h, le troisième compartiment a eu le temps de se remplir. Lors de l'arrêt de la perfusion, la concentration hypnotique minimale n'est atteinte que tardivement et le réveil est retardé.
Une perfusion de 48 h montre que l'état stationnaire est obtenu après 4 à 5 h et qu'il existe à ce stade une relation linéaire entre la dose et la concentration plasmatique obtenue.
Perfusion continue
Administré en perfusion continue et aux doses habituellement utilisées la pharmacocinétique du propofol est linéaire : le plateau de concentration mesuré (steady-state) est proportionnel au débit de perfusion.
La concentration mesurée après 2 heures de perfusion continue est d'environ 85 % de la valeur d'équilibre.
Facteurs de variation de la pharmacocinétique
Variations physiologiques
Enfant:
Le Vdc de est supérieur à celui de l'adulte; l'équilibre se faisant plus lentement entre le Vdc et le VDss, la demi-vie initiale est plus longue.
De plus la Clp est plus élevée du fait de l'augmentation de la vitesse de métabolisation hépatique et de celle du Q ° h.
Adulte + 65 ans :
Diminution du Vdc et de la Clp .
La baisse de la Clp est expliquée par celle du Q ° h, entraînant un allongement de la demi-vie d'élimination.
Variations pathologiques
Malades cirrhotiques: VDss et demi-vie d'élimination deux fois supérieurs à la normale
Le retard d'élimination est mis sur le compte de l'important volume de distribution.
Insuffisants hépatiques : réduction de la Clp.
Interférences médicamenteuses
Inhibition du métabolisme hépatique de certains agents anesthésiques, qui pourrait retarder l'élimination de produits à clairance hépatique basse comme le diazépam, mais pas ceux ayant une clairance élevée comme le fentanyl par exemple.
Une augmentation de la ½t de l'étomidate par de hautes doses de morphine a également été notée.
Effets pharmacodynamiques
Effets sur le système nerveux central
Effet hypnotique
En bolus, induit le sommeil dès le premier passage cérébral.
Ainsi, avec une dose de 0,3 mg/kg injectée en 10 à 30 sec, le sommeil apparaît dans les 30 sec et dure 4 à 6 mn.
Le délai d'induction augmente lorsque l'on diminue la vitesse d'injection.
Ainsi, avec une perfusion de 0,1 mg/kg/min, le sommeil met 136 sec à s'installer.
La mesure des taux sanguins maximaux obtenus après 0,3 mg/kg montre que ceux-ci atteignent en moyenne 1,59 g/ml après injection rapide (10 sec) et 1,30 ± 0,38 g/ml après injection lente (30 sec).
La durée du sommeil varie avec la dose injectée : 3 mn pour 0,15 mg/kg, 6 à 8 minutes pour 0,45 mg/kg .
Elle est prolongée par l'utilisation d'une prémédication.
le réveil complet demande 20 à 40 minutes selon la dose injectée .
0,3 mg/kg d'étomidate = 4 mg/kg de thiopental=2,5 mg/kg de propofol.
L'étomidate n'abolit pas tous les réflexes :
- le réflexe oculo-palpébral ne disparaît qu'en début de narcose,
- les réflexes photomoteur et cornéen sont conservés,
- la réflectivité pharyngo-laryngée est maintenue.
L'étomidate est dénué d'effet analgésique.
l'hémodynamique & métabolisme cérébral
En perfusion réduction du débit sanguin cérébral (DSC) de 34 %, expliquée par une diminution de la consommation d'oxygène cérébrale (CMRO2) de 45 % réduction de la PIC.
La réduction du DSC et de la CMRO2 est supérieure si l'on associe l'étomidate au N2O et au fentanyl.
La réactivité de la circulation cérébrale au CO2 est maintenue.
La pression artérielle moyenne (PAM*) est conservée si bien que la pression de perfusion cérébrale (PPC) (obtenue par l’équation Suivante : PPC = PAM – PIC) est conservée
* PAM = PAD + 1/3 (PP).
Ou PP = pression artérielle pulsée, ou différentielle (PP = PAS – PAD)
Effets cardiovasculaires
Variations hémodynamiques modiques.
Après une injection de 0,3 mg/kg les paramètres CVX (Pa, VES, IndC, RVS )demeurent stables.
Par ailleurs, l'absence de modification du tonus vasculaire a été confirmée chez des sujets porteurs d'un cœur artificiel permettant de conserver un débit cardiaque constant malgré une diminution du retour veineux .
En fait, l'étomidate est rarement utilisé seul. Il ne prévient pas la réponse sympathique déclenchée par l'intubation trachéale ; l'adjonction de fentanyl limite cette réaction et peut même l'annuler
L'étomidate entraîne une vasodilatation coronaire avec élévation du débit sanguin coronaire de 19 %, sans modification significative de la consommation d‘O2 du myocarde ni de la consommation de lactates et de glucose par le myocarde.
Il est ainsi proposé en association avec le fentanyl pour l'induction anesthésique du coronarien
Chez les sujets atteints de cardiopathie valvulaire, les mesures effectuées après étomidate ou étomidate-fentanyl révèlent une chute de la Pa de 20 % avec réduction de l'IC de 10 % et des RVS de 14 %. La diminution du travail du ventricule gauche permet de tolérer ces modifications.
Effets respiratoires
L'étomidate n'induit qu'une faible dépression respiratoire qui est dose-dépendante.
En l'absence de prémédication, un bolus de 0,3 mg/kg entraîne une accélération de la fréquence respiratoire (FR) qui compense la diminution du volume courant (Vt).
L'absence de modification du débit inspiratoire moyen fait penser que la réduction du Vt n'est pas d'origine centrale.
Avec une dose de 0,45 mg/kg, la FR ne s'accélère pas et la réduction du Vt entraîne une hypoventilation avec hypercapnie modérée.
Chez les malades prémédiqués avec de la morphine ou une benzodiazépine, une apnée de brève durée (inférieure à une minute) suit le plus souvent l'induction.
L'étomidate n'a pas d'action sur la musculature bronchique.
Effets endocriniens
Effets endocriniens
Après un bolus de 0,2 à 0,4 mg/kg
Le taux de cortisol chute, alors que celui de son précurseur, le 11-désoxycortisol, s'élève à des chiffres 10 fois plus importants qu'avec le thiopental.
Le taux d'ACTH augmente de 100 %. La concentration de progestérone reste constante mais la 17-alpha-hydroxyprogestérone s'élève .
Cette inhibition est dose-dépendante ; elle existe déjà pour de très faibles doses (0,04 mg/kg) qui n'entraînent pas de perte de conscience .
Elle disparaît en quelques heures après une injection unique ; après une perfusion de 90 à 120 minutes, les différentes concentrations plasmatiques sont normalisées dans les 24 heures.
Des résultats comparables ont été obtenus avec l'utilisation d'étomidate en perfusion (0,03 mg/kg/min pendant 2 à 3 h) chez l'enfant .
Aucune répercussion clinique n'est notée.
Ces perturbations sont générées par un blocage de la synthèse des hormones corticosurrénaliennes.
Actions sur les autres appareils
Diminue la pression intraoculaire(Effet est supérieur à celui de thiopental).
En association avec du fentanyl et du dropéridol, la baisse de la pression intraoculaire peut atteindre 61 %
Chez l'homme sain, le dosage des enzymes hépatiques (SGOT, SGPT, phosphatases alcalines, gamma-GT) ne montre pas en moyenne de variation significative après administration d'étomidate
Aucune influence n'a été démontrée sur la pression intragastrique et la sécrétion gastrique, le débit sanguin rénal, les contractions utérines et le débit sanguin utérin
Effets indésirables
Manifestations excitatoires
Par rapport aux autres agents hypnotiques (thiopental, propofol), l’étomidate est associé à des mouvements myocloniques à l’induction anesthésique avec une incidence pouvant atteindre 75 à 80 % .
C’est bien la molécule et non son solvant qui est à l’origine de cet effet indésirable dosedépendant et minimisé par la prémédication.
Il semble que les myoclonies soient liées à une désinhibition transitoire des structures cérébrales profondes sous-corticales.
L’hypnotique pourrait avoir des latences d’action différentes au niveau des zones cérébrales corticales déprimées rapidement et les zones sous-corticales atteintes dans un second temps.
Les craintes initiales d’une activité proconvulsivante de l’étomidate, ainsi que les réserves émises quant à son utilisation chez des patients épileptiques ne sont donc pas fondées.
En effet, des études expérimentales ainsi que des cas cliniques confirment l’action anticonvulsivante de l’étomidate
Avec une prémédication à base de morphine ou une de benzodiazépine leurs fréquences est moins importantes.
Des cas de survenue de myoclonies ou surtout de rigidité musculaire ont été décrits lors du réveil. En effet, l'activité du système sous-cortical peut alors reprendre avant que le cortex ne soit capable de jouer son rôle inhibiteur.
La fréquence de la toux et du hoquet est faible mais paraît en relation avec la survenue de myoclonies.
Nausées et vomissements surviennent fréquemment au réveil (25 à 30 %), davantage qu'avec les autres hypnotiques IV. L'association au fentanyl en augmente la fréquence ; l'utilisation d'atropine en prémédication la diminue.
Effets locaux
La fréquence des douleurs déclenchées par l'injection d'étomidate est importante (jusqu'à 60 %).
Comme pour les autres produits, le calibre de la veine joue un rôle important : 44 % de douleur après injection dans une veine du dos de la main, 8 % dans une veine de l'avant-bras.
Cette douleur peut être à l'origine du déclenchement de myoclonies.
Une prémédication à base de morphinique en diminue la fréquence ; l'efficacité de l'injection préalable de fentanyl dépend ici aussi de la dose employée .
La survenue d'une thrombophlébite dans les suites opératoires est rare (5 %) et ne semble en rapport ni avec le déclenchement d'une douleur lors de l'injection, ni avec la nature du solvant.
Accidents immuno-allergiques
L'étomidate présenté en solution dans du propylène glycol n'induit pas de libération d'histamine.
Modalités d'administration
Utilisation en bolus
- Induction = 0,3 mg/kg injectée en 20 à 40 secondes.
- Le sommeil en 30 sec et dure 4 à 6 mn.
- Entretien : 0,25 à 1,8 mg/kg/h suivant le type de chirurgie .
- Enfant de 2 à 13 ans : (peut être nécessaire d'augmenter la posologie). Une dose de 30 % supérieure à la dose utilisée chez l'adulte est parfois nécessaire
- Pas d’effet analgésique.
- L'administration d'un morphinique ou d'une benzodiazépine diminue l'incidence des myoclonies observées à l'induction. L'utilisation d'une veine de calibre important permet de réduire la fréquence et l'intensité de la douleur de l'injection.
- La pharmacocinétique justifie une réduction de dose chez le sujet âgé (0,2 mg/kg) bien que l'excellente tolérance hémodynamique du produit ne la rende pas indispensable.
Utilisation en perfusion
En perfusion pour l'entretien = 10 à 30 µg/kg/min selon l'âge et les produits associés.
Perfusion dès l'induction = 100 µg/kg/min, le sommeil étant obtenu dans les 2 mn.
Cette technique d'induction permet de réduire l'incidence des myoclonies, de la douleur et des thrombophlébites.
Le morphinique est ajouté soit en injections intermittentes, soit en perfusion à la dose de 0,06 à 0,08 µg/kg/min pour le fentanyl, de 1 à 2 µg/kg/min pour l'alfentanil.
Le réveil survient en moyenne en 10 mn (2 à 47 selon la durée de la perfusion qui était ici de 1 à 6 h).
Chez l'enfant, la dose conseillée est de 40 à 50 µg/kg/min.
Seules les perfusions de courte durée (quelques heures) sont acceptables en raison du risque endocrinien. L'utilisation de cet agent en sédation a été abandonnée.
Indications particulières
l'hypnotique de choix chez le patient allergique .
Cet avantage ainsi que la bonne tolérance sur les plans respiratoire et cardio-vasculaire en font une bonne indication dans l'anesthésie de l'asthmatique.
Des états de mal résistant aux traitements habituels ont même été traités avec succès par une perfusion d'étomidate, la supplémentation en cortisone étant bien sûr assurée conjointement.
L'absence d'effet bronchoconstricteur et le maintien d'une ventilation suffisante associés à sa brièveté d'action justifient son emploi pour les endoscopies ORL et la microchirurgie du larynx.
La discrétion des répercussions hémodynamiques explique son choix chez le sujet à risque cardio-vasculaire élevé.
L'absence de chute des RVS après le bolus d'induction et la possibilité de limiter, voire d'éviter grâce à l'injection d'un morphinique, l'hypertension artérielle liée à l'intubation trachéale indiquent cet agent chez le patient coronarien, hypertendu ou atteint de valvulopathie.
La stabilité des paramètres hémodynamiques, et en particulier de la précharge du ventricule gauche, est appréciée chez l'opéré en état de choc.
La maniabilité du produit (induction rapide, courte durée d'action, utilisation possible en perfusion), la discrétion de ses effets ventilatoires et cardio-vasculaires et la diminution de la PIC justifient son emploi pour l'anesthésie préhospitalière des polytraumatisés.
Les modifications pharmacocinétiques induites par les états de choc impliquent une réduction de la dose d'induction (0,1 à 0,2 mg/kg)
L'étomidate est conseillé pour induire l'anesthésie chez les sujets atteints d'hypertension intracrânienne.
L'étomidate a été employé avec succès pour traiter des états de mal convulsifs résistant aux traitements habituels
Les résultats obtenus ont conduit les auteurs à conserver cette indication sous couvert d'une corticothérapie maintenue 72 h après l'arrêt de la perfusion.
Les interventions ophtalmologiques nécessitant une diminution de la pression intraoculaire sont une bonne indication de l'étomidate.
Contre-indications
- Enfant de moins de 2 ans.
- Hypersensibilité connue à l'étomidate.
Il est évident que les conséquences endocriniennes contre-indiquent l'étomidate dans la réalisation de perfusions de longue durée.
Dans le cas où les avantages de cet agent paraissent majeurs, une supplémentation par cortisone doit pallier les conséquences de son défaut de synthèse.
Pour la même raison, les sujets déjà susceptibles d'être victimes d'une insuffisance corticosurrénalienne doivent être exclus.
Il est préférable de l'éviter chez l'épileptique.
Déconseiller en cas de porphyrie d'origine hépatique
d) Propofol (Diprivan®)
Xavier Viviand: Praticien hospitalier,Département d'anesthésie-réanimation, hôpital Nord, chemin des Bourrellys, 13915 Marseille cedex 20 France, extrait E.M.C.36-305-A-10 (1998). Arrangement : BMS
Historique
- Le propofol est le résultat de recherches menées au début des années 1970 sur les dérivés alkyls du groupe phénol qui avait démontré une activité hypnotique chez l'animal. Il s'en est suivi la découverte du 2,6 di-isopropylphénol.
- La première publication rapportant son utilisation comme agent d'induction chez l'homme date de 1977.
- Cependant très rapidement, des réactions anaphylactoïdes dues au solvant (Crémophor EL) ont été décrites. Il a donc été nécessaire de reconditionner la molécule dans une émulsion lipidique (1983).
Propriétés physico-chimiques
- Le propofol est le 2,6-di-isopropylphénol (IC 35868) .
- PM =178.
- Solvant = - émulsion lipidique à base d'huile de soja, phosphatides d'oeuf et de glycérol (Intralipide® à 10 %). Il est alors isotonique et possède un pH neutre.
- La formulation actuelle possède une concentration de 1 % (10 mg/ml) ou 2 %.
- Stockage: entre 2°C et 25°C.
- Absence de conservateur, et d’agent antimicrobien.
Plusieurs formes de conditionnement existent :
- Ampoule de 10 ml contient 100 mg de propofol.
- Ampoule de 20 ml contient 200 mg de propofol.
- Flacon de 20 ml contient 200 mg de propofol.
- Flacon de 50 ml contient 500 mg de propofol.
- Flacon de 100 ml contient 1000 mg de propofol.
- Seringues préremplies, d'une capacité de 50 mL,destinées à l'appareil de perfusion Diprifusor® dans le cadre d'une administration par AIVOC.
Propriétés pharmacocinétiques
Administration en bolus
- Après une IV en bolus, les [ ] sanguines de propofol diminuent rapidement à la suite à la fois de phénomènes de distribution et d'élimination.
- La distribution se fait vers les compartiments périphériques superficiels (muscles) et surtout profonds (graisse) du fait de la liposolubilité de la molécule.
- La pharmacocinétique du propofol obéit à un modèle tricompartimental .
LIAISON PROTEIQUE
Le propofol est très fortement lié aux protéines humaines (97-98 %), en particulier à l'albumine, et aux érythrocytes.
METABOLISME:
Son métabolisme est rapide par glucuro- et sulfoconjugaison hépatiques. Les produits de dégradation sont solubles dans l'eau et excrétés par le rein (plus de 88 % de la dose injectée). Moins de 1 % de la dose est éliminé inchangé dans l'urine et 2 % dans les selles.
VOLUME DE DISTRIBUTION:
Le volume du compartiment central (V1) est de l'ordre de 15 à 20 L et le volume de distribution à l'état d'équilibre (VdSS) est compris entre 150 et 700 L.
CLAIRANCE:
La clairance métabolique est très élevée 25 à 35 mL·kg-1·min-1. Elle est supérieure au débit sanguin hépatique, ce qui traduit l'existence d'autres sites de biotransformation comme l'ont démontré les études pharmacocinétiques réalisées lors de la phase anthépatique des transplantations du foie .
Perfusion continue
Administré en perfusion continue et aux doses habituellement utilisées la pharmacocinétique du propofol est linéaire : le plateau de concentration mesuré (steady-state) est proportionnel au débit de perfusion.
La concentration mesurée après 2 heures de perfusion continue est d'environ 85 % de la valeur d'équilibre.
Notion de demi-vie contextuelle
À l'arrêt de la perfusion, la courbe de décroissance des concentrations sanguines est caractérisée par deux périodes successives.
- En premier lieu, on observe une diminution très prononcée et rapide des taux sanguins. Cette décroissance est secondaire au transfert du propofol du sang vers les compartiments périphériques. C'est durant cette phase que se produit en 5 à 10 minutes le réveil immédiat (ouverture des yeux à la commande).
- Puis la courbe de décroissance s'infléchit fortement. La diminution des concentrations est alors due au métabolisme de la molécule et au retour très lent du propofol du compartiment profond vers le sang.
Ceci explique que la demi-vie d'élimination terminale soit longue ( 3,5 h). La discordance entre la rapidité du réveil clinique et la durée de la T1/2 a conduit Hugues et al à proposer un nouveau paramètre plus pertinent pour prévoir les délais de réveil immédiat quelle que soit la durée de l'administration de l'agent IV. Ils ont appelé ce paramètre la demi-vie contextuelle (context-sensitive half-time).
Il est égal au délai nécessaire pour obtenir une diminution de concentration de 50 % à l'arrêt d'une perfusion de durée déterminée.
En cas de perfusion de courte durée, la demi-vie contextuelle = 5 à 10 mn.
Si la durée d'administration augmente, la demi-vie contextuelle en fait de même sans toutefois atteindre la valeur de la T1/2.
Le propofol est l'hypnotique dont la demi-vie contextuelle est la plus courte.
Facteurs de variation de la pharmacocinétiques
Sexe
Chez la femme, le Vd est diminué et la clairance augmentée lorsqu'on exprime les paramètres en fonction du poids. L'implication clinique de ces modifications semble faible mais pourrait expliquer un réveil plus rapide par rapport à l'homme.
Âge
L'âge est le principal facteur de variation de la pharmacocinétique du propofol . La diminution du volume du compartiment central V1 et de la clairance (- 20 %) expliquent que pour une dose identique, la concentration mesurée est plus importante chez le vieillard que chez le sujet jeune.
La diminution de la protidémie entraîne également une augmentation de la concentration de propofol libre.
Enfin, du fait d'une diminution du débit cardiaque, les phénomènes de distribution sont perturbés. En revanche, les paramètres pharmacodynamiques ne semblent pas différents de ceux de l'adulte jeune .
Obésité
Il existe une corrélation positive entre le poids, la clairance métabolique et le VdSS en cas d'obésité majeure .
Le volume initial de distribution et la demi-vie d'élimination terminale demeurent inchangés.
Ces modifications pharmacocinétiques expliquent que la dose d'induction soit similaire à celle d'un patient de poids normal mais que les doses d'entretien doivent être augmentées.
Insuffisance rénale et hépatique
La pharmacocinétique du propofol chez les patients cirrhotiques et insuffisants rénaux est peu différente de celle de l'adulte sain.
En revanche, chez l'alcoolique chronique, les doses d'induction sont plus élevées (2,7 mg·kg-1).
Interactions pharmacocinétiques avec d'autres agents de l'anesthésie
Alfentanil: la cinétique du propofol inchangé mais baisse de la clairance du morphinique ensuite augmentation des taux sanguins d‘Alfentanil.
Fentanyl: Le propofol ne modifie pas sa pharmacocinétique.
L'halothane et l'isoflurane : augmentation des [ ] de propofol et baisse de sa clairance.
Midazolam: Pas d’interaction pharmacocinétique.
Effets pharmacodynamiques
Effets sur le système nerveux central
Effets hypnotiques et sur les fonctions cérébrales supérieures
Le propofol est un agent hypnotique. Il interagit au niveau du site GABA, à un niveau distinct de celui des benzodiazépines.
Après l'injection d'un bolus de 2,5 mg·kg-1 en 20 secondes, la perte de conscience est rapide (délai bras-cerveau d'environ 30 s) et dure en moyenne 5 à 10 mn.
Il est deux fois plus puissant que le thiopental (de 1 : 1,3 à 1 : 2,89 en fonction du critère de jugement choisi).
Il entraîne une amnésie marquée inférieure à celle produite par les benzodiazépines pour un même degré de sédation .
Effets sur l'hémodynamique cérébrale
Le propofol possède une action vasoconstrictive in vivo comme le prouve l'augmentation des résistances vasculaires mesurées (+ 50 %) et la diminution de 26 à 51 % du débit sanguin cérébral (DSC).
La consommation en oxygène cérébrale (CMRO2) diminue de 36 % mais le couplage DSC-CMRO2 est conservé. D’où diminution de la (PIC) de l'ordre de 30 %.
L'autorégulation cérébrale et la réactivité au CO2 sont maintenues chez le sujet sain. Le niveau de pression de perfusion cérébrale (PPC) dépend de la valeur de la pression artérielle moyenne (PAM).
Effets cardiovasculaires
Description
Important retentissement cardiovasculaire, associant classiquement
- hypotension artérielle et ralentissement de la fréquence cardiaque. Une dose d'induction de 2 à 2,5 mg·kg-1 s'accompagne d'une diminution de 25 à 40 % de la pression artérielle (systolique, moyenne et diastolique). Cet effet est plus marqué que celui du thiopental.
- La chute du débit cardiaque (- 15 %) et du volume d'éjection systolique (-20 %) est plus modérée.
- Une diminution des résistances vasculaires systémiques (-15 à - 25 %) et de l'index de travail du ventricule gauche (-30 %) est observée.
Les facteurs de risque d'hypotension artérielle sont:
- un âge supérieur à 65 ans,
- l'administration concomitante de morphiniques,
- la chirurgie abdominale et orthopédique,
- le sexe féminin,
- la prise de benzodiazépines et de bêtabloquants
- les patients ASA III .
Effets respiratoires
Dépression respiratoire avec propofol plus importante qu’avec le thiopental.
Des apnées transitoires peuvent survenir.
fréquence et la durée de ces apnées dépendent
- de la dose administrée,
- de la vitesse d'injection
- et des associations médicamenteuses (en particulier du type de la prémédication et de l'adjonction de morphiniques).
Aucune altération des paramètres ventilatoires pour des [ ] correspondant à une sédation clinique, c'est-à-dire sans perte de conscience.
L'adjonction d'un morphinique (alfentanil) potentialise l'hypoventilation alvéolaire, comme en témoigne l'augmentation du CO2 expiré recueilli au niveau pharyngé .
Le propofol et le thiopental diminuent de façon similaire la pente de la réponse au CO2. Cet effet est encore présent chez un patient réveillé puisque la normalisation de la réponse au CO2 nécessite environ 20 minutes.
La réponse ventilatoire à l'hypoxie est diminuée de façon similaire à ce qui est observé avec l'halothane.
La vasoconstriction pulmonaire hypoxique est maintenue et cette propriété est importante dans le cadre de la chirurgie pulmonaire .
Bronchomotricité : effet favorable .
Par rapport au thiopental et à l'étomidate, les résistances respiratoires et la compliance thoracoabdominale demeurent stables lors de l'induction anesthésique chez les sujets sains. Le même résultat peut être retrouvé chez des patients ayant une hyperréactivité bronchique. Le propofol apparaît comme l'agent IV de choix pour l'induction du patient asthmatique.
Au niveau des voies aériennes supérieures, le propofol entraîne une meilleure relaxation et une diminution de la sensibilité de la sphère oropharyngée par report au thiopental.
Autres effets
Effets sur la pression intraoculaire (PIO)
L'administration de propofol lors de l'induction anesthésique diminue d'environ 30 à 50 % la valeur de la PIO. L'intubation trachéale s'accompagne d'une remontée de la PIO qui ne dépasse cependant pas les valeurs préopératoires.
Effets musculaires
Le propofol n'a aucun effet sur l'électromyogramme de surface ou provoqué. Il n'existe pas de potentialisation de l'effet musculaire des curares dépolarisants ou non dépolarisants. Le propofol est utilisable sans restriction chez les sujets sensibles à l'hyperthermie maligne ou porteurs d'une myopathie
Effets allergiques
Des rashs cutanés sont rapportés chez 0,2 % des patients. Quelques cas de réactions anaphylactiques vraies ont été prouvés par des tests paracliniques. C'est la molécule de propofol et non le solvant qui est en cause. Un risque d'allergie croisée avec les curares non dépolarisants a été décrit.
Effets digestifs, hépatiques et rénaux
Le propofol diminue le réflexe de déglutition mais la récupération est rapide. Il ne ralentit pas le transit digestif et diminue de façon modeste les débits hépatiques et rénaux chez l'animal. Chez l'homme, les tests hépatiques postopératoires ne sont pas modifiés.
La fonction rénale n'est pas altérée. Au cours des perfusions de longue durée, une coloration verte des urines peut apparaître, provoquée par un des métabolites du propofol (dérivé quinol).
Des colorations roses ou blanches ont également été rapportées.
Effets endocriniens, métaboliques, sanguins et sur la reproduction
Pas d'inhibition de la fonction corticosurrénalienne.
Ne modifie pas les fonctions hématologiques ou de la coagulation malgré son solvant lipidique.
Peut être utilisé chez tout patient porteur d'une porphyrie asymptomatique. Il est cependant recommandé de doser les porphyrines et leurs précurseurs avant et après l'intervention.
Pas d’effet tératogène chez l'animal.
Risques infectieux
Plusieurs cas d'infections secondaires à l'administration de propofol contaminé ont été rapportés.
Les cas rapportés sont très rares et parfois difficilement imputables au propofol seul. Néanmoins, il est indispensable d'appliquer des consignes d'asepsie draconiennes lors de la manipulation du Diprivan® : désinfection du col de l'ampoule avec de l'alcool à 70°, préparation extemporanée et utilisation dans les 6 heures. L'utilisation de seringues préremplies diminue le risque lié aux manipulations de propofol.
Douleur à l'injection
Incidence de la douleur entre 28 et 90 %. Cette douleur est due à la molécule de propofol et non au solvant et semble d'origine veineuse.
La vitesse d'injection ne modifie ni sa fréquence, ni son intensité mais la durée pendant laquelle elle est ressentie.
L'injection dans une veine de petit calibre et l'état du capital veineux du patient (antécédent de chimiothérapie) sont des facteurs de risque. Cette irritation veineuse ne s'accompagne pas d'un risque particulier de thrombose.
L'administration de lidocaïne diminue l'incidence à 13 % .
Plusieurs techniques d'administration sont proposées. L'administration IV de lidocaïne peut précéder celle de propofol.
La posologie est de 0,5 mg·kg-1 et cette modalité doit s'accompagner d'une occlusion d'aval de la veine pendant une vingtaine de secondes. Une solution plus simple et plus efficace est de mélanger la lidocaïne au propofol dans le rapport de 20 à 40 mg de lidocaïne pour 200 mg de propofol. Cette préparation doit être extemporanée et utilisée dans les 30 minutes suivantes.
Enfin, une dernière solution est d'administrer un morphinique avant le propofol.
Utilisation pratique
Modes d'administration du Propofol
Si le bolus et la perfusion continue sont les techniques d'administration les plus employées à l'heure actuelle, le propofol est le premier agent anesthésique qui bénéficie d'une autorisation de mise sur le marché (AMM) pour AIVOC grâce à un appareil de perfusion spécifique (Diprifusor®). En effet, les techniques traditionnelles ont plusieurs désavantages.
L'injection par bolus répétés est responsable d'un profil de concentration très chaotique avec des conséquences hémodynamiques et respiratoires délétères.
La perfusion continue ne permet pas de modifier de façon rapide et fiable les concentrations sanguines.
Induction anesthésique et effet de la prémédication
Doses et concentrations requises
Induction sont chez le sujet de -60 ans de l'ordre de 2 à 2,5 mg·kg-1.
prendre en compte la masse maigre ou le body mass index (BMI ou IMC).
En pratique: posologie standard fondée sur un poids théorique de 70 kg est adaptée aux patients dont le poids est compris entre 60 et 90 kg .
La dose d'induction adéquate chez le sujet de +60 ans est 1,6 à 1,7 mg·kg-1. Cette dose doit être chez les grands vieillards (de l'ordre de 0,7 mg·kg-1).
La prémédication ou l'administration concomitante de morphiniques entraîne une baisse des posologies (potentialisation ou synergie) de propofol nécessaires à l'obtention de la perte de conscience.
Ex : dose nécessaire pour obtenir la perte de conscience chez 50 % des patients (DE 50 %) n'est que de 0,35 mg·kg-1 de propofol si 0,07 mg·kg-1 de midazolam ou 0,05 mg/kg d'alfentanil ont été préalablement administrés.
L'interaction est en revanche additive, donc moins intense, avec la kétamine et le fentanyl .
L'administration de clonidine en prémédication s'accompagne également d'un effet d'épargne .
Effets indésirables
Les effets indésirables lors de l'induction anesthésique sont rares chez l'adulte et diminuent avec l'âge.
Le principal effet indésirable est la baisse de la PA.
Pour limiter ce retentissement hémodynamique:
pratiquer une induction lente par perfusion continue de propofol à un débit de 50 mg·min-1 chez les patients de plus de 60 ans. Cette technique (permet de plus la diminution de l'incidence des bradycardies et des apnées.)
L'adjonction d'éphédrine au propofol permet de maintenir la pression artérielle chez des sujets ASA I sans qu'il soit noté de tachycardie réactionnelle.
La dose minimale doit être de 10 mg.
L'expansion volémique préalable à l'induction anesthésique est également efficace.
l'association propofol-kétamine apparaît très intéressante pour maintenir la stabilité hémodynamique.
Intubation sous propofol seul
Le propofol est adapté aux techniques d'intubation trachéale sans curare.
cette technique ne remplace pas l'induction rapide avec de la succinylcholine dans le cadre de l'anesthésie en urgence chez le patient suspect d'estomac plein. Elle est également contre-indiquée chez le patient hypovolémique.
Retentissement hémodynamique de l'intubation trachéale
Le propofol assure de meilleures conditions d'intubation que le thiopental. Cependant, seule l'administration d'un morphinique permet d'éviter une augmentation de la pression artérielle systolique après l'intubation et cet effet dépend de la dose administrée
Masque laryngé
Le propofol permet une mise en place aisée du masque laryngé du fait de ses effets favorable au niveau de la sphère oropharyngée. incidence moindre de mouvements de tête, de laryngospasme et d'efforts expulsifs par rapport au thiopental.
Entretien de l'anesthésie
De nombreux schémas posologiques ont été recommandés. Le plus utilisé est celui préconisé par Roberts et al :
Bolus de 1 mg·kg-1 suivi par des perfusions séquentielles de 10 mg·kg-1·h-1 pendant 10 mn, puis 8 mg·kg-1·h-1 pendant 10 autres mn et enfin 6 mg·kg-1·h-1 jusqu'à la fin de l'intervention.
Ce schéma permet de maintenir une concentration sanguine de propofol comprise entre 3 et 4 g·mL-1.
Les doses nécessaires doivent être diminuées chez le sujet âgé.
Chez le patient obèse, le schéma posologique d'entretien tiendra compte du poids réel et non du poids idéal.
L'adjonction d'un morphinique permet de diminuer de façon très importante les concentrations adéquates de propofol, ce qui traduit une potentialisation très marquée.
Anesthésie ambulatoire, réveil, nausées et vomissements
Réveil
Le réveil immédiat (ouverture des yeux) est obtenu généralement en moins de 10 mn. Le réveil intermédiaire (aptitude au retour au domicile accompagné) est également rapide. En revanche, la récupération complète des tests psychomoteurs explorant les fonctions supérieures (aptitude à la rue, conduite automobile) nécessite plusieurs heures et est corrélée aux taux résiduels de propofol
Effets sur les nausées et les vomissements
L'effet bénéfique du propofol vis-à-vis des nausées et des vomissements postopératoires est avéré. Cet effet est maximal lorsque le propofol est administré à la fois pour l'induction et l'entretien de l'anesthésie et en cas de chirurgie à risque (chirurgie ophtalmologique telle que le strabisme, chirurgie gynécologique).
Il est à noter que cet effet s'observe essentiellement durant les premières heures postopératoires et s'estompe progressivement. Le mécanisme d'action est encore mal connu.
Terrains particuliers
Femme enceinte et fécondation in vitro (FIV)
Anesthésie pour césarienne /thiopental,
Pas d’altération du score APGAR des nouveau-nés en cas d'injection unique de propofol lors de l'induction anesthésique .
Le propofol traverse la barrière placentaire mais les concentrations sans signification clinique .
Pas d'effet délétère sur la contractilité utérine et le volume des pertes sanguines.
L’effet hypertensif postintubation peut être bénéfique chez ces patientes.
Le propofol est retrouvé au niveau du lait maternel à des taux négligeables.
Pas d'AMM pour l'administration chez la femme enceinte. Il peut être utilisé pour l'anesthésie des ponctions d'ovocytes dans le cadre des FIV.
Chirurgie cardiaque
Le retentissement hémodynamique de l'induction anesthésique est l'un des facteurs limitant l'utilisation du propofol en chirurgie cardiaque.
La mise en route de la CEC cause d’importantes modifications pharmacocinétiques. L'hémodilution entraîne une chute des concentrations de propofol. Cette phase est transitoire et l'on assiste dans un second temps à une remontée des taux de propofol du fait de l'hypothermie. La concentration sanguine adéquate varie entre 1 à 3 g·mL-1.
Le propofol permet des réveils et des extubations plus précoces que les autres protocoles anesthésiques. Son apport semble intéressant dans le cadre de la sédation de courte durée après chirurgie cardiaque. Les doses nécessaires sont de l'ordre de 0,5 à 1 mg·kg-1·h-1.
Enfants
La pharmacocinétique du propofol chez l'enfant âgé de 3 à 11 ans est caractérisée par une augmentation du Vd et de la clairance rapportés au poids.
Ces modifications sont encore plus marquées chez l'enfant de -3 ans.
La T 1/2 d'élimination terminale est similaire à celle de l'adulte.
Ces particularités pharmacocinétiques nécessitent d'augmenter les posologies de 50 % pour l'induction (2,8 mg·kg-1) et de 50 à 100 % pour l'entretien (10,5 mg·kg-1·h-1).
Le retentissement hémodynamique est comparable à celui de l'adulte avec cependant une plus grande incidence d'épisodes de bradycardie, en particulier chez l'enfant de moins de 3 ans.
Peu adapté à l'intubation trachéale de l'enfant.
La mise en place d'un masque laryngé sous propofol seul est en revanche possible. La dose nécessaire (DE 90 %) est de 5,4 mg·kg-1 chez les enfants non prémédiqués et de 3,8 mg·kg-1 chez les enfants ayant reçu 0,5 mg·kg-1 de midazolam par voie orale.
Par rapport à l'halothane et dans le cadre d'une ventilation spontanée, le propofol diminue le risque d'obstruction des voies aériennes.
Les résultats concernant le réveil sont superposables à ceux de l'adulte.
Neurochirurgie
Du fait de ses effets favorables sur l'hémodynamique cérébrale, le propofol est particulièrement adapté à la neuroanesthésie..
Ainsi, l'intérêt principal du propofol est le réveil rapide permettant un examen neurologique précoce, " sur table ", pouvant conduire à des indications de réintervention précoce. Cet avantage nécessite que les effets délétères hémodynamiques du propofol soient strictement contrôlés en peropératoire afin de maintenir une pression de perfusion cérébrale adéquate
Anesthésie en dehors du bloc opératoire et sédation
Imagerie par résonance magnétique (IRM). Scanner. Radiothérapie
Dans l’IRM, il permet un réveil et un retour au domicile plus rapide que les techniques fondées sur l'administration de barbituriques.
Peut être utilisé pour la sédation de l'enfant lors de séances de radiothérapie ou de la réalisation de biopsies médullaires.
Cardioversion et cardiologie interventionnelle
Le retentissement hémodynamique = thiopental mais à l'étomidate. minimiser par une induction par perfusion lente .
Peut être utilisé pour une exploration électrophysiologique
Endoscopies digestives
Estomac plein. Utilisation préhospitalière
le laboratoire Zeneca Pharma* ne cautionne pas l’indication pour l'induction du patient à l'estomac plein à l'heure actuelle.
L'utilisation du propofol dans le cadre de la pratique préhospitalière est également l'objet de débats. L'administration chez des patients hypovolémiques ou en état de choc peut être responsable d'accidents allant jusqu'à l'arrêt cardiaque. De plus, la mention légale d'utilisation indique que cet agent ne peut être administré que par un anesthésiste, ce qui n'est pas la règle en pratique quotidienne dans ces situations.
Utilisation en réanimation
Estomac plein. Utilisation préhospitalière
La pharmacocinétique du propofol est très altérée chez les patients de réanimation. Elle est caractérisée par une augmentation majeure de la demi-vie d'élimination terminale (qui est de l'ordre de 30 heures) et du VdSS.
La tolérance hémodynamique est satisfaisante mais éviter toute administration en bolus et corriger préalablement une hypovolémie.
Le propofol est un des adjuvants du traitement des poussées d'hypertension intracrânienne chez le neurotraumatisé. Ses effets cérébraux ne sont favorable qu'à la condition d'un maintien strict de la pression artérielle systémique moyenne.
Le volume d'Intralipide® perfusé et le coût sont les principales limites à son emploi comme agent de sédation.
INDICATION (Vidal 2020)
Anesthésie :
Propofol à 1% est un agent anesthésique intraveineux, d'action rapide, utilisable pour :
- l'induction et l'entretien de l'anesthésie générale chez l'adulte et l'enfant de plus de 1 mois,
- la sédation des patients ventilés âgés de plus de 16 ans en unité de soins intensifs,
- la sédation au cours de procédures diagnostiques ou chirurgicales, seul ou en association à une anesthésie locale ou régionale chez l'adulte et l'enfant de plus de 1 mois.
NB. LES PRESENTATIONS DE PROPOFOL A 2% SONT RESERVEES A L'ENFANT DE PLUS DE 3 ANS
POSOLOGIE (Vidal 2020)
Instructions générales
PROPOFOL 1 % (10 mg/ml) doit être uniquement administré au sein d'un établissement hospitalier ou dans des centres de jour équipés de façon adéquate et par des médecins anesthésistes réanimateurs. Les fonctions circulatoire et respiratoire doivent être surveillées de façon constante (par ex. ECG, oxymètre de pouls) et tout le matériel nécessaire pour le maintien de la perméabilité des voies respiratoires, pour la ventilation artificielle et les autres équipements de réanimation doivent être aisément accessibles à tout moment. Lors de la sédation au cours des interventions chirurgicales ou de procédures diagnostiques, PROPOFOL 1 % (10 mg/ml) ne doit pas être administré par la personne qui effectue l'acte chirurgical ou diagnostique.
D'autres agents analgésiques sont généralement nécessaires en association au PROPOFOL 1 % (10 mg/ml).
Posologie
PROPOFOL 1 % (10 mg/ml) est administré par voie intraveineuse. La posologie administrée est ajustée individuellement selon la réponse clinique.
Anesthésie générale chez l'adulte
Induction de l'anesthésie :
Pour l'induction de l'anesthésie, la dose de PROPOFOL 1 % (10 mg/ml) doit être titrée (20-40 mg de propofol toutes les 10 secondes) en fonction de la réponse du patient jusqu'à l'obtention des signes cliniques de narcose.
La plupart des patients adultes âgés de moins de 55 ans nécessiteront de 1,5 à 2,5 mg de propofol par kg de poids corporel. Des injections répétées de bolus peuvent être administrées selon les besoins cliniques.
Chez les patients de plus de 55 ans, et chez les patients ASA grade III et IV et en particulier ceux atteints d'insuffisance cardiaque, les doses nécessaires seront moindres et la dose totale pourra être réduite à 1 mg de propofol par kg de poids corporel. Chez ces patients, des vitesses d'administration plus lentes devront être utilisées (environ 2 ml de PROPOFOL 10 mg/ml, c'est-à-dire 20 mg de propofol toutes les 10 secondes).
Entretien
L'entretien de l'anesthésie peut être fait par l'administration de PROPOFOL 1 % (10 mg/ml), soit par perfusion continue, soit par bolus répétés.
Lors de l'administration répétée en bolus, des doses croissantes de 25 mg (2,5 ml de PROPOFOL 1 % (10 mg/ml)) à 50 mg (5,0 ml de PROPOFOL 1 % (10 mg/ml)) peuvent être administrées en fonction des besoins cliniques.
Pour l'entretien de l'anesthésie par perfusion continue, les doses sont généralement comprises entre 4 et 12 mg/kg/h.
Chez les patients âgés, les patients en mauvais état général, les patients ASA grade III et IV, les patients hypovolémiques, les doses peuvent être réduites en fonction de l'état clinique du patient et de la technique d'anesthésie employée.
Anesthésie générale chez l'enfant de plus de 1 mois
Induction de l'anesthésie
Pour l'induction de l'anesthésie, la dose de PROPOFOL 1 % (10 mg/ml) doit être titrée lentement, en fonction de la réponse du patient jusqu'à l'obtention des signes cliniques de narcose. La posologie doit être ajustée en fonction de l'âge et du poids de l'enfant.
La plupart des patients âgés de plus de 8 ans nécessiteront environ 2,5 mg par kg de poids corporel pour l'induction de l'anesthésie. Chez les enfants plus jeunes, notamment entre l'âge de 1 mois et 3 ans, la dose nécessaire pourra être plus élevée (2,5 - 4 mg de propofol par kg de poids corporel).
Entretien
L'anesthésie peut être entretenue en administrant PROPOFOL 1% (10 mg/ml) en perfusion ou en injections répétées de bolus pour maintenir la profondeur d'anesthésie requise. La vitesse d'administration requise varie considérablement entre les patients mais des débits de l'ordre de 9 à 15 mg/kg/h donnent habituellement une anesthésie suffisante. Chez les enfants plus jeunes, notamment entre l'âge de 1 mois et 3 ans, les recommandations posologiques peuvent être plus élevées.
Pour les patients ASA grade III ou IV, des doses inférieures sont recommandées.
Sédation chez les adultes sous assistance respiratoire en unité de soins intensifs
Lors de l'utilisation en sédation chez les patients nécessitant des soins intensifs, il est recommandé d'administrer le propofol en perfusion continue. La vitesse de perfusion doit être adaptée en fonction de la profondeur requise pour la sédation.
Pour la plupart des patients une sédation suffisante est obtenue avec des doses allant de 0,3 mg/kg/h à 4 mg/kg/h de propofol (voir rubrique Mises en garde et précautions d'emploi).
Le propofol est contre-indiqué pour la sédation des patients de 16 ans et moins en soins intensifs (voir rubrique Contre-indications).
L'administration de propofol par un système Anesthésie Intraveineuse à Objectif de Concentration (AIVOC) n'est pas recommandée pour la sédation en unité de soins intensifs.
Sédation chez l'adulte au cours de procédures diagnostiques ou chirurgicales
Pour obtenir la sédation au cours d'interventions chirurgicales ou de procédures diagnostiques, les doses et la vitesse d'administration doivent être adaptées en fonction de la réponse clinique. Chez la plupart des patients la dose nécessaire pour le début de la sédation est de 0,5 à 1 mg/kg pendant 1 à 5 minutes. L'entretien de la sédation peut être obtenu en ajustant la dose de PROPOFOL 1 % (10 mg/ml) perfusé en fonction de la profondeur de sédation souhaitée. Chez la plupart des patients la dose se situe entre 1,5 à 4,5 mg/kg/h. Un bolus supplémentaire de 10 à 20 mg (1 à 2 ml de PROPOFOL 1 % (10 mg/ml)) pourra être administré s'il est nécessaire d'augmenter rapidement la profondeur de la sédation.
Chez les patients de plus de 55 ans et chez les patients ASA grade III et IV la dose de PROPOFOL 1 % (10 mg/ml) peut être réduite et la vitesse de perfusion diminuée.
Sédation chez l'enfant de plus de 1 mois au cours de procédures diagnostiques ou chirurgicales
Les doses et vitesses d'administration devront être ajustées selon la profondeur de sédation requise et de la réponse clinique. La plupart des patients pédiatriques nécessite 1 à 2 mg/kg de poids corporel de propofol pour la mise en place de la sédation. L'entretien de la sédation peut être accompli en titrant le PROPOFOL 1% (10 mg/ml) en perfusion jusqu'au niveau désiré de sédation. La plupart des patients nécessite 1,5 à 9 mg/kg/h de propofol. Un bolus supplémentaire d'un maximum de 1 mg/kg de poids corporel pourra être administré s'il est nécessaire d'augmenter rapidement la profondeur de la sédation.
Pour les patients ASA grade III ou IV, des doses inférieures sont recommandées.
CONTRE-INDICATIONS ABSOLUES (VIDAL 2020)
- Hypersensibilité à la substance active ou à l'un des excipients
- PROPOFOL contient de l'huile de soja et ne doit pas être utilisé chez les patients allergiques au soja ou aux arachides.
- PROPOFOL ne doit pas être utilisé chez les patients de 16 ans et moins pour la sédation en soins intensifs. L'innocuité et l'efficacité chez les patients de 16 ans et moins n'ont pas été démontrées (voir rubrique Mises en garde et précautions d'emploi).
INTERFÉRENCE MÉDICAMENTEUSE (VIDAL 2020)
- Le propofol a été utilisé en association avec des anesthésies rachidiennes épidurales et avec les prémédications communément utilisées, les agents bloquants neuromusculaires, les anesthésiques par inhalation et les analgésiques ; aucune incompatibilité pharmacologique n'a été rencontrée. Des doses plus faibles de propofol peuvent être nécessaires lorsqu'une anesthésie générale ou une sédation est utilisée en tant qu'adjuvant à des techniques anesthésiques régionales.
- Une hypotension sévère a été rapportée suite à l'induction d'une anesthésie profonde avec le propofol chez les patients prenant de la rifampicine.
- L'administration concomitante de benzodiazépines, de parasympatholytiques ou d'anesthésiques volatils allonge la durée de l'anesthésie et diminue la fréquence respiratoire.
- Après une prémédication supplémentaire par des opiacés, les effets sédatifs du propofol peuvent être majorés et prolongés, l'incidence et la durée des apnées peuvent également être augmentées.
- Il faut prendre en considération le fait que l'utilisation concomitante de propofol et de médicaments de prémédication, d'anesthésiques volatils ou d'analgésiques peut potentialiser l'anesthésie et les effets indésirables cardiovasculaires. L'utilisation concomitante de médicaments dépresseurs du système nerveux central (par exemple alcool, anesthésiques généraux, analgésiques narcotiques) peut provoquer une majoration de leurs effets sédatifs. L'administration concomitante de propofol et de médicaments dépresseurs du système nerveux central utilisés par voie parentérale peut provoquer une dépression respiratoire ou cardiovasculaire grave.
- Après administration de fentanyl, les taux plasmatiques de propofol peuvent augmenter de façon temporaire avec une augmentation de la fréquence des apnées.
- La survenue d'une bradycardie et d'un arrêt cardiaque est possible après traitement par le suxaméthonium ou la néostigmine.
- Chez des patients traités par de la ciclosporine, une leuco-encéphalopathie a été rapportée après administration d'émulsions lipidiques telles que celles utilisées dans propofol .
- La nécessité d'administrer des doses de propofol plus faibles a été constatée chez des patients prenant du valproate. En cas d'administration concomitante, une réduction des doses de propofol peut être envisagée.
e) Chlorhydrate de Kétamine (Ketalar®).
G. Mion in EMC - Anesthésie-Réanimation 1 Volume 9 > n◦3 > juillet 2012/Bernard DALENS
La kétamine a des propriétés analgésiques centrales (récepteurs morphiniques et récepteurs NMDA).
l’agent anesthésique de référence dans certaines circonstances cliniques, notamment les états de choc, la tamponnade, ou l’asthme aigu grave
il faut considérer, comme le soulignent des revues, qu’il existe deux indications de la kétamine : à forte dose comme anesthésique général, et à faible dose comme antalgique
HISTORIQUE
Dans les années 1950, les laboratoires Parke-Davis isolent la phencyclidine (PCP, Sernyl®, angel-dust), dotée de propriétés analgésiques et dépourvue d’effets dépresseurs cardiorespiratoires, mais inductrice de troubles psychiques prohibitifs.
Après l’essai de la cyclohexamine, la kétamine (CI-581) est synthétisée en 1962 par Calvin Stevens. Moins puissante que la PCP, elle provoque moins de problèmes psychiques au réveil. Commercialisée en 1969 aux États-Unis, elle est utilisée pendant la guerre du Vietnam. Malgré une mise à l’écart en anesthésie, la revue de White fait le point en 1982 d’une décennie de recherche.
Les années 1990, consacrées à la pharmacologie du récepteur N-méthyl-D-aspartate (NMDA), revisitent les effets analgésiques, tant somatiques que viscéraux, de doses faibles qui limitent les effets secondaires.
Le terme, inexact, d’« analgésique de surface » tombe en désuétude. Le renouveau de la kétamine, médicament « antihyperalgésique » synergique des morphinomimétiques, s’intègre dans les stratégies modernes d’analgésie multimodale, préventive des douleurs postopératoires.
PRÉSENTATION
Elle est présentée en ampoules de 5 mL dosées à 50 mg (solution à 1 %, soit 10 mg/mL) et en ampoules de 5 mL dosées à 250 mg (solution à 5 %, soit 50 mg/mL).
PROPRIÉTÉS PHYSICOCHIMIQUES
Le pKa de la kétamine est de 7,5.
Sa liaison protéique est faible (10 %) et elle est très liposoluble (début d’action rapide).
PHARMACOCINÉTIQUE
Pharmacocinétique ≈ du thiopental mais molécule est 5 fois plus liposoluble que le thiopental.
Liaison aux protéines plasmatiques ≈ 50%.
Débit sanguin cérébral élevée + liposolubilité = concentrations cérébrales élevées puis redistribution dans les tissus adipeux
La t1/2 de distribution régit l’effet anesthésique, et la t1/2d’élimination les phénomènes tardifs comme les hallucinations au réveil.
La kétamine s’accumule en cas d’injections répétées ou d’administration continue.
Sa demi-vie d’élimination est prolongée par l’halothane et le diazépam, ainsi que chez l’enfant de moins de 3 mois (métabolisme Hépatique diminué).
Elle traverse rapidement le placenta : les concentrations fœtales sont maximales en 1,5 à 2 minutes et peuvent dépasser les concentrations maternelles.
| Terrain |
Vdss (L/kg) |
Clairance (mL/min/kg) |
Demi-vie (h) |
Élimination Sous forme inchangée (%) |
Concentration plasmatique effective (μM/L) |
| Adulte | 3.5 | 10 | 2-3 | 5 (urines) | 10 |
| Enfant | 2.5 | 13 | 1-2 | 5 (urines) | identique |
BIOTRANSFORMATION
Siège du métabolisme : fraction enzymatique microsomiale du foie (cytochrome P450).
Étapes : déméthylation en norkétamine (action 5 fois plus faible) par les monoxygénases dépendant du cytochrome P450, hydroxylation puis glucuroconjugaison.
Élimination : urinaire (90 % sous forme métabolisée, 5 % sous forme inchangée), fécale (6 %).
PHARMACODYNAMIQUE
Mode d’action
La kétamine induit une anesthésie dissociative dose-dépendante due à une dissociation fonctionnelle et électrophysiologique entre le thalamus et le système limbique ; elle déprime la conduction axonale et l’excitabilité cellulaire, et réduit l’activité excitatrice des récepteurs (site de reconnaissance de la phencyclidine) du N-méthyl-D-aspartate (effet hypnotique) ; l’inhibition de l’action du glutamate (acide aminé neuro-excitateur le plus répandu dans le cerveau) expliquerait ses effets protecteurs sur l’ischémie cérébrale.
Elle stimule certains récepteurs morphiniques (μ et σ) (effet analgésique),
Interagit avec les récepteurs sérotoninergiques et cholinergiques du système nerveux central et inhibe le recaptage de la noradrénaline au niveau synaptique (effet inotrope positif).
Système nerveux central
La kétamine induit une anesthésie dissociative qui se traduit par un état cataleptique associant une analgésie de surface et un sommeil superficiel ; les yeux restent ouverts, les pupilles dilatées, avec parfois un nystagmus horizontal et vertical (induction et réveil).
Elle induit une amnésie postopératoire.
Le tonus musculaire est conservé et les mouvements restent possibles.
Les réflexes laryngés, pharyngés et de déglutition sont conservés mais ne mettent pas complètement à l’abri d’une inhalation (intubation trachéale et manœuvre de Sellick restent nécessaires).
Elle augmente la pression intracrânienne, le débit sanguin cérébral et la consommation cérébrale d’oxygène.
Au réveil, l’apparition de rêves, d’hallucinations voire d’expériences extracorporelles est dose-dépendante.
Système cardiovasculaire
La kétamine augmente la pression artérielle systolodiastolique, le débit cardiaque, la fréquence cardiaque, le débit sanguin coronaire et la consommation myocardique d’oxygène, indirectement par le biais d’une stimulation sympathique.
À forte concentration cependant, elle exerce un effet dépresseur myocardique direct .
Enfin, elle augmente les pressions artérielles pulmonaires et possède une action antiarythmique quinidine-like.
Système respiratoire
La kétamine est un faible dépresseur respiratoire.
Elle induit une bradypnée avec augmentation de l’amplitude respiratoire et diminue la réponse ventilatoire à l’hypercapnie chez l’enfant.
Elle diminue la compliance thoraco-pulmonaire (hypertonie musculaire) et entraîne une broncho-dilatation par diminution de la concentration de calcium intracellulaire.
Autres systèmes
En obstétrique, la kétamine ne provoque pas d’atonie utérine, et pas de dépression respiratoire ou cardio-circulatoire chez le fœtus.
Elle augmente la pression intraoculaire, provoque une hypertonie musculaire diffuse, sans chute de la langue, et une hyperglycémie.
UTILISATION CLINIQUE
| Voie |
Délai d’action |
Effet maximal |
Durée d’action |
Durée du réveil |
| IV |
< 1 min |
2 min |
5-12 min |
60 min |
| IM-Rectale | 3-5 min |
12-15 min |
15-30 min | 3-4 h |
| Orale | 20 min |
30 min |
45 min | 120 min |
Par voie épidurale, la durée d’action de la kétamine est de l’ordre de 4 heures.
La kétamine a été utilisée pour réaliser une anesthésie locorégionale intraveineuse (suivie d’une anesthésie générale à la levée du garrot).
| Voie | Adulte | Enfant |
|
Induction (IVD) |
1-2 mg/kg |
2-3 mg/kg |
|
Entretien (Perfusion) |
15-45 μg/kg/min |
15-45 μg/kg/min |
| IVD |
dose après 15-20 min |
dose après 15-20 min |
| IM | 5-10 mg/kg |
5-15 mg/kg |
|
Rectale |
- |
8-10 mg/kg (résorption peu prévisible) |
|
Épidurale |
0,2-0,4 mg/kg |
0,2-0,5 mg/kg |
|
Analgésie intraveineuse chez l’adulte |
Bolus peropératoire 0,1-0,3 mg·kg-1 Perfusion postopératoire 0,1-0,2 μg·kg-1·min-1 Analgésie autocontrôlée bolus de 1 mg |
|
Indications
La kétamine est utilisée pour l’induction et l’entretien de l’anesthésie dans certaines circonstances :
- pansements de brûlés,
- enfant,
- sujet âgé,
- asthmatique,
- exploration douloureuse,
- obstétrique,
- sédation de complément,
- transport,
- choc,
- médecine de catastrophe
- anesthésie en situation de pénurie
- analgésie postopératoire
- déshydratation ou hémodynamique précaire (tamponnade, cardiopathie cyanogène),
- anémies,
- hypovolémies.
Elle a également été proposée pour l’analgésie intraveineuse, à doses subanesthésiques, dans les syndromes douloureux chroniques.
Enfin, elle a été utilisée en analgésie épidurale et intrathécale lors de syndromes douloureux chroniques, d’algodystrophies ou en analgésie postopératoire.
Contre-indications
Absolues : elles sont nombreuses et comportent
- l’hypersensibilité à la kétamine,
- la porphyrie,
- l’hypertension artérielle sévère,
- l’hypertension intracrânienne,
- le coronarien sévère non équilibré,
- l’infarctus de moins de 6 mois,
- l’éclampsie et les états pré-éclamptiques,
- la thyréotoxicose,
- les maladies psychiatriques.
Relatives :
- chirurgie ophtalmologique,
- chirurgie du carrefour pharyngolaryngé,
- toxicomanies,
- éthylisme sévère (état de prédélirium),
- épilepsie,
- risque d’hyperthermie maligne
Restriction de prescription (AMM française)
Les indications analgésiques pures et l’administration épidurale ou intrathécale de kétamine n’ont pas d’AMM.
Limites et précautions d’utilisation
Une prémédication par un vagolytique est recommandée avant l’utilisation de kétamine.
On peut atténuer les effets psychodysleptiques en administrant simultanément des benzodiazépines (midazolam plus efficace que diazépam) ; le réveil dans une ambiance calme ne modifie en rien l’incidence des hallucinations mais un entretien préanesthésique expliquant ces phénomènes semble aussi efficace qu’une prévention pharmacologique.
INTERACTIONS MÉDICAMENTEUSES
| Médicaments |
Médicaments Effets pharmacologiques |
Mécanismes |
| Dropéridol |
Majoration des effets psychodysleptiques |
Interaction pharmacodynamique (effet additif) |
|
Benzodiazépines |
Diminution des effets psychodysleptiques |
Interaction pharmacodynamique (action antagoniste centrale) |
| Sympathomimétiques |
Augmentation des effets sympathomimétiques |
Interaction pharmacodynamique |
| Curares |
Potentialisation de la curarisation |
Interaction pharmacodynamique |
|
N2O, morphiniques, anesthésiques volatils |
Majoration deseffets ; potentialisation de la dépression respiratoire ; retard de réveil |
Interaction pharmacodynamique |
|
Alpha et bêtabloquants, ganglioplégiques, inhibiteurs calciques |
Dépression respiratoire |
Interaction pharmacodynamique |
| Aminophylline |
Abaissement du seuil convulsivant |
Interaction pharmacodynamique |
|
Barbituriques, diazépam, prométhazine |
Précipitation |
Incompatibilité physicochimique |
EFFETS SECONDAIRES ET SURDOSAGE
La kétamine augmente la sécrétion salivaire (surtout chez l’enfant).
On recommande une prémédication par un parasympatholytique,car un laryngospasme est possible.
Les nausées et vomissements sont rares.
Hallucinations, rêves, agitation, troubles psychiques au réveil sont atténués par les benzodiazépines.
Des accès de toux et un hoquet, ainsi que des mouvements tonicocloniques sont possibles chez l’enfant.
La kétamine n’est pas histaminolibératrice et les réactions allergiques sont exceptionnelles.
La marge de sécurité de la kétamine est importante ; un surdosage peut retarder le réveil ou provoquer une dépression respiratoire nécessitant parfois une ventilation assistée.
Date de dernière mise à jour : 21/05/2023
Ajouter un commentaire