i) Paracétamol (PERFALGAN®)
Introduction
Le para -acétyl-amino-phénol ou PARACÉTAMOL
En 1888, (Bayer): le paranitrophénol, un déchet de l’industrie des colorants est similaire à l’acétanilide. Oscar Hinsberg le transforme en acétophénitidine et montre ses effets antipyrétiques. C’était la phénacétine …
En 1889 On trouve de l’acétaminophène dans les urines de patients traités par phénacétine; Karl Morner montre que l’acétaminophène, est efficace contre la douleur et la fièvre.
En 1893, Joseph von Mering, compare le paracétamol et la phénacétine et affirme que le paracétamol est plus néphrotoxique que la phénacétine
Présentation
Un flacon de 100 ml contient 1000 mg de paracétamol.
Propirétés pharmacodynamiques
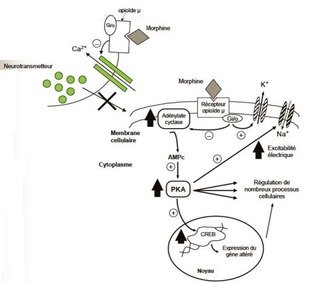
Le mécanisme précis des propriétés antalgiques et antipyrétiques du paracétamol reste à établir pouvant impliquer des actions centrales et périphériques.
 Effet antalgique
Effet antalgique
- Début de soulagement de la douleur dans les 5 à 10 minutes suivant le début de l'administration.
- Le pic de l'effet antalgique est obtenu en 1 heure et la durée de cet effet est habituellement de 4 à 6 heures.
Effet antipyrétique
- Réduit la fièvre dans les 30 minutes suivant le début de l'administration et la durée d'effet antipyrétique est d'au moins 6 heures.
Propirétés pharmacocinétiques
Absorption :
Pharmacocinétique linéaire jusqu'à 2 g en dose unique et après administration répétée sur 24 h.
Biodisponibilité après perfusion de 500 mg et 1 g est similaire à celle observée après perfusion de 1 g et 2 g de propacétamol (contenant 500 mg et 1 g de paracétamol respectivement).
La concentration plasmatique maximale (Cmax) observée à la fin des 15 minutes de perfusion intraveineuse de 500 mg et 1 g est de l'ordre de 15 µg/ml et 30 µg/ml respectivement.
Distribution :
- Le volume de distribution (Vd) est approximativement de 1 L/kg.
- La liaison aux protéines plasmatiques est faible.
- Après perfusion de 1 g , des concentrations significatives (de l'ordre de 1,5 µg/ml) ont été retrouvées dans le liquide céphalorachidien dès la 20ème minute après la perfusion.
Métabolisme
- Essentiellement au niveau du foie selon 2 voies hépatiques majeures : la glycuroconjugaison et la sulfoconjugaison.
- Cette dernière voie est rapidement saturable aux posologies supérieures aux doses thérapeutiques.
- Une faible proportion (moins de 4%) est transformée par le cytochrome P450 en un intermédiaire réactif (le N-acétyl benzoquinone imine) qui, dans les conditions normales d'utilisation, est rapidement détoxifié par le glutathion réduit et éliminé dans les urines après conjugaison à la cystéine et à l'acide mercaptopurique.
- En revanche, lors d'intoxications massives, la quantité de ce métabolite toxique est augmentée.
Elimination
- L'élimination des métabolites est essentiellement urinaire.
- 90% de la dose administrée est excrétée dans les urines en 24 heures, principalement sous forme glycuroconjuguée (60 à 80%) et sulfoconjuguée (20 à 30%).
- Moins de 5% est éliminé sous forme inchangée.
- La demi-vie plasmatique(t1/2) est de 2,7 heures et la clairance corporelle totale est d'environ 18 L/h.
Indications
- Taitement de courte durée des douleurs d'intensité modérée, (postopératoire+++)
- Traitement de courte durée de la fièvre
Contre-indications
- Hypersensibilité au parcétamol
- Insuffisance hépatocellulaire sévère.
Précautions d'emploi
- Réservé à l'adulte et à l'enfant de plus de 33 kg
- Insuffisance hépatocellulaire
- Insuffisance rénale sévère (Clcr < = 30 ml/mn)
- Alcoolisme chronique
- Malnutrition chronique
- Déshydratation
- Grossesse
- Déficit en G6PD
Posologie
Adultes et adolescents pesant plus de 50 kg : . 1 g de paracétamol (100 ml) en 15 mn, jusqu'à 4 fois par jour. avec un intervalle d'au moins 4 h entre deux administrations. . La dose maximale journalière ne doit pas excéder 4 g.
Enfants de plus de 33 kg (environ 11 ans), adolescents et adultes de moins de 50 kg : . 15 mg/kg de paracétamol par administration, soit 1,5 ml de solution par kg en 15 mn, jusqu'à 4 fois par jour. avec un intervalle d'au moins 4 h entre deux administrations. . La dose maximale journalière ne doit pas excéder 60 mg/kg (sans dépasser 3 g).
Insuffisance rénale sévère : Il est recommandé d'augmenter l'intervalle entre 2 administrations à 6 heures au moins lors de l'administration du paracétamol chez l'insuffisant rénal sévère (clairance de la créatinine < = 30 ml/min)
Surdosage
- Avant de commencer le traitement, faire le dosage plasmatique du paracétamol.
- L'administration de l'antidote N-acétylcystéine (NAC) par voie intraveineuse ou voie orale, si possible avant la dixième heure. La NAC peut cependant apporter une certaine protection même après 10 heures, mais dans ce cas un traitement prolongé est donné.
- Traitement symptomatique.
----------------------------------------------------------------------------------------------------------------------------------------------
ii)Néfopam (Acupan®)
FORMES et PRÉSENTATIONS
Solution injectable : Ampoules de 2 ml, boîte de 5
2 ml = 20 mg de néfopam
INDICATIONS
Traitement symptomatique des affections douloureuses aiguës, notamment des douleurs postopératoires.
POSOLOGIE ET MODE D'ADMINISTRATION
Voie IM : 20 mg par injection. Si nécessaire, peut être répétée toutes les 6 heures sans dépasser une dose totale de 120 mg/24 heures.
Voie IV :
- en IV lente sur plus de 15 minutes, le patient étant en décubitus, afin d'éviter la survenue d'effets indésirables (nausées, vertiges, sueurs).
- La dose unique : 20 mg par injection, répétée toutes les 4 heures, si nécessaire, sans dépasser une dose totale de 120 mg/24 heures.
CONTRE-INDICATIONS
- Hypersensibilité au néfopam ou à l'un des constituants d'Acupan.
- Enfant de moins de 15 ans, en l'absence d'étude clinique.
- Convulsions ou antécédents de troubles convulsifs.
- Risques de rétention urinaire liés à des troubles urétroprostatiques.
- Risque de glaucome par fermeture de l'angle.
PHARMACODYNAMIE
Acupan a montré un effet sur le frisson postopératoire au cours d'études cliniques.
Acupan n'a aucune action anti-inflammatoire ou antipyrétique. Il n'entraîne pas de dépression respiratoire et ne ralentit pas le transit intestinal.
Acupan possède une activité anticholinergique.
Sur le plan hémodynamique, il a été observé une augmentation modérée et transitoire de la fréquence cardiaque et de la pression artérielle.
Activité antihyperalgésique par un mécanisme qui n'est pas complètement élucidé.
PHARMACOCINÉTIQUE
Après 20 mg par voie IM, le pic plasmatique (Tmax) est situé entre 0,5 et 1 heure et les concentrations maximales (Cmax) sont en moyenne de 25 ng/ml.
La demi-vie plasmatique moyenne est de 5 heures.
Lors d'une administration par voie IV d'une même dose, la demi-vie plasmatique moyenne est de 4 heures.
La liaison aux protéines plasmatiques est de 71-76 %.
La biotransformation est importante et 3 métabolites majeurs ont été identifiés : le déméthyl-néfopam, le N-oxyde-néfopam et le N-glucuronide-néfopam. Les deux premiers métabolites, non conjugués, n'ont pas montré d'activité analgésique chez l'animal.
L'élimination est essentiellement urinaire : 87 % de la dose administrée sont retrouvés dans les urines. Moins de 5 % de la dose sont excrétés sous forme inchangée ; les métabolites identifiés dans les urines représentent respectivement 6 %, 3 % et 36 % de la dose administrée par voie IV.
----------------------------------------------------------------------------------------------------------------------------------------------
iii)Anti-inflammatoires non stéroïdiens (AINS).
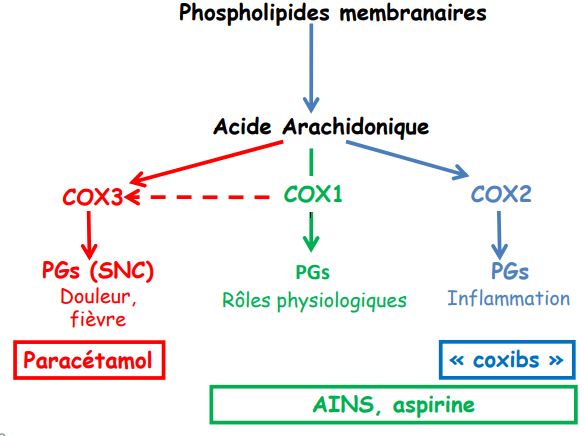
Les AINS sont tous des inibiteurs de la cyclo-oxygénase (COX).
Il existe plusieurs isoformes de la COX :
- La COX1 constitutive (reins, estomac, vaisseaux, etc.) a un rôle physiologique. Elle permet la synthèse des prostaglandines (PG) intervenant dans l’estomac (cytoprotection), les reins (maintien du flux sanguin rénal) et la synthèse du thromboxane A2 plaquettaire (vasoconstriction et agrégation plaquettaire). Son inhibition est donc responsable des effets indésirables des AINS (toxicité gastrique, diminution du flux sanguin rénal et effet anti-agrégant plaquettaire).
- La COX2 inductible par des autacoïdes (IL1, TNFα) en cas d’inflammation permet la synthèse des PG intervenant dans ces réactions. Son inhibition est responsable des effets pharmacodynamiques des AINS (effet anti-inflammatoire ainsi que les effets analgésiques et antipyrétiques).
MÉDICAMENTS EXISTANTS
A.I.N.S. EXISTANTS
|
Dénomination Commune Internationale
|
Famille chimique |
|
Phénylbutazone
|
Pyrazolés |
|
Indométacine
Sulindac
|
Indoliques |
|
Acéclofénac
Acide tiaprofénique
Alminophène
Diclofénac
Etodolac
Fénoprofène
Flurbiprofène
Ibuprofène
Kétoprofène
Kétorolac
Nabumétone
Naproxène sodique
|
Arylcarboxyliques |
|
Acide niflumique
Acide méfénamique
|
Fénamates |
|
Piroxicam
Meloxicam
Ténoxicam
|
Oxicams |
| Nimésulide |
Sulfonalidine |
|
Célécoxib
Parécoxib
|
Inhibiteurs sélectifs de la Cox-2 ou Coxibs |
MÉCANISMES D’ACTION DES DIFFÉRENTES MOLÉCULES
Par leur action inhibitrice de la COX, tous les AINS inhibent la transformation de l’acide arachidonique en prostaglandines ou thromboxanes.
Les Coxibs sont des inhibiteurs dits "sélectifs" de la COX2 aux doses usuelles. Ils ont été présentés comme une nouvelle classe d’AINS agissant préférentiellement sur la synthèse des prostaglandines lors des phénomènes inflammatoires, et donc sans effet indésirable gastrique. Or, ils n’ont pas montré d'avantages sur ce plan par rapport aux autres AINS et leur efficacité n’est pas supérieure à celle des AINS classiques. En revanche, ils exposent à des effets indésirables cardiovasculaires pouvant être graves (risque d’infarctus du myocarde). L’augmentation de la fréquence d’infarctus du myocarde et d’AVC a d’ailleurs conduit au retrait mondial en 2004 du rofécoxib.
Enfin, en inhibant préférentiellement la COX2, les Coxibs ne diminuent pas la production de thromboxane. Ils n’ont donc pas d’effet anti-agrégant plaquettaire.
EFFETS UTILES EN CLINIQUE
Certains AINS sont commercialisés à faibles doses pour leur effet antalgique et antipyrétique, leur effet anti-inflammatoire n’apparaissant qu’à des doses plus élevées.
| Molécules |
Indications |
| Ibuprofène, kétoprofène, diclofénac, naproxène, acide méfénamique |
Traitement symptomatique des affections douloureuses et/ou fébriles |
| Classe des oxicams (piroxicam, meloxicam, ténoxicam) |
Douleurs post-opératoires, crises de coliques néphrétiques, traumatologie, traitement adjuvant des manifestations inflammatoires en stomatologie ou chirurgie dentaire ou ORL. |
| Parécoxib |
Traitement à court terme des douleurs post-opératoires. |
PHARMACODYNAMIE DES EFFETS UTILES EN CLINIQUE
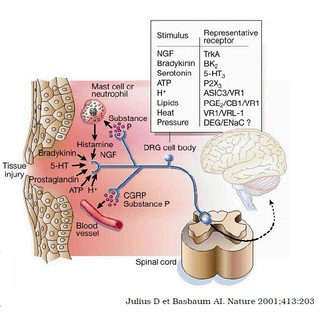
L’effet anti-inflammatoire, l’effet antalgique et l’effet antipyrétique résultent de l’inhibition de la formation des prostaglandines :
- Effet anti-inflammatoire : atténuation des phénomènes inflammatoires impliquant les prostaglandines (vasodilatation, œdème, douleur) sans effet sur les processus entraînant des lésions tissulaires chroniques.
- Effet antalgique : atténuation des douleurs d’origine périphérique.
- Effet antipyrétique : diminution de la fièvre et retour à la normale de la température corporelle par abaissement du seuil du thermostat hypothalamique.
L’importance respective de ces trois effets varie avec les produits.
L’effet anti-agrégant plaquettaire résulte de l’inhibition de la formation de thromboxane. Les Coxibs sont dénués d’effet antiplaquettaire à dose usuelle.