Jean Paul Viale ‐ Hôpital de la Croix Rousse ‐ Lyon
Née et développée dans les années d’après‐guerre, la ventilation peropératoire est une pratique actuellement routinière qui a permis des avancées considérables en anesthésiologie.
Prenant en charge la ventilation déprimée par les agents anesthésiants, elle a autorisé des actes chirurgicaux de plus en plus audacieux.
Cette pratique a récemment été remise en question à la suite du développement de connaissances sur les effets délétères de la ventilation mécanique.
Cette « revisitation » concerne le choix de la FIO2, le réglage peropératoire de la ventilation en particulier l’importance du volume courant, enfin l’identification et la prévention des complications atélectasiques peropératoires.
LE CHOIX DE LA FIO2
Ce choix se pose de façon différente pour les trois temps principaux de l’anesthésie : l’induction, l’entretien et le réveil.
1. la FIO2 à l’induction
Il est maintenant bien démontré grâce à l’imagerie pulmonaire que l’utilisation de d’oxygène pur durant l’induction provoque une augmentation du shunt intra pulmonaire, avec constitution de zones atélectasiques, alors que l’utilisation de FIO2 à 0,3 prévient ces évènements [1].
La contrepartie bien connue de l’utilisation de FIO2 basses à l’induction est la diminution de la réserve en oxygène disponible et donc du temps d’apnée possible avant la survenue d’une hypoxie.
Un travail étudiant spécifiquement le meilleur compromis possible entre importance des atélectasies induites et temps d’apnée autorisé, montre qu’une FIO2 de 0,8 évite la survenue d’atélectasie mais avec un temps d’apnée inférieur de 100 secondes en moyenne à celui qui aurait été obtenu avec une FIO2 de 1 [2].
Cette différence de tolérance de l’apnée paraît trop importante pour justifier la prise de risque au cours d’une intubation difficile non prévue.
La recommandation reste donc de réaliser une pré oxygénation avec une FIO2 de 1.
Pour des sujets dont le terrain particulier justifierait la prévention de la survenue d’atélectasie, l’alternative est d’utiliser une pression positive expiratoire pendant toute la durée de la préoxygénation, avec une FIO2 de 1.
Cette administration de pression expiratoire positive a par ailleurs l’avantage d’augmenter la capacité résiduelle fonctionnelle et donc la réserve d’oxygène disponible à l’induction [3].
2. la FIO2 à la période peropératoire
Pour cette période l’analyse du risque est toute différente puisque l’hypothèque de la tolérance à l’apnée est levée.
Le standard est d’utiliser une FIO2 de 0,3 à 0,4 chez des patients à fonction respiratoire normale.
Il est en effet bien documenté que la ventilation à la FIO2 1 en période peropératoire majore, comme à l’induction, les zones atélectasiques [4].
La traduction fonctionnelle en est une augmentation du shunt intra pulmonaire.
Ces manifestations atélectasiques sont cependant transitoires chez la plupart des patients, une étude d’imagerie pulmonaire pratiquée à 24h post opératoire montre en effet qu’il n’existe pas de différence de surface atélectasique de patient ventilé à FIO2 0,4 ou 0,8 en période peropératoire [5].
Si une FIO2 élevée doit être utilisée en période peropératoire pour assurer une saturation artérielle suffisante, des stratégies de prévention et de traitement de ces atélectasies peuvent être employées (cf. infra).
3. la FIO2 à l’extubation
Il est de pratique courante d’augmenter la FIO2 au moment de l’extubation.
L’imagerie pulmonaire a aussi montré que l’utilisation de FIO2 1 pendant les dix minutes précédant une extubation majore l’importance des zones atélectasiques [6].
Les conséquences cliniques de ces évènements ne sont pour l’instant pas démontrées.
De plus, la nécessité de la disponibilité d’une tolérance à l’apnée est moindre à l’extubation qu’à l’induction.
4. La FIO2 en période post opératoire immédiate
Les arguments issus de connaissances extérieures à la physiologie pathologie respiratoire avaient, dans les années 2000, incité à l’administration de la FIO2 élevée en période postopératoire.
Ainsi, deux études de bon niveau montraient que l’incidence des complications infectieuses postopératoires était diminuée [7] et que les réponses antimicrobiennes et pro inflammatoires des macrophages étaient augmentées par l’administration de FIO2 = à 0,8 [8].
De la même manière, des FIO2 élevées provoqueraient moins de vomissements et de nausées postopératoires comparativement à des FIO2 de 0,3 [9].
Comme souvent en médecine, ces études ont été contredites quelques années plus tard, l’explication de la contradiction reposant essentiellement sur les aspects de méthodologie [10].
Ainsi, il n’y a aucune justification actuelle à l’administration de FIO2 élevée quand la prévention des complications infectieuses postopératoires est en cause.
Par ailleurs, les experts en charge de l’élaboration des recommandations relatives à la prise en charge des nausées et vomissements postopératoires ne recommandent pas la supplémentation en oxygène en période postopératoire dans cet objectif.
LE REGLAGE DU RESPIRATEUR D’ANESTHESIE
Depuis les années 1960, période de début d’utilisation de la ventilation contrôlée de façon routinière en anesthésie, le volume courant avait été fixé à 12‐15ml/kg.
Ce choix faisait suite aux études montrant qu’un niveau de volume courant inférieur était susceptible de conduire à la constitution de zones atélectasiques associées à l’augmentation du shunt intrapulmonaire.
Récemment, les observations menées au cours de la ventilation du syndrome de détresse respiratoire aiguë ont questionné ce raisonnement.
En effet, de nombreuses études tant expérimentales que cliniques ont montré que des volumes courants élevés au cours de la ventilation de ces syndromes induisaient des lésions pulmonaires secondaires au volo traumatisme alvéolaire [11].
Trois considérations permettent aujourd’hui de cerner l’état d’avancement de cette interrogation :
1- La ventilation mécanique peropératoire s’adresse dans la très grande majorité des cas à des poumons antérieurement sains. Il a été montré que dans ces circonstances, des volumes courants de 15 ml/kg n’induisaient pas de réaction inflammatoire comparativement à une ventilation à volume courant inférieur (6ml/kg), soit après une heure de ventilation alors que la chirurgie n’avait pas été commencée [12], soit après 4 heures de chirurgie abdominale ou thoracique majeure [13]. Dans les deux cas, cette ventilation était effectuée à des niveaux de pression plateau considérés comme non agressifs pour le tissu pulmonaire, inférieurs à 30cm d’eau.
2- La durée de ventilation semble importante dans la genèse des lésions pulmonaires induites par la ventilation sur poumons antérieurement sains. En effet, une étude menée chez des patients de soins intensifs ventilés depuis plus de 48 heures, indemnes de lésion pulmonaire initiale, montre par une analyse multivariée que les principaux facteurs de risque associés au développement d’une lésion pulmonaire sont l’utilisation volumes courants supérieurs à 6 ml/kg (odds ratio de 1,3 par ml au‐dessus de 6ml/kg de poids idéal), la transfusion de produits sanguins ainsi que l’acidémie. Cette étude qui met en cause la durée de ventilation associée à l’importance du volume courant, confirme des travaux expérimentaux récents montrant qu’une ventilation à des volumes courants considérés comme protecteurs mais de durée supérieure à 24h induisent une augmentation de marqueurs de l’inflammation tel quel’Interleukine 6 et du nombre de neutrophiles dans le liquide lavage pulmonaire [14]. Ainsi une ventilation mécanique prolongée de poumons antérieurement sains avec des volumes courants considérés comme protecteurs est susceptible d’induire une altération de la fonction pulmonaire.
3- Enfin, l’existence d’une inflammation pulmonaire ou extra pulmonaire est susceptible d’interagir avec les effets propres de la ventilation mécanique, quel que soit le niveau des volumes courants utilisés. Par exemple, des volumes courants de 12ml/kg ont été montrés amplifier la réaction inflammatoire par rapport à des volumes courants de 6‐8ml/kg dans la chirurgie avec circulation extra pulmonaire. De même, une ventilation mécanique chez des rats ayant subi antérieurement un choc hémorragique suivi de remplissage adéquat, amplifie la réaction inflammatoire pulmonaire [15]. Ainsi, il semble exister une interaction entre l’agression inflammatoire induite par la ventilation mécanique et l’existence d’une inflammation pulmonaire ou extra pulmonaire. Cette observation peut être faite par exemple au cours de ventilation uni pulmonaire, il a été ainsi montré qu’une ventilation utilisant une stratégie protectrice diminuait la réponse systémique pro inflammatoire au cours d’oesophagectomie et ventilation unipulmonaire, avec conservation de l’efficacité d’échangeur pulmonaire [16].
Ainsi, d’un point de vue pratique, il apparaît logique aujourd’hui d’utiliser des volumes courants de l’ordre de 10ml/kg chez des malades à poumons antérieurement sains, d’opter pour une stratégie de réduction de ces volumes courants seulement chez les patients présentant un syndrome inflammatoire pulmonaire ou extra pulmonaire, ou anesthésiés pour une chirurgie susceptible d’induire un tel état inflammatoire comme une circulation extra corporelle ou une ventilation uni pulmonaire.
Dans ces cas de réduction de volume courant à 6 ml/kg, l’addition d’une pression expiratoire positive préviendra la constitution de zones atélectasiques.
LA PREVENTION ET LE TRAITEMENT DES ATELECTASIES PERI OPERATOIRES
La constatation de la genèse d’atélectasies par la ventilation monotone peropératoire est déjà ancienne, puisque dès 1965 JF Nunn et Col. observaient la constitution progressive d’une désaturation au cours d’une ventilation peropératoire dont l’imagerie récente a révélé quelle était secondaire à la constitution de zones atélectasiques [16].
Il n’existe actuellement aucun argument robuste démontrant que la survenue de ces zones atélectasiques est en relation causale avec les complications respiratoires postopératoires.
Il est cependant suggéré que chez certains patients, la prévention et le traitement de telles atélectasies peuvent diminuer l’incidence des complications respiratoires postopératoires.
1. La prévention des atélectasies
Elle utilise plusieurs moyens mettant en jeu les modalités de ventilation :
- L’application d’une pression expiratoire positive prévient la survenue de l’atélectasie si elle est appliquée dès l’induction.
- L’utilisation de la FIO2 modérée pendant l’entretien de l’anesthésie diminue l’incidence de ces atélectasies.
- La conservation du tonus musculaire en évitant l’utilisation de relaxant musculaire n’a pas fait la preuve définitive de son intérêt dans l’évitement de survenue d’atélectasie.
2. Le traitement des atélectasies constituées
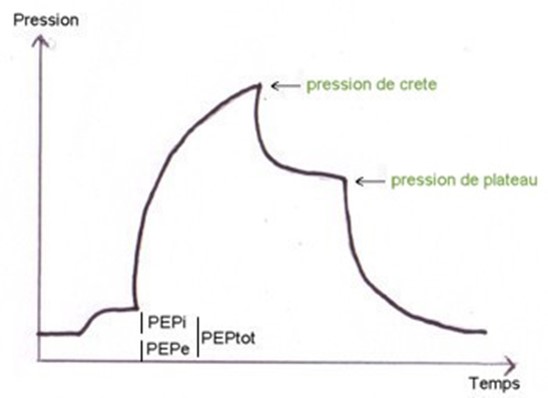
Dans le travail déjà noté de JF Nunn, il était indiqué que la correction de l’augmentation du shunt intra pulmonaire observé au cours de l’anesthésie ne pouvait être obtenue que par une pression positive de 40cm H2O pendant une durée de 40 secondes.
Ces données initiales ont été largement confirmées à la suite des études d’imagerie, montrant qu’une telle pression était susceptible de supprimer les zones atélectasiques observées par tomodensitométrie [17].
Une étude de cinétique de ce recrutement a par ailleurs montré que 8 secondes d’une telle pression étaient suffisantes pour supprimer les zones atélectasiques [18].
Ces manoeuvres de recrutement n’ont pas d’effet délétère sur la fonction pulmonaire, en revanche l’effet circulatoire est constant.
Elles induisent une diminution de la pression artérielle par diminution du débit cardiaque, cet effet est d’autant plus important qu’il existe au préalable un état d’hypovolémie.
Cet effet circulatoire pourrait être moindre quand les manoeuvres de recrutement sont faites par l’administration de volumes courants successifs induisant des pressions respiratoire de 40cm H2O.
Quel que soit le type de manoeuvre de recrutement réalisé, il convient de conserver l’avantage du recrutement par l’utilisation de FIO2 modérée, et l’administration d’une pression expiratoire positive de 10cm d’eau.
AU TOTAL
Si la ventilation mécanique peropératoire a rendu d’énormes services à la pratique médico‐chirurgicale au cours de années passées, les connaissances physiopathologiques récentes ont montré que de nouvelles stratégiques étaient possibles.
Deux contextes doivent être distingués :
- Les patients sans réaction inflammatoire pulmonaire ou extra‐pulmonaire sont ventilés avec les précautions de FIO2 peropératoires habituelles, avec des volumes courants de l’ordre de 10 ml/kg, la fréquence respiratoire étant adaptée grâce à la mesure de la PET CO2.
- Les patients ayant une telle réaction inflammatoire, ou susceptible par leur chirurgie d’en expérimenter une, bénéficieront probablement d’une stratégie de ventilation protectrice, en prenant soin d’administrer une pression expiratoire positive.
REFERENCES
[1] Rothen HU, Sporre B, Engberg G, Wegenius G, Reber A, Hedenstierna G. Atelectasis and pulmonary shunting during induction of general anaesthesia‐‐can they be avoided? Acta Anaesthesiol Scand 1996;40:524‐9.
[2] Edmark L, Kostova‐Aherdan K, Enlund M, Hedenstierna G. Optimal oxygen concentration during induction of general anesthesia. Anesthesiology 2003;98:28‐33.
[3] Rusca M, Proietti S, Schnyder P, Frascarolo P, Hedenstierna G, Spahn DR, et al. Prevention of atelectasis formation during induction of general anesthesia. Anesth Analg 2003;97:1835‐9.
[4] Rothen HU, Sporre B, Engberg G, Wegenius G, Reber A, Hedenstierna G. Prevention of atelectasis during general anaesthesia. Lancet 1995;345:1387‐91.
[5] Akca O, Podolsky A, Eisenhuber E, Panzer O, Hetz H, Lampl K, et al. Comparable postoperative pulmonary atelectasis in patients given 30% or 80% oxygen during and 2 hours after colon resection. Anesthesiology 1999;91:991‐8.
[6] Benoit Z, Wicky S, Fischer JF, Frascarolo P, Chapuis C, Spahn DR, et al. The effect of increased FIO(2) before tracheal extubation on postoperative atelectasis. Anesth Analg 2002;95:1777‐81, table of contents.
[7] Greif R, Akca O, Horn EP, Kurz A, Sessler DI. Supplemental perioperative oxygen to reduce the incidence of surgical‐wound infection. Outcomes Research Group. N Engl J Med 2000;342:161‐7.
[8] Kotani N, Hashimoto H, Sessler DI, Muraoka M, Hashiba E, Kubota T, et al. Supplemental intraoperative oxygen augments antimicrobial and proinflammatory responses of alveolar macrophages. Anesthesiology 2000;93:15‐25.
[9] Greif R, Laciny S, Rapf B, Hickle RS, Sessler DI. Supplemental oxygen reduces the incidence of postoperative nausea and vomiting. Anesthesiology 1999;91:1246‐52.
[10] Pryor KO, Fahey TJ, 3rd, Lien CA, Goldstein PA. Surgical site infection and the routine use of perioperative hyperoxia in a general surgical population: a randomized controlled trial. Jama 2004;291:79‐87.
[11] ARDSNet. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. The Acute Respiratory Distress Syndrome Network. N Engl J Med 2000;342:1301‐8.
[12] Wrigge H, Zinserling J, Stuber F, von Spiegel T, Hering R, Wetegrove S, et al. Effects of mechanical ventilation on release of cytokines into systemic circulation in patients with normal pulmonary function. Anesthesiology 2000;93:1413‐7.
[13] Wrigge H, Uhlig U, Zinserling J, Behrends‐Callsen E, Ottersbach G, Fischer M, et al. The effects of different ventilatory settings on pulmonary and systemic inflammatory responses during major surgery. Anesth Analg 2004;98:775‐81, table of contents.
[14] Bailey TC, Maruscak AA, Martin EL, Forbes AR, Petersen A, McCaig LA, et al. The effects of long‐term conventional mechanical ventilation on the lungs of adult rats. Crit Care Med 2008;36:2381‐7.
[15] Vaneker M, Halbertsma FJ, van Egmond J, Netea MG, Dijkman HB, Snijdelaar DG, et al. Mechanical ventilation in healthy mice induces reversible pulmonary and systemic cytokine elevation with preserved alveolar integrity: an in vivo model using clinical relevant ventilation settings. Anesthesiology 2007;107:419‐26.
[16] Michelet P, D'Journo XB, Roch A, Doddoli C, Marin V, Papazian L, et al. Protective ventilation influences systemic inflammation after esophagectomy: a randomized controlled study. Anesthesiology 2006;105:911‐9.[17] Tusman G, Bohm SH, Vazquez de Anda GF, do Campo JL, Lachmann B. 'Alveolar recruitment strategy' improves arterial oxygenation during general anaesthesia. Br J Anaesth 1999;82:8‐13.
[18] Rothen HU, Neumann P, Berglund JE, Valtysson J, Magnusson A, Hedenstierna G. Dynamics of re‐expansion of atelectasis during general anaesthesia. Br J Anaesth 1999;82:551‐6.