- Accueil
- Modules 1ére année
- 4. ENSEIGNEMENTS DIRIGÉS & PRATIQUES-Techniques- (VH: 90 h, Coef: 3)
- Les Evaporateurs
Les Evaporateurs
HERVE MENU. In JLAR (Les Journées Lilloises d'Anesthésie Réanimation et de Médecine d'Urgence)
1. INTRODUCTION
1.1. LES ANESTHESIQUES VOLATILS :
Les anesthésiques volatils sont à 20° sous forme liquide, pour les administrer au patient il faut Les faire passer à l'état gazeux
⇒ rôle et de la chambre d'évaporation
⇒ influence des propriétés physiques des gaz
Pouvoir doser la quantité de vapeur délivrée au circuit patient ⇒ Rôle du vaporisateur
Les évaporateurs sont des dispositifs qui transforment un anesthésique liquide en sa vapeur ( on définit comme vapeur un gaz qui est principalement sous forme liquide à température ambiante). Cet évaporateur délivre une quantité contrôlable de gaz dans un flux gazeux destiné à un patient : les "gaz frais".
1.2.EVAPORATEUR : PRINCIPE DE FONCTIONNEMENT :
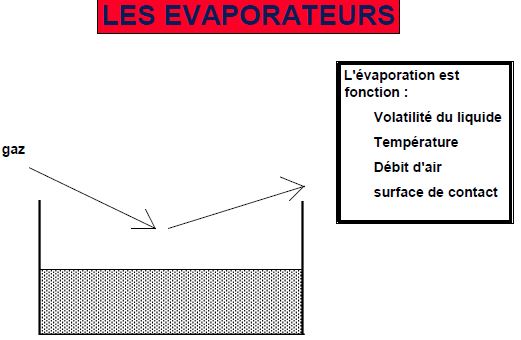
Un liquide volatil mis en contact avec de l'air s'évapore, ceci est du au fait que des molécules de ce gaz diffusent dans le gaz. Cette évaporation est fonction de :
- la volatilité du liquide
- la température du liquide
- débit du gaz à la surface
- la surface de contact (ou le volume et la configuration de la chambre d'évaporation)
DANS TOUT CE QUI VA SUIVRE, on considère que les vapeurs anesthésiques se comportent comme des gaz.
1.3. HISTORIQUE
- 1638 Le belge JB HELMONT découvre l'anhydride carbonique, le mot gaz dérive du flamant Ghoast (=esprit).
- 1676 : loi de Mariotte sur la compressibilité des gaz
- 1772 : Rutherford découvre l'azote
- 1773 : Carl Wilhelm SCHEELE isole l'oxygène
- 1776 Priesley isole le protoxyde d'azote'
- 1798 : Alexandre César CHARLES énonce la loi d'augmentation de pression à volume constant
- 1799: Humphry DAVY purifie le Protoxyde d'Azote et envisage de l'utiliser dans la douleur chirurgicale
- 1801 : DALTON énonce la loi des proportions multiples
- 1808 : Louis Joseph GAY LUSSAC énonce la loi qui dit que les volumes de 2 gaz qui se combinent entre eux sont dans un rapport simple
- 1811 AVOGADRO énonce la loi qu'un même volume de gaz contient le même nombre de molécules et en déduit les masses moléculaires.
- 1844 : le dentiste américain Horace Wells réalise sur lui la première anesthésie au Protoxyde d'Azote'
- 1837 :inscription oxygène à la pharmacopée française
- 1877 : première liquéfaction des gaz
- 1908 inscription Protoxyde d'Azote à la pharmacopée française
- 1930 : utilisation du Cyclopropane
- 1932 : première installation de gaz médicaux
- 1934 : utilisation de Trilène (trichloréthylène)
- 1947 : Chlorure d'éthyl (C²H5Cl)
- 1950 : première installation air médical par combinaison oxygène et azote
- 1953 : Fluoromar
- : Halothane
- 1963 : synthèse Enflurane
- 1965 synthèse Isoflurane
- 1992 : loi 92 1279 du 8/12/1992 imposant que las gaz à usage médicaux aient un A.M.M.
- (transpose la directive européenne 89/341/CEE du 3 mai 1989)
- 1994 : Mise sur le marché du Desflurane
- 1995 : Mise sur le Marché du Sévorane
Des propriétés physiques des molécules pouvant passer sous forme de gaz vont influer sur la conception des chambres d'évaporation.
1.4. DEFINITION
Corps qui se présente à l'état fluide expansible et compressible à température et condition de pression normales soit température =0 Celcius et pression d'1 atmosphère..
1.4.1.Expansibilité
se répartit et occupe tout le volume d'un espace clos en engendrant une pression partout identique
1.4.2.Compressibilité
possibilité d'entraîner une faible augmentation de pression en diminuant le volume du contenant.
2. CLASSIFICATION DES GAZ
2.1. SELON LEUR ETAT PHYSIQUE
2.1.1.Gaz comprimés
gaz dont la température critique est inférieure à la température ambiante; Tout le produit est à l'état gazeux dans la bouteille
2.1.2.Gaz liquéfiés sous pression
Température critique supérieure à température ambiante, la compression les fait passer en partie sous forme liquide. La pression exercé est égale à la PVS.
2.1.3.Gaz liquéfiés à basse température ou cryogéniques:
Gaz rendus liquides par baisse de la température et transportés réfrigérés;
2.1.4.Gaz Dissous
Gaz instable dissous dans un solvant (acétylène).
2.2. CLASSIFICATION SELON LES PROPRIETES CHIMIQUES
un Gaz peut être neutre(Gaz n'entraînant pas de combustion et ne réagissant que dans des conditions extrêmes (Argon)) ou bien combustible (= inflammable) ou bien comburant (=oxydant) ou bien corrosif.
Un gaz qui s'enflamme spontanément au contact de l'air est dit Pyrophorique (Silane)
2.3. CLASSIFICATION SELON LEUR PROPRIETE PHYSIOLOGIQUE
2.3.1.Gaz inerte
Gaz dénué d'effet physiologique connu autre qu'asphyxiant si hypoxie(argon, azote, hélium).
2.3.2.Gaz pharmacologique ment actifs :
Gaz qui administrés par voie pulmonaire ont un effet physiologique voire thérapeutique.
2.3.3.Gaz toxiques:
Gaz nocifs pour les organismes vivants, cette toxicité peut être instantanée, immédiate (15 min.), ou à long terme.
Pour ces gaz on défini :
- La VLE (Valeur limite d'exposition) qui est une valeur toxique mesure pour des dures d'exposition de moins de 15 minutes'
- La VME: Valeur Moyenne d'Exposition détermine pour une exposition de 8 heures.
Ces doses sont exprimées en p.p.m. ou particule par million ou millionièmes en volume ou en mg/m3
2.4. CLASSIFICATION SELON LES COMPOSANTS :
Gaz pur ou mélange.
2.5. CLASSIFICATION SELON LA PURETE :
S'exprime en %, en p.p.m. ou en p.p.b./vol (Partie par milliard en volume
On distingue des gaz industriels, médicaux (leur pureté est inscrite à la pharmacopée),et de laboratoire.
Les dérivés halogénés sont donc des bouteilles de gaz renfermant un gaz pur ou un mélange (halothane et conservateur par exemple), physiologiquement actif et pouvant par assimilation être considérés comme liquéfié.
Les vapeurs d’halogénés étant la forme active et se comportant comme des gaz, il est important de connaître les propriétés physiques d’un gaz pour comprendre la cinétique de la vaporisation et le comportement des vapeurs dans un mélange gazeux.
3. PROPRIETES PHYSIQUES DES GAZ
3.1. LOI D'AVOGADRO :
Des volumes égaux de 2 gaz à température et pression identiques renferment le même nombre de molécules.
Donc densité du gaz proportionnelle à son P.M.
Le nombre d'Avogadro est le nombre de molécules contenues dans un volume molaire normal (22,41 litres). Ce nombre est égal à 6,02*10 23.
3.2. DIAGRAMME DES PHASES:
Donne en fonction de la température et de la pression l'état d'un gaz
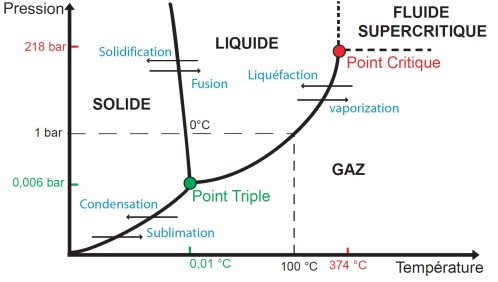
Figure 2 : diagramme des phases
Le point critique se définit comme étant le point où il n'existe plus d'équilibre gaz/liquide (tout est gazeux)
Ceci montre qu'un corps à l'état liquide est en fait toujours en équilibre avec sa pression de vapeur saturante (PVS)
A l'état d'équilibre et à une température donnée, la pression exercée par la vapeur reste constante et en équilibre avec le gaz , cette pression est appelée Pression de Vapeur Saturante.
3.3. CHALEUR LATENTE DE VAPORISATION:
Le passage liquide gaz nécessite l'apport de chaleur, cette chaleur latente varie en fonction du corps, des condition de pression.
La chaleur latente de vaporisation est nulle lorsque la température est > à la température critique.
NB: Protoxyde d'Azote : température liquéfaction = -88,5, température solidification = -90,8, donc dur de garder Protoxyde d'Azote à phase liquide.
3.4. RELATION PRESSION VOLUME :
La compression d'un gaz se fait selon 3 phases :
• Basse pression, corps gazeux augmentation régulière de pression quand vol diminue
• Gaz en partie liquide : La réduction du volume se fait à pression constante
• Quand tout le corps est liquéfié : grande augmentation de pression quand petite baisse de volume.
3.5. EQUATION D'ETAT :
C'est une équation qui relie pression, température, volume
La plus simple est la loi de Mariotte ou équation des gaz parfaits
P V = n R T
où
- P est la pression absolue
- V est le Volume occupé par le gaz
- n est le nombre de moles contenues dans le volume de gaz V
- R est la constante des gaz parfaits (R= P0 * V0 / T0 = 8,314 Joules Moles-1 Kelvin-1
- T est la température en degrés Kelvin.
En réalité cette loi ne tient compte que des collision entre les molécules d'un même gaz, seul l'hydrogène s'en rapproche.
Plus un gaz est près de sa température de liquéfaction, moins il est parfait.
Pour les gaz réels, le loi de Mariotte est corrigée par un facteur de compressibilité Z, on obtient donc
P V = Z(T,P) n R T
3.6. LES RELATIONS GAZ, VOLUME, PRESSION, TEMPERATURE DE TOUS LES GAZ:
3.6.1.La Loi de Boyle Mariotte :
à température et masse constante, le produit pression par vol est une constante.
P V = cst
En pratique, une bouteille contenant du gaz sous forme gazeuse pure : le contenu de la bouteille en gaz décomprimé est proportionnel la pression
3.6.2.Loi de Gay Lussac
La pression et la masse restant inchangée, le volume varie en fonction de la température absolue
V/T = cst
V=V0 (1 + ∝ (T-T0)
∝ est une constante indépendante de P
3.6.3.Loi de Charles
Le volume et la masse restants inchangés, La pression d'un gaz exercée sur son contenant varie en fonction de sa température absolue
P/T= cst
P = P0 ( 1 + β (T-T0))
∝ = β = 1/T0= 1/273,15
3.6.4.Loi de Dalton
La pression d'un mélange gazeux dans un contenant est la somme des pressions partielles qu'auraient chacun des gaz s'ils occupaient seul la même volume, à une même température.
La pression exercée par un gaz étant le produit de sa concentration fractionnelle par la pression totale (ici la barométrique)
P0² = F 0² * P barom
Pour les évaporateurs fonctionnant à 20° cette fraction peut se traduire en fraction, ainsi pour l’Halothane, elle est de 32%.
.
Si la température baisse ou augmente, la valeur de la PVS et de la fraction change dans le même sens.
Lorsque l'halogéné atteint sa température d’ébullition, la pression partielle qu'il exerce est égale à la pression atmosphérique.
3.7. DIFFERENCE GAZ REEL ET PARFAIT POUR L'OXYGENE: EXEMPLE
Une bouteille de 50 litres contient O2 à 200 bars à 15°.
| GAZ PARFAITS | GAZ REELS |
|---|---|
|
Vol (1atm) * Pres atm =Vol (50)*press(200) donc V= 50*200/ pression atmo |
Le coefficient de compressibilité 200 bar et 15° = 0,9415 |
3.8. APPLICATION AUX HALOGENES :
La loi d’Avogadro peut avoir une utilité en anesthésie lorsque l'on veut calculer la consommation d'un halogéné.
En effet, soit PMH le P.M. de l'halogéné, PMH donne 22.414 litres de gaz, donc 1 gramme de liquide donne 22.414 l / PMH litres de vapeur (ou de gaz)
autrement dit :
un ml de liquide devient :
22.414 * densité du produit / PMH litre de vapeur (*1000 si on veut en ml) comme on travaille à une température t: 1ml d'halogéné devient : ((22.414*(1+t/273))*densité halog/PMH)*1000 ml de vapeur
Les données des 3 halogénés principaux sont :
| NOM | P.M | Densité |
|---|---|---|
| Fluo | 197.39 | 1.86 |
| Ethrane | 184.5 | 1.52 |
| Forène | 184.5 | 1.49 |
| Desflurane | 168 | 1.50 |
| Sevorane | 200 |
ainsi pour le Fluo : 1 ml donne à 20 degrés
22.414 * (1+20/273) * 1.86 / 197.39 *10000 = 226 ml
Ethrane = 198 et iso = 194
4. LES UNITES UTILISEES:
4.1. TEMPERATURE
| Echelle | Température congélation | Température ébullition |
1° K = (équivalence des degrés) |
|---|---|---|---|
| Kelvin(°K) | 273.15 | 373.15 | 1 |
| Celsius(°C) | 0 | 10 | 1 |
| Réaumur(°R) | 0 | 80 | 0.8 |
| Fahrenheit(°F) | 32 | 212 | 1.8 |
4.2. PRESSION :
L'unité SI est le pascal qui est la pression exercée par 1 newton sur une surface de 1 mètre carré
| Unité | Abréviation | Valeur en SI |
|---|---|---|
| Pascal | Pa | 1 |
| Bar | Bar | 105 Pa (100 000) |
| Atmosphère | atm | 101 325 pa |
| Centimètre d'eau | cm H2O | 249 |
| Millimètre de mercure | mm HG | 133,3 |
| Torricelli | Torr | 133,3 =1 mm Hg=1/760 atm |
NB 1 mm Hg = cm d'eau
4.3. VOLUME :
| Unité | Abréviation | Correspondant à (litre) |
|---|---|---|
| Mètre cube | m3 | 1000 |
| Pied cube | ft3 | 28.32 |
| Galon | US gal | 3.785 |
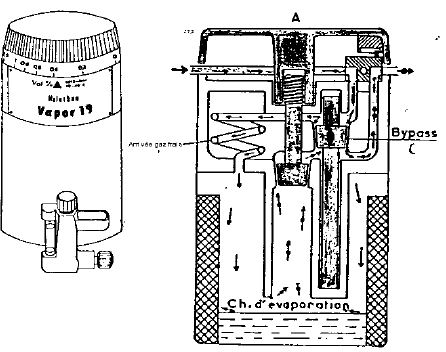
5. PRINCIPE DE FONCTIONNEMENT D'UN EVAPORATEUR CLASSIQUE :
5.1. PRINCIPE
Les évaporateurs fonctionnent en mettant en contact un gaz vecteur avec du liquide en équilibre avec ses vapeurs; il existe trois type de contact :
Goutte à goutte :
- simple: on laisse tomber des gouttes dans le conduit du gaz et une certaine quantité s'évapore
- plus actuel : Délivrance par SAP ou injecteur d'une certaine quantité d'halogénés calculée en fonction du débit de gaz frais et de la concentration voulue, l'halogéné est ensuite passé sur un système de nébuliseur à ultra son et les vapeurs sont emportées par le gaz
- Système à léchage : le courant d'air balaye la surface du liquide
- Système à barbotage : le gaz passe au travers du liquide la surface de contact des gouttes est importante.
La concentration maximale en vapeur doit être égale à la PVS dans le chambre d’évaporation; cette quantité ne dépend que de l’halogéné et de la température. Pour avoir une concentration précise de vapeur halogéné, il suffit de diluer une quantité connue de vapeur halogénées dans un mélange gazeux sans halogéné. C’est le principe des évaporateurs à bypass variable ou à débit contrôlé.
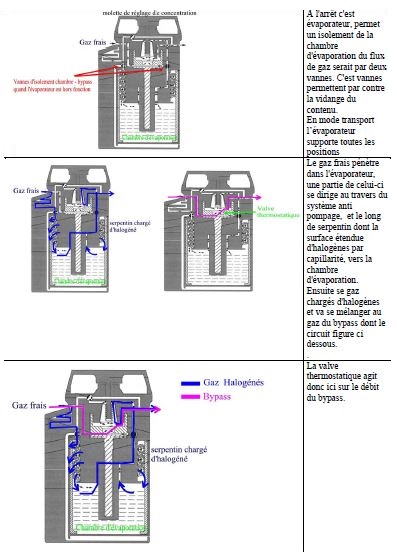
5.2. LES EVAPORATEURS A BYPASS VARIABLE
La majorité des évaporateurs fonctionnent sur ce principe, une partie du plux de gaz frais est dirigé vers une chambre d’évaporation où la pression de vapeur halogénée est la pression de vapeur saturante, l’autre partie court circuite cette chambre d’évaporation
Exemple avecd l’halothane (PVS #32% à 20°), concentration souhaitée de 1.6%
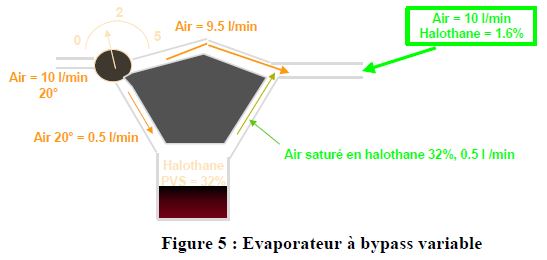
Bien entendu, si l'on souhaite une concentration supérieure par exemple 3,2 %, dans ce cas il passera 98 minutes par le bypass et 1 l par la chambre d'évaporation.
La mallette de réglage de l'évaporateur va donc permettre de faire varier la partie de débit de gaz frais passant par la chambre d'évaporation.
Cette modélisation n’est valable qu’à température constante. En pratique, il se greffe des problèmes de température de fonctionnement et d’échange thermique.
5.3. ASPECT CALORIQUE :
5.3.1.les problèmes rencontrés :
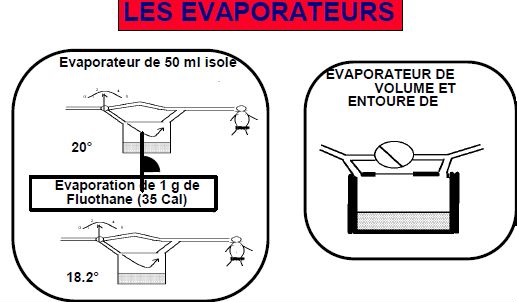
Pour qu'un liquide s'évapore, il faut qu'il y ait une certaine agitation thermique (à - 273 elle est nulle et y'a plus de gaz).
L'évaporation consomme donc de la chaleur, pour évaporer un gramme de FLUO, il faut une perte de 35 calories.
Cette quantité est appelée chaleur latente de vaporisation. Or, la quantité de chaleur pour augmenter ou diminuer la température du FLUO aux alentours de 20° est de 0.19 calories; cette quantité est appelée chaleur spécifique.
On conçoit donc que si l'on a une cuve de 50 ml contenant du FLUO, totalement isolée sur le plan thermique et que 1 gramme de FLUO s'évapore soit 0.5 ml, la perte est de 35 calories, ceci fait passer la température du reste du mélange à 35/0.19*100 # 1.8 °.
Il faut donc si l'on veut avoir une réaction stable dans le temps prévoir une cuve conductrice de chaleur et de masse importante de façon à pouvoir absorbé les variations de températures.
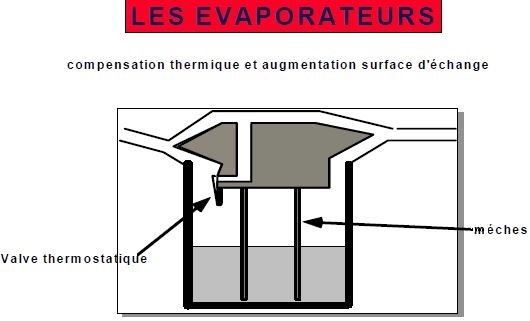
5.3.2.Valve thermostatique :
Lorsque la température baisse dans l'évaporateur, la PVS baisse et donc la fraction délivrée d’halogénés.
Pour maintenir une concentration constante d'halogéné, il faut augmenter la partie de flux de gaz passant par la chambre de vaporisation et diminuer le flux du bypass.
Ceci a aussi pour effet d'augmenter le transfert de chaleur depuis le gaz vecteur vers l'halogéné et de combattre la chute de température.
Cette modification est sous le contrôle d'une valve thermostatique. Celle ci a l’aspect d’une bivalve métallique.
5.4. AUGMENTATION DE LA SURFACE DE CONTACT :
Si le flux de gaz est important, il est possible que la chambre d’évaporation ne soit pas totalement saturée en vapeurs d’halogénés (PV <> PVS)
Pour faciliter le maintien d'une P.V. = PVS, on peut également jouer sur la surface de contact entre le gaz et l'halogéné, c'est le rôle des mèches (généralement métalliques situées dans la chambre d'évaporation :
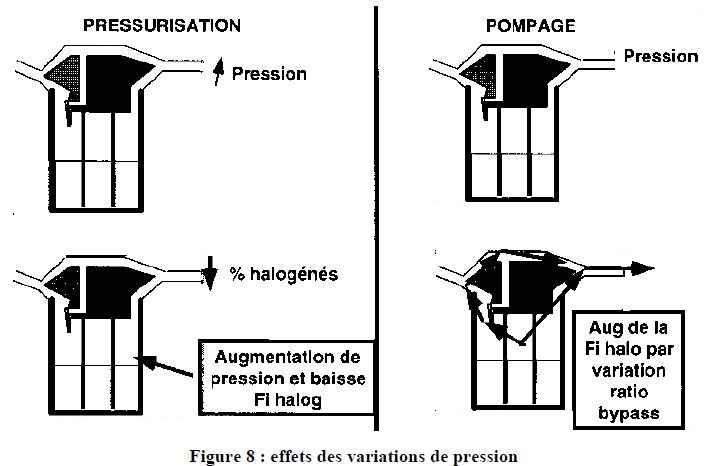
5.5. ROLE DES MODIFICATIONS DE PRESSION :
Si je ventile un sujet à l'ambu avec un évaporateur simple placé en amont, il existe une augmentation de pression en amont qui se répercute au niveau de l'évaporateur, ce qui occasionne une augmentation de la pression (donc du nombre de molécules ) du gaz alors que le nombre de molécule de vapeur reste constant; ceci induit une baisse de la fraction de vapeur.
C'est d'autant plus vrai que le débit de gaz est élevé et que la concentration de vapeur souhaitée est faible. Cet effet s'appelle l'effet de pressurisation.
Lors de la baisse de pression, il existe une issue depuis la chambre d'évaporation vers le patient plus importante que à flux constant, ceci peut entraîner un passage de gaz et d'halogéné vers le bypass et augmenter transitoirement la concentration vers le patient.
Ceci s'appelle l'effet de pompage.
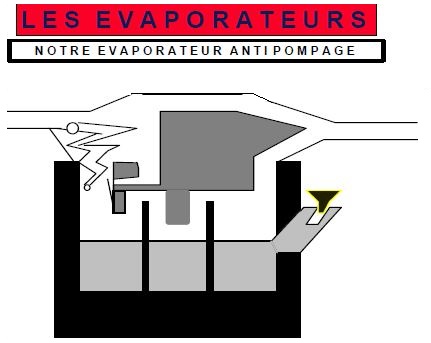
On le combat en diminuant le volume de gaz de la chambre d'évaporation et en allongeant le trajet du gaz entrant dans la chambre ( tube spiralé).
L'effet de pompage survient plutôt quand les débits de gaz sont faibles et la concentration souhaitée forte. Il est plus important en clinique que l'effet de pressurisation.
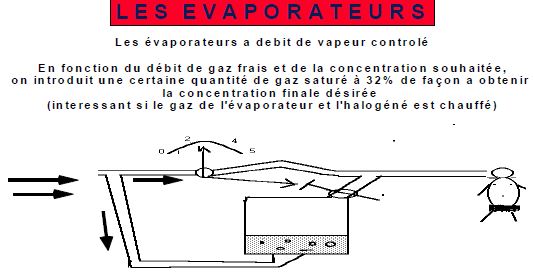
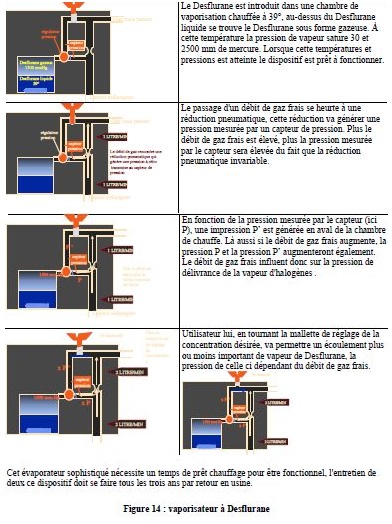
5.6. EVAPORATEURS A DEBIT DE VAPEUR CONTROLEE
Par rapport au précédent type d'évaporateurs, le flux de gaz frais et les chargés de molécules d'halogènes et évaporer.
Ce débit de vapeur peut être soit réglé manuellement, soit sur les machines actuelles réglées de manière électronique. La majorité des évaporateurs d'y électronique fonctionne sur ce principe.
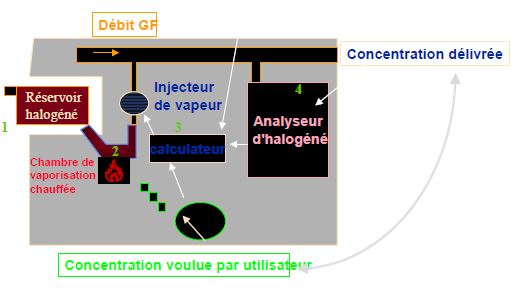
Le schéma suivant vous présente ce type d'évaporateur, (exemple Datex ADU)
1. une cassette contenant des halogènes et est introduite auprès de l'évaporateur et permet la reconnaissance de l'halogène.
2. Une chambre de vaporisation chauffée permet la conversion totale de l'halogène et est présent dans cette chambre sous forme de vapeur. La température de cette chambre peut-être ajustée en fonction de l'halogène et point c'est évaporateur permet donc d'utiliser plusieurs halogènés et avec le même système de vaporisation.
3. En fonction de la concentration désirée par l'utilisateur, et du débit de gaz frais, un calculateur calcule que le nombre de millilitres de vapeur a apporté au circuit patient. Cet apport sera réalisé grâce à un injecteur de vapeur.
4. La contrôle de la concentration dans le débit de gaz frais est assuré de manière optionnelle par un analyseur d'halogènes
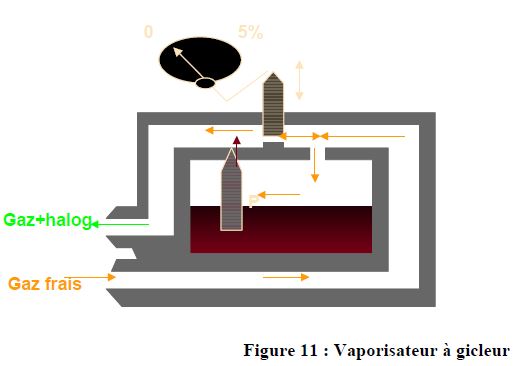
5.7. VAPORISATEUR A GICLEUR: >SIEMENS POUR SERVOVENTILATEUR
l'anesthesique sous pression est injecté en amont du ventilateur, à des pressions voisines de 3bars dans le flux de gaz. Il faut une compensation de l'injection en fonction du mélange gazeux.
Une Réduction du diamètre variable (1) génére une contre pression dans la chambre de vaporisation, plus la réduction est importante, plus la pression sur le gicleur est élevée et donc plus on injecte d'halogénés.
L'augmentation de DGF cré aussi une augmentation de pression qui induit une injection plus importaznte d’halogénés dans le circuit.
Ce type de vaporisateur peut être mis dans un circuit fermé si vérification constante de la concentration d'halogénés.
6. LES DIFFERENTS EVAPORATEURS :
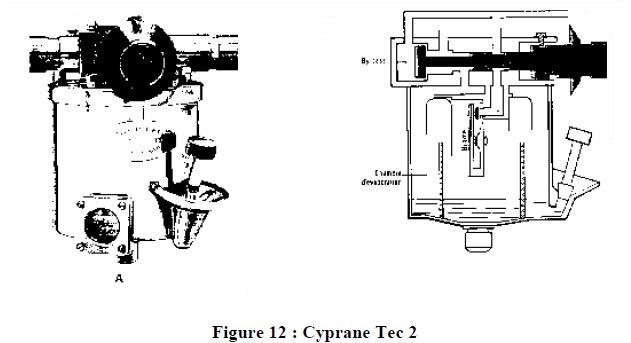
6.1. CYPRANE FLUOTEC MK2
Ressemble au notre, le volume de la chambre est de 630 ml, la concentration est proche de celle affichée de 4 à 10 l/min. Si le débit est inférieur à 0.5 litres, la concentration est nulle puisque la force d'inertie du gaz n'arrive pas à vaincre les résistances de l'évaporateur, de 0.5 à 4 litres la concentration est supérieure à celle affichée.
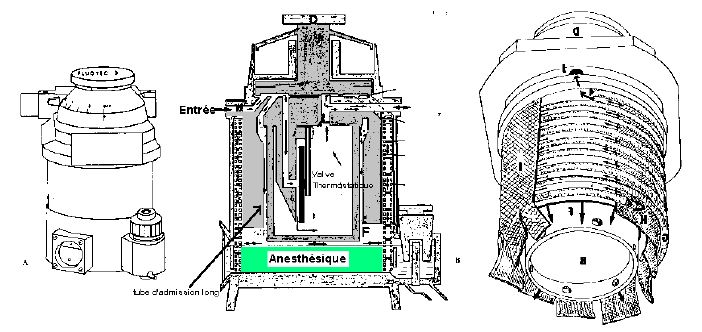
6.2. FLUOTEC 3
Le volume de la chambre est de 150ml; le gaz frais passe dans une chambre d'évaporation et ressort dans 'un serpentin de cuivre de 2.40m tapissé de mèche.
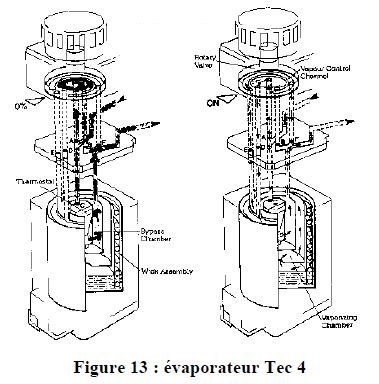
6.3. TEC 4
Supporte d’être incliné jusque 45° sans problème.
6.4. VAPOR 19 DE DRAEGER
La connexion se fait par le système Interlock 2
Température entre 15 & 35°
Débit de fluide de 0.5 à 15 litres/minute
Il est interdit de fonctionner en affichant une concentration entre 0 et 0.2% (la concentration n'est alors pas connue).
* AVEC HALOTHANE :
Entre 0.3 et 1% la différence entre la concentration indiquée et la concentration mesurée peut être de 0.15% maximum ( Un appareil en bon état de marche délivre pour une concentration affichée de 0.4% entre 0.25 et 0.55% Halothane )
Au delà de 1% la variation permise est de 15% de la concentration affichée
( Un appareil en bon état de marche délivre pour une concentration affichée de 3% entre 2.55 et 3.45% Halothane )
* AVEC ISOFLURANE :
Entre 0.2 et 1%, la différence entre la concentration indiquée et la concentration mesurée peut être de 0.15% maximum ( Un appareil en bon état de marche délivre pour une concentration affichée de 0.4% entre 0.25 et 0.55% d'Isoflurane)
Au delà de 1% la variation permise est de 15% de la concentration affichée
( Un appareil en bon état de marche délivre pour une concentration affichée de 5% entre 4.25 et 5.75% d'Isoflurane).
6.5. DRAGER VAPOR 2000
6.6. RESUME DES CARACTERISTIQUES DES EVAPORATEURS A BYPASS VARIABLE
| Nom | chambre | température | débit l/min | erreur | commentaire |
|---|---|---|---|---|---|
| Fluotec2 | 630 ml | 20-30 | 4-10 | ||
| Fluotec 3 | 150 ml | 18-36 | 0.25-10 | 15% jusque 3% plus ensuite | pds=6.3kg |
| Fluotec 4 | |||||
| Dräger 19.3 | 15-35 | 0.5-15 | 15 % ou 0.15 | ||
| Drager 2000 | 300 ml (+60ml pour méches) | 10 à 40 ° C | 0.25–15 |
Angle inclinaison supporté en service 30° |
|
| Tec 6 |
6.7. EVAPORATEUR A DESFLURANE :
Commercialisé par Draeger et Ohmeda mais fabriqué seulement par Ohmeda.
La temp de vaporisation de Desflurane est de 23° donc, la choix a été fait d’utiliser ce produit au delà de sa valeur d’ébulition.
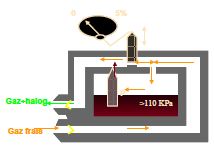
6.8. EVAPORATEUR PIVAP (DESFLURANE SIEMENS)
C’est un Evaporateur a gicleur pour Desflurane
Le Principe est identique à l'évaporateur a gicleur mais pour que cela fonctionne il faut que le Desflurane n’atteigne pas son point d’ébullition, de façon à ce qu'il reste liquide lors de l'injection.
Or la température d'ébullition du Desflurane est de 22° Celsius à 101,3 kPa (pression atmosphérique) et de 39° à 110 kPa.
En conséquence à la fin que le Desflurane reste sous forme liquide, une pression de 110 KPa est maintenue à l'intérieur de l'évaporateur. Ainsi le fonctionnement de c'est évaporateur et superposable au fonctionnement des autres évaporateurs à gicleurs. Bien sûr le fonctionnement ne sera pas possible au-delà de 39°. En cas de déconnexion de l'évaporateur de son support, des valves se ferment et maintiennent la pression à l'intérieur du dispositif.
7. QUELQUES REMARQUES PRATIQUES :
7.1. THYMOL ET HALOTHANE
Halothane est stabilisé par 0.01% de Thymol, le Thymol ayant un point d'ébullition à 233°C, il est donc moins volatil que le Fluo, il aura donc tendance à rester dans la cuve, c'est ce qui donne la jolie couleur jaune au vieux Fluo. Il convient donc en moyenne une fois par mois (toute les semaines pour la SFAR) de faire ou de faire faire une vidange des cuves à fluo ( vider, remplir, vider , jeter puis remplir à nouveau).
7.2. ERREUR D'HALOGENE :
| Evaporateur\ halogéné versé | Halothane | Enflurane | Isoflurane |
|---|---|---|---|
| Halothane | 1.00 | 0.60 | 0.97 |
| Enflurane | 1.60 | 1.00 | 1.55 |
| Isoflurane | 1.02 | 0.63 | 1.00 |
C'est surtout quand on rempli un évaporateur à Enflurane d'autre chose qu'on a des risques de surdosage; lorsque cette erreur se produit ; un analyseur est il utile?
Les analyseurs infrarouge monobande ont un coefficient de gain six fois plus important pour le FLUO que pour les autres, i.e.
- si 1% fluo et sur Ethrane ou iso sélectionné : on lira 0.2 - 0.3 %
- si sélectionne fluo sur analyseur et que il arrive 1% d’éthane, la concentration lue sera de 5 - 6% Si remplissage évaporateur à Ethrane avec Fluo et qu'on affiche 1%; la concentration délivrée
sera de 1.6%; si l'analyseur est sur :
- Ethrane on lira 0.3%
- Fluo on lira 1.6%
Lorsque le remplissage survient sur une cuve non vide , on aura un mélange d'halogéné qui donnera quelque chose de plus dangereux et de difficilement quantifiable.
Diverses solution ont été proposées : rampes Sélectatec ou Interlock ou autre
Système de remplissage sélectif avec parallélépipède spécifique et filetage spécifique
7.3. TRANSPORT :
Il convient de transporter les évaporateurs debout ou vidés (sauf Tec 4) Vapor 19.3 :L'appareil ne doit pas être incliné de plus de 45°, si une telle éventualité se produit: faire passer un flux de 10 litres à concentration max. pendant 20 minutes au travers de l'évaporateur avant nouvel emploi (attention à la pollution de la pièce!!
Lorsque l'on transporte des vaporisateurs d'une pièce à une autre qui ont des températures différentes, il faut attendre le temps nécessaire à ce que l’évaporateur soit à la température de la pièce pour s'en servir
7.4. ENTRETIEN :
Problèmes éventuels:
- Dérive de la concentration : c'est pas grave car clinique et analyseurs
- Fuites : problème moins accessible, le risque principal est (expérience personnelle sur Tec 3 en mater) lorsque l'on ventile en pression positive de voir le gaz repartir par la molette de l'halogéné, on se retrouve sans halogéné et sans oxygène!!
Donc nécessité d'un entretien préventif (ne serait ce que du point de vue médico-légal) tous les ans pour Tec 3 et 4, Six mois pour Draeger, Trois ans pour Tec 5. La chambre d'évaporation et les mèches ont une durée de vie de 2 à 5 ans en moyenne)
Ce genre d'entretien a un coût de 1500 à 2500 F par an et un vaporisateur coûte 15 à 20 000 francs.
7.5. POSITION DANS LE CIRCUIT :
Lorsque deux vaporisateurs sont placés en série, il faut toujours mettre en amont celui qui a la PVS la plus faible, ainsi la fraction du bypass qui va dans l'évaporateur est plus faible dans le second.??
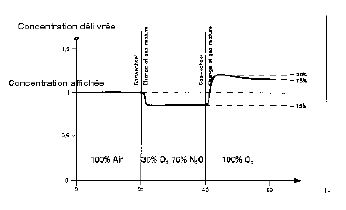
7.6. VARIATION SELON LA COMPOSITION DU GAZ
Tout évaporateur est réglé en présence d'air, en cas de variation de la composition du gaz des variations de concentrations apparaissent du fait de changement de la viscosité du fluide :
- En O² pur : augmentation de 15% de la concentration d'halogénés
- Avec 30% d'O² et 70% de N²O : baisse de 15 % de la concentration par rapport à celle observée en air.
Donc si on veut contrôler un évaporateur : le faire en air (la SFAR préconise une précision de +/- 20 %, mais ne précise pas le gaz vecteur)
7.7. VAPORISATION ET REMPLISSAGE :
Lorsque la quantité d'halogéné baisse dans la cuve, il arrive un moment donné où la concentration délivrée diminue, heureusement, les mèches diminuent ce phénomène.
Suite au remplissage d'une cuve par un produit sortant en théorie du réfrigérateur; il existe une baisse de la PVS jusqu'à ce que la température du médicament soit redevenue égale à celle avant remplissage. Les valves thermostatiques permettent une compensation de ce phénomène.
function gtag(){dataLayer.push(arguments);} gtag('js', new Date()); gtag('config', 'UA-20853834-1');
Date de dernière mise à jour : 28/02/2020
Ajouter un commentaire