- Accueil
- Modules 1ére année
- 4. ENSEIGNEMENTS DIRIGÉS & PRATIQUES-Techniques- (VH: 90 h, Coef: 3)
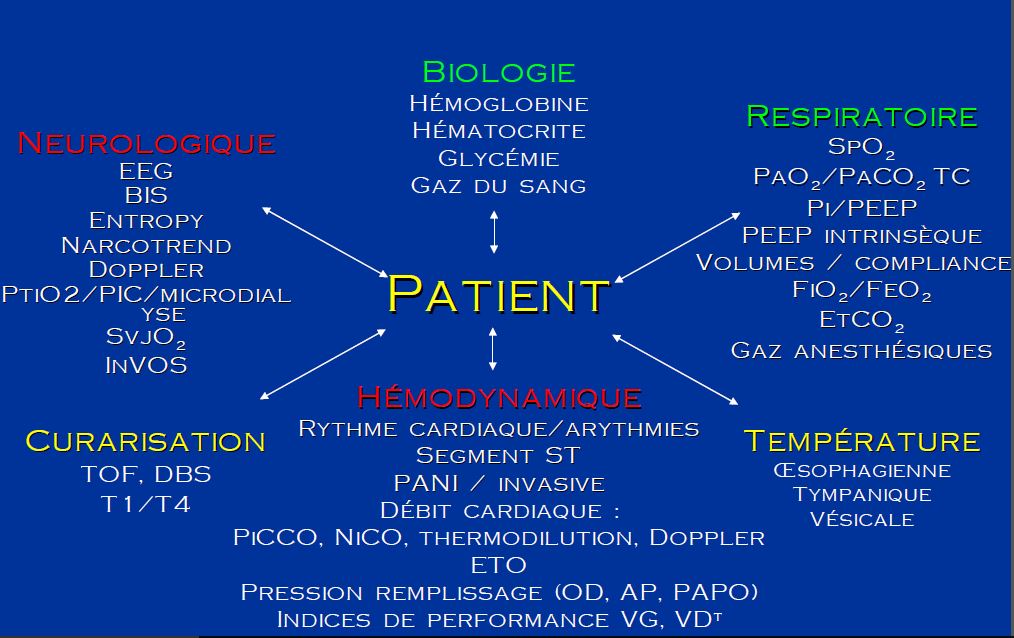
- Le monitorage au bloc opératoire
Le monitorage au bloc opératoire
S. Pili-Floury, B. Devaux, E. Samain * Service d'anesthésie-réanimation, CHU Jean Minjoz, 3, boulevard Fleming, 25030 Besançon cedex, France* e-mail : e1samain@chu-besancon.fr
DEFINITION
Le monitoring est l'anglicisme du terme surveillance
MONITORAGE s. m. (angl. monitoring). Enregistrement permanent de certains signes physiologiques à l’aide d’un dispositif de surveillance électronique.
Surveillance médicale en continu ou à intervalles rapprochés, effectuée par mesure de paramètres ou par enregistrement de phénomènes divers (contractions utérines, battements cardiaques, etc.)
Le but du monitorage est de donner des informations sur la situation clinique du patient, afin d'en améliorer la prise en charge.
Recommandations de la Sfar
| Paramètres | Équipement |
|---|---|
|
Contrôle continu de : |
Électrocardioscope |
|
Surveillance de : |
Sphygomanomètre ou brassard automatisé |
|
Contrôle continu (si intubation trachéale) de : |
Spiromètre ou débitmètre |
Monitorage minimal rendu obligatoire par le décret du 5 décembre 1994 et recommandé par la Sfar. Il est précisé dans le décret que le matériel doit permettre l'administration de gaz et vapeurs anesthésiques, ce qui a conduit la Sfar à recommander la mesure des concentrations inspirées et expirées des agents anesthésiques par inhalation.
La deuxième édition des Recommandations concernant la surveillance des patients en cours d'anesthésie ont intégré les obligations réglementaires et précisent de plus qu'un analyseur de vapeur anesthésique est nécessaire, pour les anesthésies avec un circuit filtre alimenté par un faible débit de gaz frais.
Elles soulignent que la présence d'un médecin anesthésiste réanimateur est obligatoire pour assurer la surveillance du patient et qu'il est responsable de la décision de mettre en œuvre d'un monitorage supplémentaire en fonction de la situation clinique.
Pour toute parturiente,
- Mesure automatique de la fréquence cardiaque et de la pression artérielle (PA)
- Pour le fœtus, celle du rythme cardiaque fœtal.
Moyens de surveillance plus importants que le minimum décrit si parturiente avec Atc ou clinique particulière.
Si analgésie obstétricale
- Un appareil de mesure automatique de la fréquence cardiaque et de la PA,
- un électrocardioscope
- un oxymètre de pouls (SpO2)
si mise en place d'un cathéter péridural, la surveillance des paramètres vitaux .
concernant l'appareil d'anesthésie :
- manomètre,
- volumètre, analyseur d'O2,
- capnographe,
- analyseur de vapeur anesthésique,
- alarme de pression haute ou d'obstruction,
- alarme d'arrêt du ventilateur.
MONITORAGE RESPIRATOIRE
Paramètres d'oxygénation
Oxymétrie de pouls
Ce moniteur est universellement utilisé et a bénéficié de la technologie Massimo, qui rend la mesure moins sensible aux mouvements et réduit l'incidence des fausses alarmes.
Limites et complications
Il existe de nombreuses limites de la mesure qui doivent être bien connues (tableau II).
L’oxymétrie de pouls Masimo SET a montré sa précision lors de mouvements ou en cas de faible perfusion.
Il permet la mesure non-invasive de la carboxyhémoglobine et de la méthémoglobine utilisant la CO-oxymétrie de pouls
| Anomalie | Mécanismes |
Causes possibles |
|---|---|---|
|
SpO2 non mesurée ou erronée |
Onde de pouls insuffisante |
Hypotension artérielle |
|
SpO2 erronée |
Artefacts de mesure |
Mouvements ou frissons |
|
Sous-estimation de la SaO2 |
Augmentation de la pression |
Position déclive du membre |
|
SpO2 erronée |
Signal insuffisant |
Anémie extrême (Ht < 10 %) |
|
Sous-estimation si SaO2 > 85 % |
Absorption par hémoglobine anormale |
Méthémoglobinémie |
|
Surestimation de la SaO2 |
Absorption modifiée |
Carboxyhémoglobine |
|
SpO2 erronée |
Colorants intraveineux |
Vernis à ongle ou ongles synthétiques, henné |
|
SpO2 absente ou erronée |
Modification de l'absorption |
Vernis à ongle ou ongles synthétiques, henné |
|
SpO2 ne reflétant pas la SaO2 |
Manque de précision |
Hypoxémie sévère (SaO2 < 80 %) |
Analyse de concentration des gaz en oxygène
La mesure de la fraction inspirée en O2 sur le circuit inspiratoire est une obligation permettant de détecter l'administration d'un mélange n'ayant pas la bonne composition en oxygène.
L'analyse de la fraction en O2 en fin d'expiration (FeO2) n'est pas obligatoire et n'est possible de manière fiable qu'avec certains capteurs rapides (paramagnétiques). Lorsque la FeO2 est 90 %, la quasi totalité de l'air alvéolaire a été remplacée par de l'oxygène.
Analyse de concentration des gaz en oxygène
Limites du monitorage de la FeO2
La FeO2 est un témoin fiable de la qualité de la préoxygénation, mais elle ne donne pas d'information directe sur la quantité des réserves d'oxygène. Cependant, l'élévation rapide de la FeO2 au cours de l'inhalation d'oxygène chez l'enfant, la femme enceinte ou chez le patient obèse ou ayant une maladie respiratoire restrictive traduit en général des réserves faibles, alors que chez l'emphysémateux, l'élévation de la FeO2 est plus lente.
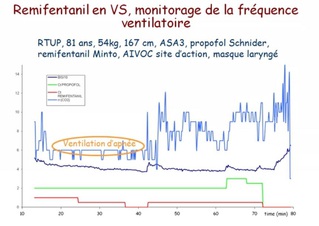
Paramètres de ventilation
Capnométrie
La mesure continue de la concentration en CO2 dans le gaz du circuit respiratoire se fait le plus souvent sur un échantillon de gaz aspiré en continu par le capnomètre.
Le débit d'aspiration (50 à 200 ml/min) doit être pris en compte en pédiatrie ou en cas de faible débit de gaz frais.
Intérêt et limites
l'absence de CO2 dans le gaz expiré permet la détection précoce de l'intubation œsophagienne.
Cette détection peut-être prise en défaut en cas de bronchospasme sévère, d'arrêt cardiaque ou de fuite dans le circuit.
A contrario, un capnogramme transitoire peut-être observé après intubation œsophagienne, l'estomac pouvant contenir du CO2 ;
la présence de CO2 dans le gaz inspiré est le témoin d'une réinhalation (chaux sodée saturée, faible débit de gaz frais ou valve défectueuse) ;
la concentration en CO2 du gaz en fin d'expiration (PetCO2) est un reflet, habituellement fidèle de la PaCO2, avec un gradient compris entre 3 et 5 mmHg.
Cependant, ce gradient n'est pas toujours prévisible (affections broncho-pulmonaires préexistantes) et peut varier en fonction de la situation clinique chez un même malade (modifications hémodynamiques, chirurgie thoracique, embolie).
La PetCO2 ne peut donc pas remplacer la mesure directe de la PaCO2 dans ces circonstances ou lorsque la PaCO2 doit être ajustée précisément (neurochirurgie).
une variation de la PetCO2 doit toujours être interprétée rapidement, car elle peut traduire :
- une variation de la ventilation alvéolaire ;
- une modification de la production de CO2, notamment en cas de variation de température ;
- une résorption de CO2 en cœliochirurgie ;
- une modification du débit cardiaque ;
- un phénomène embolique pulmonaire (quelle que soit la nature de l'embole) ;
la forme du capnogramme est également importante à considérer.
L'absence de plateau en fin d'expiration, remplacé par une pente expiratoire prolongée, témoigne d'une inhomogénéité des constantes de temps de vidange pulmonaire observé dans la BPCO et le bronchospasme.
Dans ce cas, l'expiration en cours est interrompue par l'insufflation suivante, et la PetCO2 sous-estime la PaCO2.
Paramètres ventilatoires
Mesure des pressions et volumes
Les pressions des voies aériennes et des volumes expirés (spirométrie ou débimétrie) sont monitorés en continu pour détecter des anomalies ventilatoires liées au ventilateur, au circuit, au patient (bronchospasme, pneumothorax, toux...) ou au mode de ventilation.
Le monitorage des courbes pression-volume permet de détecter les modifications de mécanique respiratoires, notamment celles liées aux variations de profondeur d'anesthésie.
Courbe débit-volume et trapping gazeux
Le trapping gazeux en fin d'expiration est lié à une réduction du flux expiratoire, observé dans le bronchospasme ou les pathologies bronchiques chroniques, notamment l'emphysème.
Sa détection est importante, notamment en cas de ventilation unipulmonaire, car il s'accompagne d'une pression positive en fin d'expiration (auto-PEP ou PEP intrinsèque) et peut avoir un retentissement hémodynamique majeur, liée à la gène au retour veineux et à l'interaction entre ventricules.
Il est important de noter que cette PEP intrinsèque n'est pas détectée par le monitorage habituel de la pression dans les voies aériennes supérieures, car celle-ci ne reflète pas dans ce cas la pression intra-alvéolaire.
Sa mesure directe est impossible sur la plupart des respirateurs d'anesthésie, munis d'une valve APL (Adjustable pressure-limiting valve, permet au gaz en excès dans le circuit de s'échapper quand sa pression dépasse une valeur réglable, appelée pression d'ouverture. Elle assure donc un contrôle de la pression régnant à l'intérieur du circuit d'anesthésie.) générant une pression positive en fin d'expiration.
En revanche, elle peut être détectée manière indirecte par un débit expiratoire non nul (et anormal) en fin de l'expiration sur un monitorage de la courbe débit-volume.
MONITORAGE CARDIO-VASCULAIRE
Rythme cardiaque
L'électrocardioscope inscrit sur un écran le tracé ECG dans 1 ou 2 dérivations et permet l'analyse par l'observateur du rythme cardiaque.
Le calcul de la fréquence ventriculaire est automatique, avec une alarme d'asystolie, certains scopes permettant également une détection des arythmies.
Limites du monitorage
Les causes les plus fréquentes d'artefacts sont les interférences électriques, les mouvements du patient ou des câbles et la déconnexion partielle du circuit.
Ces artefacts peuvent mimer de véritables arythmies, et entraîner des traitements inappropriés [5].
En cas de trouble du rythme, l'obtention d'un ECG 12 dérivations sur papier est indispensable.
Ischémie myocardique
Elle est au mieux détectée en peropératoire par le monitorage continu et automatisé du décalage du segment ST par rapport à la ligne isoélectrique.
Ceci suppose un signal ECG numérisé et un scope à 5 branches pour permettre le monitorage de dérivations standard (DII ou DIII) et précordiales.
Dans le territoire précordial, les dérivations V3 et V4 sont les plus performantes pour le diagnostic d'ischémie ou d'infarctus du myocarde [6].
Le bon positionnement du point isoélectrique (espace PR) et du segment ST (60 à 80 ms après le point J) doit être vérifié.
Les anomalies du segment ST ne sont pas absolument spécifiques d'ischémie myocardique (changement de posture, hyperventilation, hyperkaliémie...).
Un bloc de branche gauche, une hypertrophie ventriculaire peuvent gêner l'analyse et un stimulateur cardiaque la rend impossible.
L'ETO permet de mettre en évidence des nouvelles anomalies de cinétique segmentaire, mais les contraintes d'utilisation en font plus un outil de diagnostic que de monitorage.
Pression artérielle
Pression artérielle non invasive
Les méthodes non invasives de mesure discontinue de la PA font désormais appel à une méthode oscillométrique automatisée.
Les mesures de la PA systolique et moyenne sont très précises, tant au niveau du bras que du mollet, sous réserve d'un brassard adapté (supérieur de 20 à 50 % à la largeur du membre).
En revanche, les mesures micro-oscillométriques (mesure continue au doigt) périopératoires ne sont pas fiables.
Limites du monitorage
Les limites sont les valeurs extrêmes, une PA imprenable étant habituellement le témoin d'une hypotension profonde.
Les complications sont très rares, liées à des mesures trop rapprochées.
Pression artérielle invasive
Une conférence d'experts de la Sfar a précisé les modalités et les indications de la surveillance de la PA par voie invasive, résumées dans le tableau III (www.sfar.org).
Limites et complications
Les principales limites sont liées au caractère invasif comportant des risques d'infection (asepsie chirurgicale) et de thrombose artérielle (0,2 %).
La prévention des thromboses passe par le choix d'un cathéter de diamètre adapté à l'artère et du site de ponction : les artères radiales (test d'Allen recommandé) et fémorales sont choisies préférentiellement, mais les artères axillaires et pédieuses sont utilisables, alors que le cathétérisme huméral est à proscrire.
La qualité de la mesure repose sur une calibration et un positionnement du capteur corrects et l'absence d'amortissement ou de résonance dans le circuit.
|
Bénéfice attendu du monitorage |
Indications |
|---|---|
|
Prélèvements sanguins itératifs |
Chirurgie prolongée (carcinologique), neurochirurgie |
|
Variations hémodynamiques brutales |
Chirurgie majeure, notamment hémorragique |
|
Contrôle précis de la PA indispensable |
Coronaropathies ou cardiopathies sévères |
|
Mesure non-invasive impossible |
Circulation extracorporelle |
|
Évaluation de la réponse |
Chirurgie exposant à des variations importantes de volémie |
Évaluation de la volémie et du débit cardiaque
Des renseignements peuvent être obtenus, le plus souvent de manière indirecte sur ces paramètres fondamentaux par les moniteurs décrits ci-dessous.
Il faut insister sur le fait que des approximations sont souvent nécessaires dans le processus de calcul et que chacun des paramètres mesurés ne donne qu'une information parcellaire sur la situation hémodynamique du patient.
La confrontation aux données cliniques et la réponse à la thérapeutique sont indispensables.
Variations respiratoire de la PA
Les variations de la PA lors de la ventilation contrôlée peut renseigner sur la précharge-dépendance du ventricule gauche (VG) et préjuger de l'augmentation du débit cardiaque (DC) en réponse à un remplissage vasculaire ou des effets hémodynamiques d'une PEP [7].
En effet, l'augmentation initiale de la pression intrathoracique lors de la phase inspiratoire se traduit par une augmentation systolique inspiratoire puis par une baisse de PA (down).
Lorsque le down est > à 5 mmHg, la probabilité que le remplissage vasculaire augmente le DC est élevée.
D'autre part, la pression pulsée (PP = PAS-PAD) varie de manière plus marquée au cours du cycle respiratoire en cas d'hypovolémie.
Un nouvel indice a été créé, le PP = (PPmax - PPmin)/[(PPmax + PPmin)/2]. Lorsqu'il est > à 13 %, une augmentation significative du DC en cas d'expansion volémique est très probable.
Limites du monitorage
La validation de ce paramètre dans toutes les situations cliniques n'est pas acquise.
D'autre part, pour l'interpréter correctement, la ventilation doit être constante, la fréquence cardiaque régulière et < 120 b/min et le thorax fermé.
Enfin, cette mesure reste fastidieuse, car il faut pouvoir « geler » une courbe de PA et utiliser la fonction de mesure de la PAPO ou disposer d'un enregistrement papier.
Pression veineuse centrale (PVC)
La PVC varie en fonction de facteurs périphériques (volémie, compliance veineuse, pressions intrathoraciques) et cardiaques (fonction ventriculaire droite, compliance des cavités droites, qualité de la valve tricuspide).
En l'absence de pathologie tricuspidienne, la PVC reflète la pression télédiastolique ventriculaire droite (PTDVD), elle-même reflet du volume télédiastolique du ventricule droit pour une compliance ventriculaire donnée
Limites et complications
Les principales complications sont celles du cathétérisme veineux central.
Bien que la PVC reste l'un des moyens très utilisés pour guider le remplissage vasculaire, ses limites dans cette indication sont importantes :
- la PVC est un médiocre témoin de la précharge-dépendance ventriculaire : il n'existe pas de valeur de PVC seuil permettant de prédire correctement une augmentation de DC en réponse à un remplissage vasculaire. Néanmoins, une réponse favorable au remplissage est probable en cas de valeur basse de PVC < 5 mmHg [8] ;
- aucune valeur de PVC ne peut donc représenter un objectif thérapeutique à atteindre ;
- l'augmentation de la PVC au cours du remplissage n'est pas un témoin de l'efficacité du remplissage vasculaire qui devra être jugée sur d'autres paramètres hémodynamiques ou cliniques (diurèse, signes d'hypoperfusion périphériques).
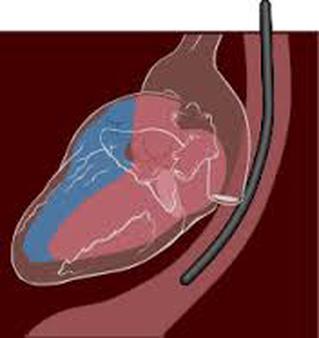
Cathétérisme cardiaque droit (Swan-Ganz)
Le cathéter de Swan-Ganz permet la mesure de :
- la POD, PAP et PAPO ;
- du DC de manière discontinue ou continue ;
- l'oxygénation du sang veineux mêlé (discontinue ou continue par infrarouges) ;
- pour certains capteurs, de la fraction d'éjection du VD.
Bien que ses indications aient fait l'objet de recommandations de la Sfar, l'utilisation de ce monitorage reste très variable, en raison de limites importantes.
Limites du monitorage
La PAPO est un mauvais reflet de la précharge ventriculaire gauche et il n'y a pas de valeur de PAPO qui témoigne de la précharge-dépendance ventriculaire [9]. Elle peut néanmoins permettre de fixer une limite supérieure acceptable de tolérance pulmonaire ;
le cathétérisme comporte un risque iatrogène réel ;
il existe de réelles difficultés d'interprétation des mesures obtenues, aboutissant à des défauts d'évaluation, voire à des attitudes thérapeutiques inappropriées [10] ;}
enfin, le bénéfice de ce monitorage sur la morbi-mortalité n'a pas été démontré, certaines études ayant même rapporté une surmortalité liée à son utilisation.
Doppler transœsophagien (DTO)
La sonde Doppler mesure la vélocité du flux sanguin dans l'aorte thoracique descendante, ce qui permet de calculer le DC moyennant l'acceptation de plusieurs approximations sur la valeur de la surface de l'aorte (mesurée par échographie 2D ou estimée), la répartition considérée stable du DC entre les troncs supra-aortiques (1/3) et l'aorte descendante (2/3), le profil sanguin harmonieux dans l'aorte et un centrage parfait du faisceau Doppler dans l'aorte.
D'autres paramètres (pic de vélocité, temps d'éjection corrigé, accélérométrie), renseignant sur la fonction cardiaque, peuvent être dérivés du signal Doppler.
Son intérêt réside dans son caractère non invasif et un apprentissage simplifié.
Limites et complications
En dépit de progrès technologiques ces 20 dernières années, la valeur absolue de DC calculée est imprécise.
C'est donc plus la variation du DC dans le temps ou sous l'effet d'une thérapeutique qui est intéressante.
Le monitorage continu n'est possible que chez 70 % des patients environ.
L'intérêt des autres paramètres dérivés est plus controversé mais pourraient participer à l'analyse de la situation hémodynamique d'un patient [11].
PiCCO (Pulse intermittent Contour Cardiac Output)
La mesure du débit cardiaque (DC) se fait de manière discontinue par thermodilution transcardiopulmonaire, et en continu par l'analyse du contour de la PA.
Il nécessite la pose d'une voie veineuse centrale et un cathéter artériel muni d'une thermistance, inséré par voie artérielle fémorale de préférence.
D'autre part, l'analyse de la courbe de thermodilution permet d'estimer certains volumes intrathoraciques, dont le volume télédiastolique global (VTDG), qui pourrait être un bon indicateur de précharge [8].
L'analyse du contour de la pression artérielle permet ensuite de déterminer le VES à chaque systole et de calculer le DC.
La variation de VES induite par la ventilation mécanique, est un indice dynamique de précharge permettant d'identifier correctement les patients susceptibles de bénéficier d'un remplissage vasculaire [8].
La mesure de l'eau pulmonaire extravasculaire (EPEV) est également possible, mais sa validité en pratique clinique reste à démontrer.
Bio-impédance thoracique
Le principe repose sur la variation d'impédance du thorax, traversé par un courant électrique alternatif en fonction de la quantité de sang qu'il contient et donc du DC.
L'intérêt principal réside dans son caractère non invasif (utilisation de 8 électrodes cutanées) et son innocuité.
La précision de la mesure a été montrée dans certaines circonstances cliniques [12].
Limites du monitorage
Les principales limites sont liées aux difficultés d'acquisition du signal (mouvements du patient, bistouri électrique, arythmie) et aux situations où la modélisation du système n'est pas validée (obésité, grossesse, épanchements pleuraux, œdème pulmonaire, etc.).
NICO (Non Invasive Cardiac Output)
La mesure du DC par le NICO repose sur le principe de Fick, adapté à l'analyse des variations de CO2 expiratoire, induite artificiellement par une réinhalation rapide et transitoire du gaz expiré [13].
Le moniteur calcule automatiquement la valeur de DC au terme du cycle de réinhalation.
L'intérêt principal de cette technique réside dans le caractère non invasif de la mesure du DC et de son caractère quasiment continu (une mesure toute les 3 minutes).
Échocardiographie transœsophagienne (ETO)
L'ETO est un outil à part car elle permet une analyse morphologique et fonctionnelle des structures cardiaques et des flux intracardiaques et/ou trans-valvulaires. Elle permet :
- d'évaluer les fonctions du VG et du VD et leur interaction ;
- de diagnostiquer une ischémie myocardique par l'analyse de la cinétique segmentaire du VG ;
- d'estimer le DC par effet Doppler ;
- de diagnostiquer une hypovolémie, par l'analyse des surfaces télédiastoliques (± télésystoliques) ;
- d'estimer la réponse au remplissage vasculaire ;
- de détecter les patients à risque d'embolie paradoxales ;
- de détecter les embolies.
Limites du monitorage
Les principales limites viennent de la disponibilité de l'appareil, et surtout d'un opérateur compétent.
La mise sur le marché d'appareil portables, moins onéreux, et l'implication des anesthésistes dans l'enseignement de l'échocardiographie (modules de DU spécifiques à la période opératoire) permet un accès plus facile à cet outil.
Cependant, en dehors de la chirurgie cardiaque, l'ETO doit être actuellement considérée plus comme un outil diagnostic des défaillances circulatoires, qu'un moyen de monitorage hémodynamique.
MONITORAGE DE LA PROFONDEUR D'ANESTHÉSIE
Indice bisp
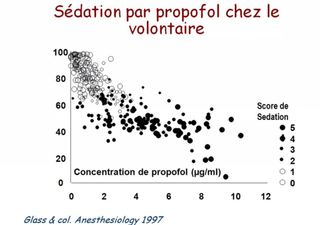
La variation interindividuelle de la réponse aux agents anesthésiques expose à un risque de surdosage, source d'hypotension, et de sous-dosage, qui expose à un risque de mémorisation, de mouvements et d'hypertension.
De nombreux paramètres ont été proposés pour juger du niveau d'anesthésie, parmi lesquels l'analyse des effets corticaux (EEG) de l'anesthésie parait intéressante.
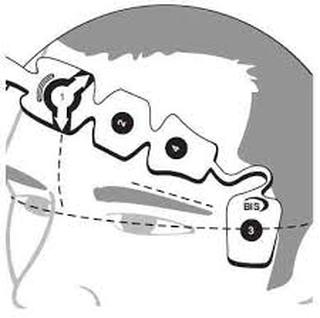
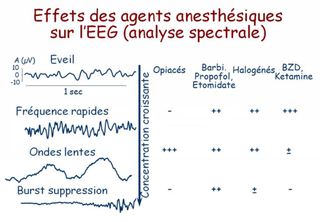
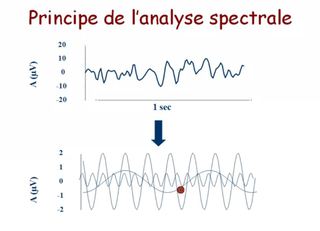
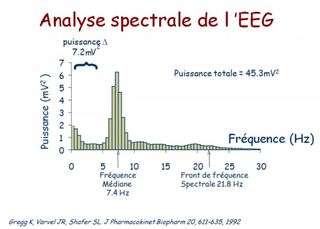
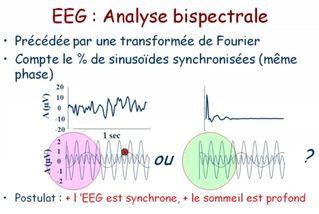
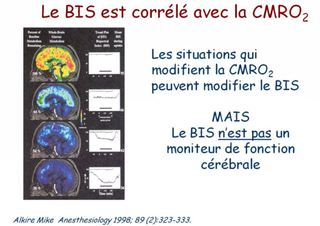
Le moyen de monitorage le plus utilisé est l'indice bispectral (BIS) qui analyse le spectre, la synchronisation (analyse bispectrale) et de la proportion de « burst suppressions » des signaux EEG.
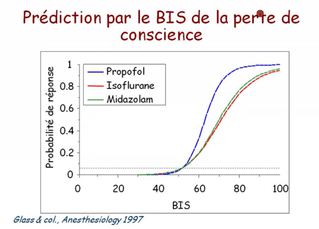
Le BIS reflète avant tout la composante hypnotique de l'anesthésie, et est exprimé sous la forme d'un indice chiffré, sans dimension, compris entre 100 (éveil normal) et 0 (silence électrique cortical).
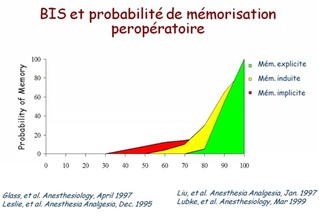
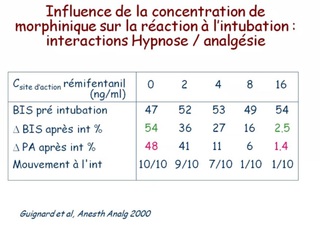
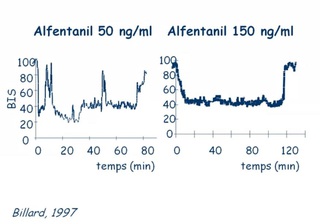
Entre ces valeurs extrêmes, le BIS diminue (de manière non linéaire) lorsque la concentration en agent anesthésique augmente, ce qui a permis de déterminer que un BIS < à 60 correspondait à un état anesthésique probable (risque faible de mémorisation) qu'une valeur < 40 correspondait à un surdosage.
Limites du monitorage
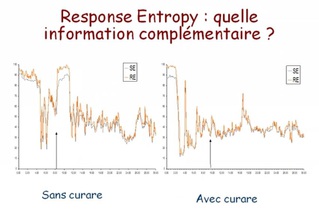
il existe un délai d'intégration et de calcul entre le recueil du signal et l'affichage de l'indice, et les signes d'éveil peuvent donc précéder l'augmentation du BIS ;
les effets du N2O (et de la kétamine) sont mal pris en compte par le BIS ;
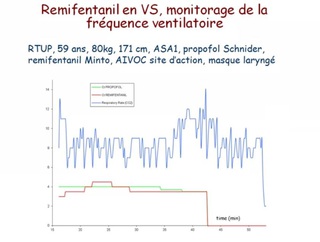
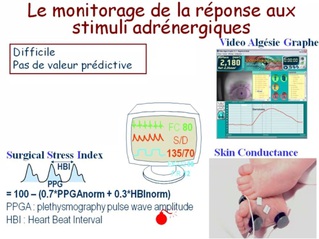
les morphiniques à faible dose ou administrés dans une anesthésie balancée, modifient peu la valeur de BIS, alors qu'ils contribuent largement à l'absence de réaction lors d'une stimulation nociceptive. Ceci explique qu'aucune valeur de BIS n'est prédictive d'un mouvement ou d'un éveil en réponse à une stimulation nociceptive ;
un lissage des valeurs de BIS sur 15 secondes expose à une variabilité instantanée importante du BIS, qui peut être réduite par un lissage sur 30 secondes ;
le BIS est peu prédictif du délai de réveil d'un patient [14] ;
le BIS peut être artéfacté par de nombreux autres signaux (bistouri, réchauffeurs à air, pompes de circulation extracorporelle). Le signal électromyographique (désormais affiché sur le moniteur) peut augmenter le BIS en l'absence de réveil
Indications du BIS
Le premier objectif du BIS est d'éviter la mémorisation explicite, dont l'incidence varie de 0,15 % à 0,6 %, chez les patients à risque [15].
Cependant, son utilisation systématique dans cette seule indication présenterait un rapport coût/bénéfice exorbitant, et il doit être réservé aux patients pouvant présenter un niveau de PA basse, dissocié du niveau d'anesthésie (interventions avec variations de volémie marquées, chirurgie cardiaque, certains polytraumatisés et les patients ayant une dysautonomie neurovégétative).
Le second objectif du monitorage du BIS est d'éviter un surdosage anesthésique, notamment chez les patients ayant une marge thérapeutique étroite (patients âgés) [16]. Il a été montré sur un collectif de 1 064 patients, que le temps cumulé d'anesthésie profonde était un facteur de risque indépendant de mortalité (odds ratio [IC 95 %] par heure de BIS < à 45 = 1,2 [1,1-1,4]). Cet impact de l'anesthésie trop profonde est faible, mais il s'agit pour une fois d'un facteur sur lequel il est possible d'intervenir. D'autres études devront suivre pour confirmer le rôle pronostic du BIS.
Enfin, le BIS pourrait permettre de guider l'anesthésie chez les patients ayant une élévation de PA, non liée à une anesthésie insuffisante (phéochromocytome, clampage aortique).
AUTRES MONITORAGES
Monitorage de la curarisation
Il est utile pour l'intubation trachéale, pour adapter la curarisation aux contraintes chirurgicales et pour évaluer la curarisation résiduelle et indiquer la réversion pharmacologique.
Les indications sont larges, surtout en cas de réinjection ou perfusion continue de curare ou d'hypothermie [17].
Limites du monitorage
La surveillance qualitative qui consiste à compter le nombre de réponse au train de 4, ne permet pas d'évaluer avec précision la curarisation partielle. Il est nécessaire de mesurer le rapport T4/T1 en utilisant un accéléromètre ou un mécanomyomètre.
Ce monitorage a pour objectif principal la détection précoce d'une complication cérébrale (bas débit...) ou médullaire, en neurochirurgie, chirurgie du rachis, de la carotide, cardiaque ou de l'aorte thoracique.
Monitorage neurologique
Les paramètres accessibles au monitorage, sont :
- neurophysiologiques par l'EEG et les potentiels évoqués ;
- d'oxygénation cérébrale par la SvjO2, PtiO2, microdialyse cérébrale, oxymétrie cérébrale par spectrométrie infrarouge ;
- de débit sanguin cérébral par Doppler transcrânien et laser Doppler ;
- de pression intracrânienne, par capteur intraparenchymateux.
La description de l'intérêt et limites de ces moniteurs dépasse le cadre de cet exposé. Cependant, il n'y a pour l'instant pas de bénéfice clairement démontré à leur utilisation, notamment en chirurgie de la carotide
Monitorage de la température
L'hypothermie involontaire est responsable d'une morbidité importante, liée aux interactions avec le métabolisme des anesthésiques, au frisson et aux troubles de l'hémostase.
Elle favorise l'ischémie myocardique [18].
Ce monitorage s'est largement répandu avec du matériel à usage unique pour des sites de mesure fiables œsophagiens et vésicaux.
Monitorage biologique
La surveillance de la glycémie et de l'hémoglobine au bloc opératoire est possible à l'aide de moniteurs portables fiables et peu coûteux.
La démonstration de l'intérêt de ces mesures très simples sur la morbidité périopératoire est en cours, et ces moniteurs ne posent pas d'autres problèmes que de penser à les utiliser [1].
CHOIX DU MONITORAGE
La mise en place du monitorage obligatoire, défini par la loi ne pose pas de problème particulier.
La principale difficulté est de sélectionner les mesures pertinentes pour la situation clinique, liées au terrain du patient, au type d'anesthésie, à la nature de la chirurgie, et/ou à l'environnement dans lequel l'acte prend place.
Principes généraux de choix du monitorage
on demande au monitorage de détecter un événement indésirable de manière plus sensible et spécifique que la clinique et/ou de permette son interprétation afin de guider la thérapeutique.
La grande diversité des paramètres qui peuvent être mesurés peut poser un problème aux équipes d'anesthésie.
- Invasif
- Trop d’information
- Source de distraction
Monitorage dans la chirurgie à risque, en fonction du terrain
Tableau IV. Proposition de monitorage en fonction de la nature de la chirurgie et du terrain du patient. Le monitorage vient en complément d'un monitorage standard comprenant :
- électrocardioscope, SpO2, pression artérielle non invasive,
- analyse des gaz, des pressions et des débits de ventilation en cas d'anesthésie générale
- monitorage de la curarisation en cas d'administration de curares.
| ASA I-II |
HTA sévère |
Insuffisance |
Insuffisance |
Insuffisance |
Sujet âgé |
|
|---|---|---|---|---|---|---|
|
Chirurgie ou acte à faible risque |
Standard | Standard |
Standard |
Standard | Standard | Standard |
|
Chirurgie à risque intermédiaire |
Température |
PA invasive |
PA invasive Segment ST Température Débit urinaire 1 Hémoglobine |
PA invasive |
PA invasive |
PA invasive Segment ST Température Débit urinaire 1 Volémie 4 Hémoglobine 2 Anesthésie |
|
Chirurgie à risque |
PA invasive |
PA invasive |
PA invasive |
PA invasive |
PA invasive |
PA invasive |
|
Chirurgie carotidienne |
(Situation rare) |
PA invasive |
PA invasive |
PA invasive |
PA invasive |
PA invasive |
|
Chirurgie du phéochromocytome |
Non applicable |
PA invasive |
PA invasive |
PA invasive |
PA invasive |
PA invasive |
|
Chirurgie à risque d'embolie gazeuse |
PA invasive KT central (Doppler, ETO |
PA invasive KT central (Doppler, ETO |
PA invasive |
PA invasive KT central (Doppler, ETO |
PA invasive KT central (Doppler, ETO |
PA invasive KT central (Doppler, ETO |
Monitorage en dehors du bloc opératoire
Le monitorage doit tenir compte des contraintes environnementales et organisationnelles de ces salles d'intervention, d'un accès au malade le plus souvent limité et de l'isolement par rapport aux blocs centraux.
Le matériel de monitorage doit être adapté aux mouvements parfois importants de la table et/ou de l'opérateur.
Un répétiteur d'écran peut-être utile en autorisant la surveillance et/ou le réglage des paramètres et des alarmes sans interruption de l'examen, ni exposition prolongée aux radiations ionisantes. Certaines de ces procédures peuvent être lourdes et prolongées (gestes endovasculaires) et justifient la surveillance de la température centrale du patient, de la PA invasive, et la détection de l'ischémie myocardique.
Monitorage en IRM
L'IRM peut perturber le fonctionnement des moniteurs, les détériorer ou induire des lésions au patient et transformer tout objet ferromagnétique en projectile [21]. Ce phénomène s'est acutisé avec les nouvelles IRM 3 Tesla, et il faut garder en mémoire qu'il n'est pas possible d'interrompre rapidement le champ magnétique.
Le monitorage ne peut donc s'envisager qu'avec du matériel compatible, en respectant des précautions suivantes :
- positionner le patient de façon à qu'il ne touche pas l'aimant ;
- utiliser un filtrage basse fréquence sur le scope, placer les électrodes au centre du champ magnétique avec une distance interélectrodes faible ;
- interposer si possible des éléments non conducteurs entre la peau du patient et les câbles, éviter les boucles de conduction et effectuer un tressage des câbles ;
- vérifier l'absence de métal ferromagnétique dans l'enceinte de l'IRM, parfois présent en très petite quantité, mais pouvant être transformé en projectile par les IRM 3 Tesla ;
- éloigner le capteur de SpO2 et éviter les boucles sur le cable (fibres optiques).
RÉFÉRENCES
- Lienhart A, Auroy Y, Pequignot F, et al. Premières leçons de l'enquête « mortalité » Sfar-Inserm. In : Sfar, Ed. 45e Congrès national d'anesthésie et de réanimation. Paris : Elsevier ; 2003. p. 203-18.
- Ministère des affaires sociales de la santé et de la ville. Décret no 94-1050 du 5 décembre 1994 relatif aux conditions techniques de fonctionnement des établissements de santé en ce qui concerne la pratique de l'anesthésie et modifiant le code de la santé publique. Journal Officiel de la République Française du 8 décembre 1994.
- Hatton F, Tiret L, Maujol L, et al. INSERM. Enquête épidémiologique sur les anesthésies. Premiers résultats. Ann Fr Anesth Réanim 1983 ; 2 : 331-86.
- Caplan RA, Posner KL, Ward RJ, et al. Adverse respiratory events in anesthesia: a closed claims analysis. Anesthesiology 1990 ; 72 : 828-33.
- Knight BP, Pelosi F, Michaud GF, et al. Clinical consequences of electrocardiographic artifact mimicking ventricular tachycardia. N Engl J Med 1999 ; 341 : 1270-4.
- Landesberg G, Mosseri M, Wolf Y, et al. Perioperative myocardial ischemia and infarction: identification by continuous 12-lead electrocardiogram with online ST-segment monitoring. Anesthesiology 2002 ; 96 : 264-70.
- Tavernier B, Makhotine O, Lebuffe G, et al. Systolic pressure variation as a guide to fluid therapy in patients with sepsis-induced hypotension. Anesthesiology 1998 ; 89 : 1313-21.
- Teboul JL. Recommandations d'experts de la SRLF : Indicateurs du remplissage vasculaire au cours de l'insuffisance circulatoire. Réanimation 2004 ; 13 : 255-63.
- Tousignant CP, Walsh F, Mazer CD. The use of transesophageal echocardiography for preload assessment in critically ill patients. Anesth Analg 2000 ; 90 : 351-5.
- Squara P, Bennett D, Perret C. Pulmonary artery catheter: does the problem lie in the users? Chest 2002 ; 121 : 2009-15.
- Perrino AC, Jr., Fleming J, LaMantia KR. Transesophageal Doppler ultrasonography: evidence for improved cardiac output monitoring. Anesth Analg 1990 ; 71 : 651-7.
- Sageman WS, Riffenburgh RH, Spiess BD. Equivalence of bioimpedance and thermodilution in measuring cardiac index after cardiac surgery. J Cardiothorac Vasc Anesth 2002 ; 16 : 8-14.
- Berton C, Cholley B. Equipment review: new techniques for cardiac output measurement - oesophageal Doppler, Fick principle using carbon dioxide, and pulse contour analysis. Crit Care 2002 ; 6 : 216-21.
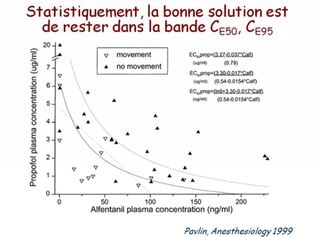
- Pavlin JD, Souter KJ, Hong JY, et al. Effects of bispectral index monitoring on recovery from surgical anesthesia in 1,580 inpatients from an academic medical center. Anesthesiology 2005 ; 102 : 566-73.
- Myles PS, Leslie K, McNeil J, et al. Bispectral index monitoring to prevent awareness during anaesthesia: the B-Aware randomised controlled trial. Lancet 2004 ; 363 : 1757-63.
- Monk TG, Saini V, Weldon BC, Sigl JC. Anesthetic management and one-year mortality after noncardiac surgery. Anesth Analg 2005 ; 100 : 4-10.
- Debaene B, Plaud B, Dilly MP, et al. Residual paralysis in the PACU after a single intubating dose of nondepolarizing muscle relaxant with an intermediate duration of action. Anesthesiology 2003 ; 98 : 1042-8.
- Sessler DI. Mild perioperative hypothermia. N Engl J Med 1997 ; 336 : 1730-7.
- Eagle KA, Berger PB, Calkins H, et al. ACC/AHA Guideline Update for Perioperative Cardiovascular Evaluation for Noncardiac Surgery - Executive Summary. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Update the 1996 Guidelines on Perioperative Cardiovascular Évaluation for Noncardiac Surgery). Anesth Analg 2002 ; 94 : 1052-64.
- Sandham JD, Hull RD, Brant RF, et al. A randomized, controlled trial of the use of pulmonary-artery catheters in high-risk surgical patients. N Engl J Med 2003 ; 348 : 5-14.
- Bashein G, Syrory G. Burns associated with pulse oximetry during magnetic resonance imaging. Anesthesiology 1991 ; 75 : 382-3.
Date de dernière mise à jour : 03/03/2020
Ajouter un commentaire