CIRRHOSE ET INSUFFISANCE HÉPATIQUE
La cirrhose est une étape tardive de la fibrose hépatique qui a entraîné une distorsion diffuse de l'architecture hépatique.
La cirrhose est caractérisée par des nodules de régénération entourés par un tissu fibreux dense.
Les symptômes peuvent être absents pendant des années et sont souvent non spécifiques (p. ex., l'anorexie, la fatigue et la perte de poids).
Les manifestations tardives sont l'hypertension portale, l'ascite et, lorsque la décompensation se produit, une insuffisance hépatique sévère. Le diagnostic nécessite souvent une biopsie hépatique. La cirrhose est habituellement considérée comme étant irréversible. Le traitement est un traitement de support.
Relation entre Insuffisance hépatique aigue et cirrhose
- L’insuffisance hépatique aiguë est un syndrome résultant d'une altération massive et brutale des fonctions hépatiques chez des patients indemnes d’hépatopathie préalablement connue.
- Il s'agit donc d'une pathologie rare par opposition aux décompensations aiguës survenant dans un contexte de cirrhose (notion de chronicité).
- L’insuffisance hépatique aiguë est qualifiée de fulminante quand elle s’associe à une encéphalopathie hépatique.
ÉVALUATION DE LA SÉVÉRITÉ DE LA MALADIE HÉPATIQUE
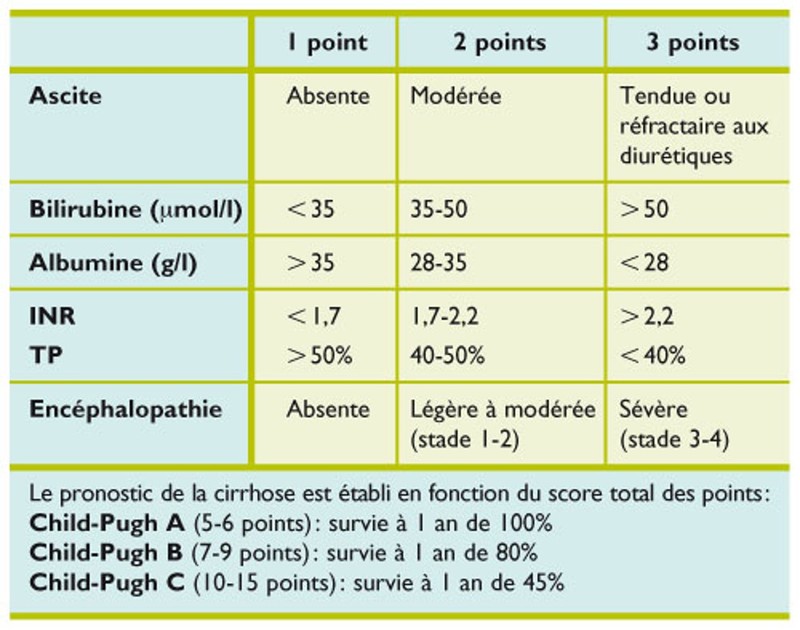
•Le score de Child-Pugh est un score largement validé et simple d’utilisation. Bien que comprenant deux variables subjectives, c’est un score souvent utilisé pour prédire la survie des patients cirrhotiques.
•Le MELD (Model for end stage liver disease) est un score pronostique plus objectif, qui nécessite toutefois un logiciel de calcul. Il s’est imposé pour déterminer l’ordre de priorité pour la transplantation hépatique.
•Le score de Maddrey permet d’identifier les formes sévères d’hépatite alcoolique, pouvant bénéficier d’une corticothérapie pour réduire la mortalité à court terme.
RAPPELS PHYSIOPATHOLOGIQUES
Définitions
L’insuffisance hépatocellulaire désigne l’ensemble des manifestations cliniques et biologiques en rapport avec une ↘ des fonctions hépatocytaires.
= ↘ de la fonction synthèse + ↘ de la fonction épuration des hépatocytes + altération de leurs excrétion biliaire.
- Il existe 2 ingrédients primaires:
- Fibrose hépatique
- Cellules du foie en cours de régénération
- En réponse à une lésion, les facteurs de croissance induisent une hyperplasie hépatocellulaire (à l'origine des nodules de régénération) et une angiogenèse artérielle.
- Les régulateurs de croissance comprennent les cytokines et les facteurs de croissance hépatiques.
- L' insuline, le glucagon et les variations du flux sanguin intrahépatique sont également responsables du mode de développement et de la localisation des nodules
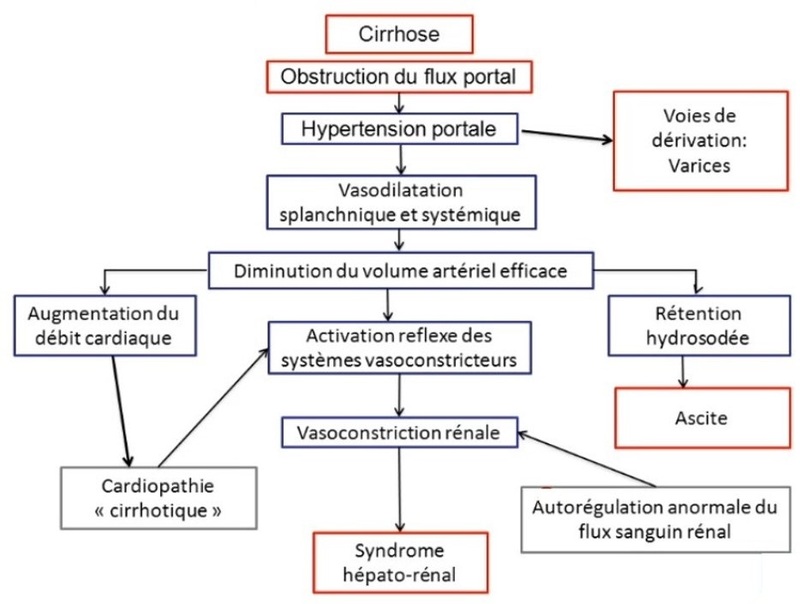
De nouveaux vaisseaux se forment par angiogenèse dans la fibrose entourant les nodules.
Ces vaisseaux relient l'artère hépatique et la veine porte aux veinules sus-hépatiques, restaurant ainsi l'hémodynamique intrahépatique. De tels vaisseaux d'interconnexion assurent un drainage veineux de volume relativement faible et à pression relativement élevée, qui ne peut assurer un débit suffisant. Il en résulte une augmentation des pressions veineuses portales. De telles distorsions dans les flux sanguins contribuent à l'hypertension portale, qui augmente parce que les nodules de régénération compriment les veinules hépatiques.
RÉPERCUSSIONS DE L'INSUFFISANCE HÉPATOCELLULAIRE
Répercussions cardiovasculaires
« Hypercinésie » circulatoire associant :
- une vasodilatation systémique et surtout splanchnique ;
- une ↘ de la pression artérielle ;
- et une ↗ du débit cardiaque.
Forte séquestration sanguine splanchnique (« pooling ») et ↗ de la compliance vasculaire systémique.
Tendance à l’hypovolémie sévère en cas de cirrhose décompensée avec ↗ de la différence artérioveineuse en oxygène et de la lactatémie, associées à une ↘ de la consommation d’O2.
Évolution vers une dilatation des cavités cardiaques par cardiomyopathie de causes multiples : rechercher systématiquement une atteinte cardiaque en préopératoire.
Répercussions pulmonaires
1.Syndrome hépatopulmonaire:
- caractérisé par la coexistence
- d’une hypertension portale,
- d’un élargissement du gradient alvéolo-artériel (différence entre la pression partielle de l'oxygène alvéolaire et celle de l'oxygène artériel)
- de dilatations vasculaires pulmonaires.
- shunts anatomiques vrais, artérioveineux ou portopulmonaires, qui sont responsables d’hypoxémie réfractaire.
Le seul traitement= transplantation hépatique.
2.L’hypertension artérielle pulmonaire (HTAP):
- 2% des malades
- Diagnostic (souvent tardif)= pression artérielle pulmonaire moyenne ≥ 25 mm Hg, + pression pulmonaire capillaire < 13 mm Hg.
Réponse à l'HTP
3.Phénomènes de restriction mécanique à la respiration
L’ascite abondante ou les épanchements pleuraux (10%) gênent la mécanique ventilatoire et les échanges gazeux.
4.Modifications du rapport ventilation/perfusion (Rares)
Entraînent une hypoxémie qui pourra être corrigée par l’oxygénothérapie.
5.Déviation vers la droite de la courbe de dissociation de l’oxyhémoglobine
Souvent BPCO par tabagisme qui aggrave ces anomalies
Répercussions rénales et métaboliques
1.Rétention hydrosodée
L’insuffisance rénale complique fréquemment la cirrhose, même modérée
2.Syndrome hépatorénal
Lésion rénale aiguë en l'absence de lésions structurelles du rein (de type fonctionnel) ; elle est réfractaire au remplissage et s’associe à ...
- une hypotension artérielle,
- une encéphalopathie hépatique,
- une hypercréatinémie,
- une hyponatrémie
- et une oligurie avec natriurèse basse
⇒ mortalité de 90 à 100 %
Répercussions hématologiques
- L’IHC et/ou l’HTTP =
- troubles de l’hémostase primaire,
- de la coagulation
- et de la fibrinolyse
- une ↘ de la plupart des facteurs de coagulation
- une thrombopénie par hypersplénisme ou par défaut de production médullaire, retrouvée dans 30 à 80 % des cas ;
- une thrombopathie avec allongement du temps de saignement en cas d’IHC sévère ;
- une susceptibilité au développement d’une coagulation intravasculaire disséminée (CIVD) en cas de complication infectieuse ou d’insuffisance circulatoire ;
- une tendance à l’accélération de la fibrinolyse ;
- une ↗ de l’activateur tissulaire du plasminogène
- une ↘ de l’activité de l’inhibiteur spécifique rapide du t-PA (PAI-1) synthétisé par le foie. Cette ↘ est d’autant plus importante que l’IHC est sévère.
Répercussions nutritionnelles et infectieuses
- Dénutrition
- La malnutrition protidique
- Infections
Autres atteintes
- Troubles neuropsychiques dans le cadre de l’encéphalopathie hépatique classé en 4 stades
- Ascite : en rapport direct avec l’IHC. L’HTP est une condition nécessaire, mais non suffisante, à son développement.
- L’anémie
- L’hypoalbuminémie
- L’ictère à bilirubine conjuguée
- Des troubles gastro-intestinaux
PHASE PRÉ ANESTHÉSIQUE
Consultation préanesthésique
2 Objectifs:
- Évaluer le risque opératoire
- Optimiser la préparation du patient afin de prévenir les complications postopératoires.
Risque opératoire
Dépend de trois éléments :
- La sévérité de l’IHC,
- Ses répercussions extra hépatiques
- Le type d’intervention chirurgicale.
Bilan, préparation du patient
1. Bilan hépatique
- un bilan de coagulation : au minimum TP, TCA, numération des plaquettes
- le dosage des transaminases
- le dosage de la bilirubine, des γ-GT, des phosphatases alcalines et 5’nucléotidiques
- une fibroscopie digestive haute
2. Bilan cardiorespiratoire
- ECG,
- radiographie pulmonaire
- gazométrie artérielle
Si cardiopathie présente ou patente: échocardiographie et/ou une épreuve d’effort
Si BPCO : exploration fonctionnelle respiratoire
3. Bilans rénal, métabolique et nutritionnel
- Le bilan rénal comportera un ionogramme sanguin et urinaire
- L’évaluation de la fonction rénale se fait par le dosage de la créatinine plasmatique et urinaire et le ionogramme urinaire
- L’état nutritionnel est principalement évalué sur la concentration plasmatique d’albumine et de globuline
4. Bilan hématologique
- NFS
- Si hyperleucocytose : hémocultures,
Contre-indications à la chirurgie chez le cirrhotique
À l’exclusion de l’urgence :
- l’hépatite aiguë ;
- l’hépatite chronique en décompensation aiguë ;
- la persistance des troubles de coagulation majeurs (TP < 50 %) malgré un traitement adapté par vitamine K ;
- l’appartenance à la classe C de Child-Pugh.
PHASE PER ANESTHÉSIQUE
Choix de l’anesthésie
Adapté à l’acte opératoire.
- l’ALR est bien souvent contre-indiquée, à cause des troubles de la coagulation consécutifs à la cirrhose.
⇒ AG ++++
⇒ agents anesthésiques qui n’induisent pas une ↘ du débit hépatique →anoxie ou hypoxie hépatocytaire
⇒ bon profil cinétique (métabolisme et durée d’action)
Prémédication
- Pas recommandé dans le cas des cirrhose sévère (grades B et C de Child-Pugh)
- Si une prémédication est jugée utile, faire attention au métabolisme (Benzo+++), biotransformations de phase II (notamment glucoronoconjugaison) sont en général plus tardives que les biotransformations de phase I.
- À éviter chez patients sujets à des épisodes d’encéphalopathie.
Induction anesthésique
- Une séquence d’induction rapide et intubation trachéale est conseillée en cas d’ascite volumineuse ou de procédure endoscopique en situation d’hémorragie digestive haute.
Choix des agents anesthésiques
Les résultats des études portant sur la pharmacocinétique des agents anesthésiques chez les patients ayant une IHC , sont discordants, voire contradictoires, dû au fait que les patients étudiés n’ont pas toujours le même degré d’atteinte hépatique et que la plupart des cirrhotiques ne sont pas opérés à un stade ultime de leur maladie.
1. Barbituriques.
- Modifications pharmacodynamiques de tous les barbituriques avec amplification des effets. Ceci est dû à l’augmentation de la fraction libre plasmatique, mais aussi à une sensibilité accrue du système nerveux central
- Quel que soit le barbiturique, il est fortement conseillé de diminuer les doses initiales et d’apprécier la susceptibilité clinique individuelle de chaque patient.
2. Benzodiazépines
- ↗ de la ½ t, et du ↗ VD, ↗ la fraction libre + élimination retardé
- Diminuer les doses de deux à trois fois et leur rythme d’administration
- L’utilisation des benzodiazépines en pratique courante ne semble donc pas recommandée chez le patient cirrhotique
3. Propofol et étomidate
- La cirrhose modérée n’entraîne pas de modification pharmacocinétique significative du propofol, que celui-ci soit administré en injection unique ou en perfusion continue
- Chez le cirrhotique, l’étomidate en perfusion continue est contre-indiqué car sa clairance hépatique diminue et sa demi-vie d’élimination augmente considérablement
4. Morphiniques
- Si cirrhose compensée: pharmacocinétique inchangé pour fentanyl et Sufentanil, mais hypersensibilité du SNC par augmentation de la liaison aux récepteurs opioïdes.
- Rémifentanil : hydrolyse par des estérases plasmatiques et tissulaires => pharmacocinétique non modifiée
- Si cirrhose décompensée → prolongement de la ½ t des morphiniques => espacer les intervalles de réinjections de 1,5 à 2 fois.
- Alfentanil: ↗ de la ½ t par ↘ de la clairance hépatique intrinsèque et du débit hépatique, mais aussi ↗ importante de la fraction libre ⇒ EFFETS PROLONGES ⇒ ADAPTATION POSOLOGIQUE
5. Curares
- Succinylcholine : métabolisme peu perturbé par la cirrhose
- Pancuronium: si cirrhose, allongement de sa ½ t de 50 % et ↗ son volume de distribution (Vd) => phénomène de résistance.
- Atracurium : il constitue le curare de choix pour le patient cirrhotique car il n’est pas métabolisé par le foie, mais par la voie d’Hoffman et les pseudocholinestérases plasmatiques. La même remarque s’applique à son isomère, le cisatracurium.
- Rocuronium : la durée d’action du rocuronium au cours de la cirrhose est prolongée du fait d’un allongement de plus de 50 % de sa ½ t et d’une augmentation de son Vd.
- Mivacurium : le mivacurium est dégradé par la pseudocholinestérase plasmatique. L’activité de cette enzyme est diminuée chez les cirrhotiques, ce qui explique que la durée d’action du mivacurium soit prolongée chez ces patients .
6. Halogénés
- ces agents peuvent induire une toxicité hépatique par deux mécanismes :
- indirect, par anoxie tissulaire en diminuant le débit et l’oxygénation hépatiques ;
- direct, par toxicité propre de certains métabolites
⇒ HÉPATOTOXICITÉ
Monitorage
- Monitorage des interventions mineures
- électrocardioscope ;
- pression artérielle non sanglante ;
- oxymètre de pouls : SaO2 ;
- capnographe : FECO2.
- Monitorage des interventions majeures
- pression artérielle sanglante ;
- pression veineuse centrale ± pression capillaire pulmonaire (Swan-Ganz) ;
- température ;
- diurèse horaire ;
- système de perfusion rapide avec au moins un gros cathéter périphérique ou un désilet brachial ou fémoral ;
- moniteur de la curarisation.
- Surveillance biologique pour les interventions majeures
- ionogramme sanguin : K, Ca ;
- gaz du sang ;
- hémoglobine, hématocrite ;
- numération des plaquettes ;
- TP, TCA, ± fibrine, PDF, facteurs de coagulation.
Préservation du débit sanguin hépatique (DSH)
Le principal déterminant est l’acte chirurgical lui-même, cependant, d’autres facteurs de réduction de DSH sont contrôlables par l’anesthésiste :
- Contrôle hémodynamique : prévention de toute chute du débit cardiaque et de toute hypotension artérielle;
- Paramètres de ventilation : le DSH diminue sous l’effet de la ventilation en P° +, surtout si en plus associé à une PEP;
- Contrôle de l’hémostase
PHASE POSTOPÉRATOIRE
Les complications postopératoires pouvant survenir chez l’IHC sont nombreuses et graves
1- Infections: l’incidence des complications septiques est de 46%, dues, en majorité, à des bactéries à Gram négatif d’origine le plus souvent digestive endogène.
2- Décompensation ascitique postopératoire: Son traitement fait appel aux diurétiques (spironolactones, diurétiques de l’anse) et à la ponction d’ascite évacuatrice avec éventuellement compensation des pertes
- Causes de la décompensation ascitique postopératoire
- Cardiovasculaires
- diminution du retour veineux par compression de la VCI ;
- compression du ventricule droit par ascension diaphragmatique ;
- augmentation de la postcharge ;
- réduction des débits splanchniques.
- Rénales
- réduction du débit sanguin rénal ;
- réduction de la filtration glomérulaire.
- Pulmonaires
- augmentations des pressions intrathoraciques ;
- diminution des volumes pulmonaires ;
- diminution de la compliance totale ;
- ventilation des zones proclives.
- Autres
- augmentation de la pression portale ;
- anorexie ;
- hernies ombilicales et inguinales.
3. Hémorragies
- le risque hémorragique est particulièrement élevé chez l’IHC où se trouvent associées :
- des perturbations de l’hémostase ;
- des affections chirurgicales susceptibles de saigner
- La rupture de varices œsophagiennes représente la cause de mort de la moitié des cirrhotiques
4. Thérapeutiques médicamenteuses de la rupture de varices œsophagiennes
- La vasopressine réduit la pression portale par vasoconstriction splanchnique
- somatostatine agit par réduction du flux portal
5. Syndrome hépatorénal
- Ce syndrome associe oligurie et réduction de la natriurèse. Son traitement est limité :
- correction de l’hypovolémie ;
- emploi de dopamine à faibles doses ;
- traitement étiologique par anastomose portocave et transplantation hépatique.
- Le pronostic de cette complication est défavorable dans la majorité des cas.
6. Troubles de la conscience : encéphalopathie hépatique
- les facteurs déclenchants sont nombreux :
- hémorragie digestive,
- déshydratation,
- agents sédatifs,
- sepsis,
- constipation,
- Anastomose portocave…
- Le traitement est fondé sur trois éléments :
- arrêt du facteur déclenchant ;
- contrôle des voies aériennes et prévention de l’inhalation ;
- arrêt de l’absorption intestinale de métabolites azotés. Le lactulose induit une acidification du contenu digestif, un blocage de la pullulation bactérienne et de l’absorption d’azote.
7. Ictères postopératoires
- Diagnostique
- examen clinique,
- un bilan biologique et une
- échographie abdominale.
- Les causes sont multiples : hémolyse, résorption d’hématome, cholestase posthépatique, complication de la chirurgie, sepsis, exceptionnelle hépatite aux halogénés
8. Troubles métaboliques
- hyponatrémie : le plus souvent par dilution dans le cadre d’un hypervasopressinisme ou bien par déplétion, dans le cadre de diarrhées profuses ou par excès de diurétiques ;
- hypokaliémie : secondaire aux pertes digestives et rénales (diurétiques) ;
- anomalie de l’équilibre acidobasique : avec souvent une alcalose mixte à la fois respiratoire (hyperventilation hypoxique) et métabolique (hypokaliémie, vomissements, hypovolémie) ;
- hypomagnésémie secondaire aux diurétiques de l’anse ;
- hypercalcémie à un stade avancé de la cirrhose.
9. Prise en charge nutritionnelle
- L’apport nutritionnel calorique quotidien du cirrhotique doit être limité à 2000 kcal. L’apport protéique initial ne doit pas dépasser 0,6 g/kg. Il peut ensuite être augmenté par paliers jusqu’à 1,5 g/kg.



