i) Pneumopathies associées aux soins (nosocomiales)- Dr AOUF
A- Pneumopathies infectieuses graves
I- Définitions
Les infections broncho-pulmonaires sont des infections respiratoires basses pouvant toucher les bronches (bronchites), le parenchyme (pneumonies et suppurations pulmonaires et pleuropulmonaire) ou les deux à la fois (broncho-pneumonie).
- Il est habituel de distinguer parmi les pneumopathies (PNP), les pneumopathies communautaires, nosocomiales et de l’immunodéprimé.
- Les pneumopathies communautaires sont acquises en dehors de l’hôpital ou dans les 48 premières heures d’un séjour hospitalier ; elles sont surtout d’origine bactérienne et liés à des germes fréquents (pneumocoque, Haemophilus,).
- Les pneumopathies nosocomiales sont acquises à l’hôpital après un séjour hospitalier de plus de 48 heures ; elles sont souvent liées à des germes ayant acquis des résistances aux antibiotiques ce qui en fait toute la gravité.
- Les pneumopathie de l’immunodéprimé sont graves et résultent de la rupture de l’équilibre entre hôte et environnement par faillite du système immunitaire
Les agents causals sont transportés par voie aérienne, mains, matériels ou voie hématogène
Les bactéries : Par ordre de fréquence : pneumocoque, Haemophilus, klebsiella, puis staphylocoque aureus, pyocyanique, entérobactéries …
Les bactéries atypiques : Mycoplasmes et chlamydiae …La tuberculose
Les virus : Les PNP virales sont les plus fréquentes CMV, coxackies, rougeole…
Les parasites : Exotiques et rares : bilharziose, amibiase, échinococcose…
Les champignons : Aspergillus, candidose…
* FACTEURS FAVORISANTS
FACTEURS EXTERIEURS
- Tabac+++ très souvent associé à l’alcool (éthylo-tabagisme)
- La pollution (nanoparticules)
- Le terrain, sujet âgé Immunodéficience : SIDA, cancer, dénutrition, corticoïdes, diabète
II- Physiopathologie
Phénomènes inflammatoires entrainant
- réduction du volume gazeux :
- comblement par des exsudats (cellules et produits de l’inflammation)
- Altération du surfactant : collapsus
- Troubles de la perméabilité, micro thrombose, anomalies de la vasoréactivité
- Anomalies des bronchioles :
- Broncho constriction et œdème de la muqueuse
Conséquences
- Altération des échanges gazeux (shunt intra pulmonaire et espace mort pathologique)
- Baisse de la compliance pulmonaire (relation pression volume) par comblement alvéolaire et Hypertension artérielle pulmonaire HTAP
- Pouvant entrainer une insuffisance cardiaque droite
- Conséquence ultime : Insuffisance respiratoire aigüe pouvant mettre en jeu le pronostic vital augmentation de la résistance des voies aériennes.
III- Diagnostique
-
Signe clinique
Variables et pas toujours présents (sujet âgé++)
- la toux : sèche ou grasse si bronchite associée
- la dyspnée :
- Fréquence respiratoire élevée > 15/mn (Si basse pré mortem)
- Signes de lutte : tirage sus sternal, sus claviculaire intercostal, battement des ailes du nez (conduit à l’épuisement)
- expectorations : sales et purulentes (bronchite)
- fièvre : plus ou moins élevée (absente si pneumopathie virale)
- auscultation : crépitant en foyer ou généralisés (idem OAP !)
- percussion : matité localisée en cas d’épanchement pleural associé
-
Signes de gravite
- Impossibilité de parler
- Cyanose : lèvres, extrémités traduit l’hypoxie avec
- Les marbrures = état de choc
- Trouble de la conscience = Hypercapnie et hypoxie
-
Examens complémentaires
C’est l’examen de 1ère intention
Apparition d’opacités non labiles
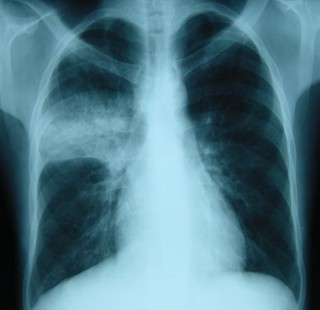
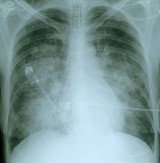
Pas en 1ère intention
Apprécie mieux la gravité des lésions, leur aspect, leur localisation, leur évolution : œdème, fibrose, hépatisation, abcès, épanchements pleuraux…
Permet un diagnostic différentiel : tumeur, image cicatricielle, sarcoïdose…
Hyperleucocytose : GB>10 000/ml
Augmentation de la PCR (protéine C réactive N= 0 à10)) et de la procalcitonine (N=0 à2)
Hypercapnie 35 à 45mmHg (peut être abaissée ou normale)
Devrait être obligatoire car aucun des examens précédents n’est spécifique
CBC = cytobactériologie des crachats : ne sert à rien !
Aspirations trachéales avec ou sans fibroscopie
Lavage bronco alvéolaire
Liquide pleural obtenu par ponction
Antigènes solubles urinaires pour legionnelle et pneumocoque
Sérologies pour les PNP atypiques et virales
Hémocultures
IV - Evolution
- La gravité d’une pneumopathie et son pronostic sont liés à son évolution sous traitement
- Pour cas des PNP communautaires l’évolution est favorable :
Amélioration des signes cliniques dans les 3jours, complète en 8 jours, radiologique en 2 à 3 semaines
Complications
- Insuffisance respiratoire aigüe : réanimation et/ou décès
- Choc septique (souvent avec le pneumocoque)
- Décompensation d’une pathologie sous-jacente : insuffisance cardiaque, rénale, diabète…
- Epanchement pleural à ponctionner
- Abcès pulmonaire : chirurgie
PNP récidivantes orientant vers des troubles de la déglutition, un déficit immunitaire, un cancer, un corps étranger chez l’enfant
V- Traitement
- Traitement de la cause
- But : stériliser les lésions par une antibiothérapie nécessairement probabiliste au départ.
C’est l’antibiothérapie. Elle dépend des données épidémiologiques, du terrain, de la gravité, de la présentation radio clinique
* sujet sain, sans signes de gravite =Amoxicilline, PO sans hospitalisation
* sujet fragile ou signes de gravite = Hospitalisation, C3G (Ceftriaxone) + quinolone (Levofloxacine) ou macrolide (Clarythromycine)
PNP d’inhalation : Amoxicilline + acide clavulanique (Augmentin)
TRAITEMENT SYMPTOMATIQUE
- O2 avec un matériel adapté au débit
- Lunettes, sonde, masque, masque haute concentration
- Puis ventilation non invasive, ventilation invasive (intubation),
- HYDRATATION PO ou IV
- Anti coagulation préventive =HBPM
- Kinésithérapie
- Aérosols : bronchodilatateurs et fluidifiants (si reflexe de toux)
- Pas d’antitussifs (toux = moyen de défense)
TRAITEMENT PREVENTIF
- Vaccins grippe et pneumocoque
MESURES PREVENTIVES
- Hygiène
- Isolement protecteur
- Lever précoce
B- Pneumopathies non infectieuses : Syndrome de MENDELSON
I-Définition
Décrit par le médecin Curtis Lester Mendelson dans les années 1940,le syndrome de Mendelson constitue une forme de pneumopathie d'inhalation.
La pneumonie d’inhalation (PI) se définit par l’inhalation de contenu gastrique ou oropharyngé dans le larynx ou les voies aériennes inférieures, ce qui peut entrainer une obstruction des voies aériennes et ou une inflammation pulmonaire.
- En anesthésie les PI sont plus fréquentes en péri opératoire, le risque d’inhalation surtout à l’induction et au réveil elle est responsable d’une mortalité allant de 3 à 5 % des sujets atteints.
- Elle est la cause de 36% des décès maternels liés à l’anesthésie en milieu obstétrique.
- Elles sont rencontrées dans d’autres circonstances.
II- Physiopathologie
L’inhalation bronchique peut survenir suivant 2 mécanismes :
a) Régurgitation : processus où le contenu gastrique reflue de l’estomac vers l’œsophage
le larynx phénomène passif
b) Vomissement : expulsion du contenu gastrique vers la bouche phénomène actif
- Mendelson distinguait 02 tableaux selon la nature liquide ou solide des aliments.
Le degré des lésions pulmonaires était corrélé au PH, volume du liquide gastrique inhalé et la nature
Inhalation de liquide acide PH= 1.5 – 2.4 provoque
* Dans les 4 premières heures
- des zones d’atélectasie diffuse par destruction du surfactant
- aires hémorragiques et nécrotiques avec œdème diffus interstitiel type lésionnel
* Au-delà des 24 premières heures
- disparition de revêtement épithélial bronchique et alvéolaire
- les alvéoles contiennent dès ce stade des membranes hyalines
- suivie d’une réaction fibroblastique interstitielle = fibrose
Inhalation de liquide PH>2,5
Lésion moins grave
Hypoxie modérée (baisse25% de PaO2) en rapport avec un bronchospasme réflexe par inhalation et destruction des surfactants dans certaines zones
Facteurs favorisants :
- Volume gastrique 2.5 l
- AG et PH du liquide inhalé < 2.5
- chirurgie en urgence surtout ASA III & IV
- Estomac plein – grossesse – hernie hiatale – RGO
- Obésité – stress – diabète
- Cause médical : coma – convulsion ou phase post critique
III -Diagnostic :
- Parfois on assiste à l’inhalation du liquide et l’aspiration trachéale ramène un liquide d’allure gastrique
1. Signes cliniques
Se développe rapidement dans les deux heures :
- tableau de détresse respiratoire : toux – dyspnée – tachypnée – cyanose voir un syndrome d’obstruction bronchique
- auscultation pulmonaire: râles ronflants ou sibilants diffus ou localisés - tableau d’OAP : expectoration mousseuse – crépitation
- les cas graves peuvent évoluer vers l’hypoxémie sévère (Pa02 < 50) une apnée et à l’état de choc.
2. Télé thorax
- infiltrats à droite ou bilatéraux
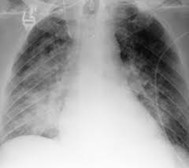
3- Evolution
La mortalité dépend de l’importance de l’atteinte initiale et est corrélé à la fois à l’étendue radiologique des infiltrats et au gradient alvéolo capillaire en O2
Rapide : quelques heures à œdème lésionnel à SDRA avec hypoxémie et hypercapnie
Mortalité +++ : tableau de défaillance multi viscérale dû aux surinfections pulmonaires Fibrose irréversible
Complications infectieuses +++ (germes anaérobies) à abcès du poumon, pleurésie purulente
IV- Traitement :
But :
- rétablir la liberté des voies aériennes
- assurer une ventilation adéquate ·
- éliminer les matières inhalées résiduelles
Traitement Symptomatique :
- rapide et adapté
- position latérale de sécurité
- Aspiration endotrachéale
Thérapie précoce de qualité
- Intubation trachéale ·
- fibroscopie bronchique : chez patients suspectés d’inhalation de particules de gros calibre suggéré par des foyers s’atélectasie persistants, celle-ci pouvant être éliminés au cours de l’examen
- remplissage pour maintenir une volémie correcte
- Traitement médical
- Bronchodilatateur en aérosol
- Corticoïde aucune place
- Antibiotique
- Ventilation artificielle : Précoce, améliore le pronostic fonctionnel pulmonaire (normoxie)
V-Prévention :
Respect du jeûne préop
Médicaments : Antiacide : citrate de Na 1h avant, renouvelé avant l’extubation si chirurgie > 45mn.
Anti H2 : cimétidine- Ranitidine Inhibiteur de la pompe à protons : omeprazole
Préférer l’ALR - Si non si AG : - position du patient : proclive de la tête 20-30°
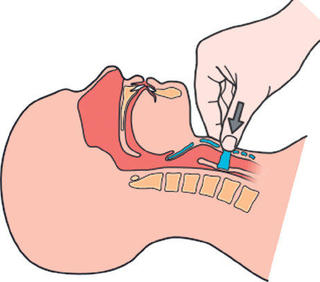
Manœuvre de SELLICK
- L’application manuelle sur le cartilage cricoïde d’une pression importante de l’ordre 4 à 5 kg visant à collabé l’œsophage, efficace vis-à-vis de la régurgitation et vomissement Débute avant l’induction jusqu’au gonflage du ballonnet de la sonde d’intubation
--------------------------------------------------------------------------------------------------------------------------------
Les pneumopathies d'inhalation
D. Chatellier, S. Chauvet, R. Robert∗ Service de réanimation médicale, CHU de Poitiers, 2, rue de la Milèterie, 86021 Poitiers cedex, France J. Morel, C. Auboyer, R. Jospe, R. Terrana, S. Molliex 2010
Définition*
*2009 Société de réanimation de langue française. SRLF.
La pneumonie d’inhalation est définie par l’inhalation de contenu gastrique ou oropharyngé dans le larynx ou les voies aériennes inférieures.
Elle est liée à quatre mécanismes qui peuvent être associés :
- retard à la vidange gastrique,
- hypersécrétion gastrique,
- facteurs favorisant le reflux gastro-œsophagien
- et atteinte laryngée lésionnelle ou réflexe.
Elle survient essentiellement chez des malades ayant une altération de la conscience.
Les conséquences cliniques des inhalations sont variables et dépendent de la nature, du pH et du volume des sécrétions inhalées.
Les bactéries associées aux pneumopathies d’inhalation ont une origine oropharyngée.
Les mesures préventives ont surtout été étudiées au cours de l’anesthésie chez les patients ayant l’estomac plein.
Elle a été décrite par Mendelson en 1946 à partir d’une série de 61 patientes d’obstétrique ayant inhalé leur contenu gastrique lors de l’anesthésie à l’éther
En fait, sous le terme de PI, plusieurs syndromes sont possibles selon la quantité et surtout la nature du liquide inhalé .
- Il peut s’agir d’inhalation de liquide gastrique acide stérile réalisant une pneumonie chimique et correspondant au syndrome décrit par Mendelson (traduit en anglais comme « aspiration pneumonitis »).
- Il peut également s’agir de l’inhalation des sécrétions oropharyngées colonisées ou infectées par des bactéries (traduit en anglais comme « aspiration pneumonia »).
Ce dernier mécanisme est actuellement le plus fréquent.
La distinction entre les deux entités est parfois difficile et des formes mixtes sont possibles.
Passe souvent inaperçue
Pour Neelakanta (Neelakanta G Chikyarappa A. A review of patients with pulmonary aspiration of gastric contents during anesthesia reported to the Departmental Quality Assurance Committee. J Clin Anesth 2006;18: 102-7)
L’inhalation est certaine lorsqu’...
- elle est visualisée
- et que du liquide gastrique est aspiré de l’arbre trachéobronchique.
L’inhalation est probable lorsque...
- du liquide gastrique est présent dans les voies aériennes supérieures ou la bouche,
- qu’a été constaté un épisode périopératoire d’hypoxie (SpO2 < 90 %) avec ou sans sibilance
- et qu’apparaissent sur une radiographie pulmonaire postopératoire des modifications radiologiques hautement compatibles avec une inhalation gastrique.
Pour Warner ( Warner MA,Warner ME,Weber JG. Clinical significance of pulmonary aspiration during the perioperative period. Anesthesiology 1993;78: 56-62.)
L’inhalation est reconnue par la présence de sécrétions biliaires ou de particules solides visualisées à l’intérieur de l’arbre trachéobronchique.
Pour les patients chez qui cette donnée n’est pas disponible, l’apparition d’un infiltrat radiologique pulmonaire est nécessaire.
Les PI sont au cinquième rang des effets indésirables survenant au cours de l’anesthésie générale, en particulier sur estomac plein, l’incidence des PI est d’un pour 2000 à 4000 anesthésies chez l’adulte et d’un pour 1200 à 2600 chez l’enfant
Une étude rétrospective rapporte que la majorité des inhalations en périopératoire surviennent lors de la laryngoscopie ou de l’extubation avec une fréquence de l’ordre de 1 pour 3200 anesthésies et une mortalité d’un pour plus de 70 000.
Facteurs de risque d’inhalation.
Retard à la vidange gastrique
- Traumatisme
- Spasme du pylore
- Ileus
- Médicaments ralentisseurs du transit (morphiniques, sédatifs)
Hypersécrétion gastrique
Facteurs favorisant le reflux gastro-oesophagien
- Reflux oesophagien
- Hernie hiatale
- Obésité*
- Neuropathie diabétique avec dysautonomie *
Facteurs laryngés
- Intubation en préhospitalier
- Anesthésie générale
- Traumatisme crânien
- Atteinte neuromusculaire
- Sclérose en plaque
- Parkinson
- Guillain-Barré
- Paralysie des nerfs crâniens
- Dystrophies musculaires
*Facteurs discutés.
Facteurs de risque d’inhalation lors de l’induction de l’anesthésie*
*SakaiT, Planinsic RM, Quinlan JJ, Handley LJ, KimTY, Hilmi IA. The incidence and outcome of perioperative pulmonary aspiration in a university hospital: a 4-year retrospective analysis. Anesth Analg 2006; 103:941-7.Kluger MT, Short TG. Aspiration during anaesthesia: a review of 133 cases from the Australian Anaesthetic Incident Monitoring Study (AIMS). Anaesthesia 1999;54:19-26..
- Urgence
- Anesthésie insuffisante
- Position de Trendelenburg
- Pathologie gastro-œsophagienne
- Antécédents de chirurgie œsophagienne
- Analgésie morphinique
- Intubation difficile
- Ventilation au masque
- Obésité et antécédents de chirurgie bariatrique
- Syndrome occlusif
- Dysfonction gastro-intestinale
- Prise alimentaire récente
- Troubles de la déglutition
Physiopathologie
Les mécanismes physiopathologiques en cause dans les PI dépendent de la nature du liquide inhalé et donc du type de PI
Les pneumopathies d’inhalation : différences selon la nature du liquide inhalé.
|
Type de liquide inhalé
|
Liquide gastrique acide
|
Sécrétions oropharyngées infectées
|
|
Mécanisme d’atteinte pulmonaire
|
Lésions pulmonaires aiguës toxiques
|
Inflammation pulmonaire aiguë en réponse à l’inoculation bactérienne
|
|
Microbiologie
|
Stérile au départ
Possibilité de surinfection secondaire
|
Cocci Gram positif
Bacilles Gram négatif
Anaérobies
|
|
Facteurs de risque
|
Altération marquée de la conscience
|
Dysphagie, troubles de la motilité gastrique
|
| Âge |
Pas d’influence de l’âge
|
Sujets âgés le plus souvent
|
| Clinique |
Inhalation souvent constatée par un témoin
Tous les intermédiaires entre : asymptomatique, toux, bronchospasme, expectoration sanglante, détresse respiratoire aiguë dans les deux à cinq heures suivant l’inhalation
|
Inhalation rarement constatée
Polypnée, toux, signes de pneumopathie infectieuse
|
Régurgitations et vomissements
Pression du sphincter oesophagien (PSO) ≈ 15 à 25 mmHg,
La pression intragastrique (PIG) normale < à 7 mmHg.
La PIG peut augmenter au-delà de 25 mmHg en position couchée ou lors d’une distension.
SI PIG > à PSO = régurgitation, phénomène passif.
En anesthésie, PI de régurgitations ; 3 FOIS PLUS fréquents que vomissements
Rôle de l’acidité, du volume et de la nature du liquide inhalé
Ces 3 éléments déterminent la gravité des lésions pulmonaires
pH
- En dessous d’un pH à 1,5 les lésions sont particulièrement graves,
- entre 1,5 et 2,5 elles sont proportionnelles au volume inhalé
- et au-delà d’un pH à 2,5 elles sont comparables à l’inhalation de sérum salé physiologique
Volume
- Un important volume liquidien ainsi que des aliments solides en grande quantité ou de grosse taille peuvent être responsables d’un tableau initial d’asphyxie
- La présence de particules alimentaires de petite taille, même dans un liquide à pH élevé, peut donner des réactions inflammatoires importantes similaires à l’inhalation de liquide acide mais plus localisées et d’apparition un peu retardée.
Nature du liquide inhalé
L’ inhalations de charbon activé, utilisé comme substance épurative en toxicologie , peut avoir de graves conséquences (bronchiolite oblitérante, évolution vers une fibrose pulmonaire)
La diffusion du liquide inhalé vers la périphérie pulmonaire se fait en quelques secondes. Si la base droite, du fait de la configuration anatomique de la bronche souche droite, est logiquement la plus exposée, la migration se fait en pratique en fonction de la posture du patient au moment où survient l’inhalation.
L’inhalation de liquide gastrique acide entraîne :
- une agression tissulaire directe, avec desquamation de l’épithélium bronchique, atteinte de l’épithélium alvéolaire, destruction du surfactant et dégénérescence des pneumocytes de type I et II ;
- une réaction inflammatoire, faisant intervenir les médiateurs habituels de l’inflammation (histamine, thromboxane, cytokines, interleukines, tumor necrosis factor [TNF], etc.) survient secondairement à l’agression locale, puis va ensuite intervenir à distance sur le reste du parenchyme pulmonaire et même sur l’ensemble de l’organisme. Une lésion directe relativement localisée peut ainsi être responsable d’une atteinte pulmonaire beaucoup plus extensive et d’un syndrome inflammatoire à réponse systémique ;
- très rapidement, un œdème interstitiel puis alvéolaire, de type lésionnel avec présence d’éléments cellulaires (hématies, polynucléaires, macrophages).
Ainsi, après une phase initiale variable, pouvant être assez discrète, la réaction inflammatoire va se développer vers la 2ème heure avec une évolution qui peut se faire en 48 heures vers la formation de membranes hyalines suivie d’une réaction fibroblastique interstitielle avec risque de fibrose .
Les particules alimentaires sont responsables de lésions bronchiolaires plus marquées, souvent obstructives, avec des réactions granulomateuses pouvant mettre plusieurs semaines pour disparaître, voire évoluer vers des lésions chroniques.
Complications infectieuses
Lors de l’inhalation d’un liquide gastrique acide (aspiration pneumonitis), habituellement stérile, l’inflammation est au premier plan des lésions observées.
Néanmoins, la contamination de ce liquide lors du passage oropharyngé, la gravité des lésions altérant les mécanismes de défense locaux et une éventuelle ventilation mécanique vont exposer le patient au développement secondaire d’une infection.
Lors d’une inhalation associée à une aspiration de liquide contaminé d’origine digestive ou oropharyngée (aspiration pneumonia), le risque infectieux est a priori présent d’emblée.
Aspects cliniques
Survenue de l’inhalation
Elle est plus ou moins évidente, parfois totalement occulte, ou au contraire d’emblée très aiguë.
- occulte : régurgitation au cours d’un coma, d’une anesthésie, d’une alimentation entérale, sans signe clinique significatif immédiat. On peut être amené à évoquer l’inhalation au décours d’une anesthésie avec aggravation pulmonaire secondaire inexpliquée;
- discrète : épisode de toux plus ou moins important, souvent atténué par une sédation en réanimation sous ventilation mécanique. C’est l’aspiration trachéale qui peut alors ramener un liquide d’aspect digestif ou évoquant le liquide de nutrition entérale ;
- plus évidente : régurgitation visualisée lors de l’intubation, vomissement extériorisé suivi d’une toux, d’une dyspnée sibilante, d’une cyanose passagère, d’une désaturation en oxygène ;
- aiguë : tableau asphyxique secondaire à une obstruction des voies aériennes par des particules alimentaires ou par une quantité liquidienne importante avec menace vitale à court terme.
Évolution secondaire
Dans un grand nombre de cas, l’inhalation reste silencieuse et sera même ignorée. En l’absence de symptômes dans les 2 heures qui suivent l’inhalation, l’évolution est le plus souvent simple ;
Il peut s’agir d’un tableau clinique et radiologique, initialement très inquiétant, mais qui s’amende en 24 à 48 heures. Il correspond généralement à l’inhalation, en grande quantité, d’un liquide gastrique clair à pH élevé ;
On peut, au contraire, observer une évolution rapide en quelques heures vers un œdème lésionnel dont la topographie déborde largement le territoire primitivement concerné et qui peut donner rapidement un tableau de syndrome de détresse respiratoire aiguë (SDRA) avec une hypoxémie importante, parfois une hypercapnie.
Même dans ces formes graves, une évolution favorable peut néanmoins survenir avec un bon pronostic fonctionnel à long terme ;
Elle peut se faire vers une complication infectieuse se traduisant par une pneumopathie classiquement située au niveau de la base droite mais en fait de localisation variable. La bactériologie est fonction des circonstances initiales. On peut observer des formes évolutives nécrotiques abcédées prolongées où le rôle des anaérobies est possible ;
On peut aussi observer des évolutions traînantes avec diminution de la compliance, hypercapnie, finalement résolutives en quelques semaines, souvent secondaires à des inhalations de particules alimentaires. Une évolution vers une fibrose irréversible est possible.
Traitement
Corticothérapie
N’ont pas fait leur preuve (les complications infectieuses seraient plus fréquentes.)
Antibiothérapie
Antibiothérapie empirique comprenant souvent une association bêtalactamine/inhibiteur des bêtalactamases
Prévention
Anesthésie
Dans de nombreux cas, l’inhalation peut être rattachée à une prise en charge inadaptée de l’anesthésie :
- sous-estimation du risque,
- absence d’intubation,
- non-utilisation d’une séquence rapide,
- non-application d’une pression cricoïdienne (manœuvre de Sellick).
Le risque existe aussi lors d’une sédation pour des procédures exploratoires ou interventionnelles qui implique une grande vigilance et des conditions rigoureuses (matériel disponible, surveillance et compétences immédiatement accessibles) , sédation parfois utilisée pour des manœuvres trop complexes ou trop longues .
Jeûne
Recommandations sur la pratique du jeûne avant anesthésie (recommandations de la Société scandinave d’anesthésie-réanimation [2005]).
- Les patients (adultes et enfants) peuvent boire des liquides clairs jusqu’à 2 heures avant une anesthésie générale ou régionale
- Les patients ne doivent pas prendre de nourritures solides 6 heures avant l’induction de l’anesthésie
- L’alimentation au sein doit être arrêtée 4 heures avant l’induction de l’anesthésie.
- La même précaution doit s’appliquer pour le lait en poudre
- Les adultes peuvent boire jusqu’à 150 ml d’eau avec une prémédication jusqu’à 1 heure avant l’induction de l’anesthésie, et les enfants jusqu’à 75 ml
- L’usage de chewing-gum et fumer doivent être évités durant les 2 heures avant l’induction de l’anesthésie
- Ces recommandations s’appliquent aussi aux césariennes programmées
- Les liquides clairs sont définis comme des liquides sans particule, sans graisse, par exemple, eau, jus de fruit sans pulpe, thé, café
- Le lait de vache et le lait en poudre sont considérés comme de la nourriture solide Les patients avec un retard connu ou suspecté de la vidange gastrique (diabète, pathologie gastro-intestinale haute) doivent être considérés sur des bases individuelles
Recommandations de l’American Society of Anesthesiologists (ASA, 2007)
- La prise orale de liquide clair en faible quantité peut être permise chez des patientes en travail simple
- Les patientes, sans complication, devant avoir une césarienne programmée peuvent prendre des liquides clairs en faible quantité jusqu’à 2 heures avant l’induction anesthésique. Exemple de liquide clair : eau, jus de fruit sans pulpe, boisson bicarbonatée, thé, café noir
- Le volume de liquide est moins important que la présence de particules
- Les patientes présentant un risque supplémentaire d’inhalation (obésité morbide, diabète, intubation difficile) ou un risque augmenté d’accouchement difficile (rythme cardiaque instable) peuvent avoir des restrictions supplémentaires de prise orale décidées au cas par cas
- L’ingestion de matières solides doit être évitée durant le travail
- Les patientes devant subir une césarienne programmée doivent observer un jeûne pour les matières solides de 6 à 8 heures dépendant du type de matière ingérée (matière grasse)
- Avant une procédure chirurgicale (césarienne), le médecin doit considérer l’opportunité de l’administration d’un antiacidenon particulaire, un anti H2 et/ou du métoclopramide
Augmentation du pH
Une seule dose de ranitidine ou d’inhibiteur de la pompe à sodium s’est montrée efficace pour augmenter le pH et diminuer le volume du liquide gastrique pendant toute la période opératoire .
Le citrate de sodium élève le pH en 2 minutes et le maintient au-dessus de 2,5 pendant 6 heures
---------------------------------------------------------------------------------------------------------------------------------
Infections broncho-pulmonaires du nourrisson , de l'enfant et de l'adulte (arrangement BMS)
Introduction
Il convient de distinguer
- les bronchites (et les bronchiolites),
- les pneumonies (bactériennes, virales, et plus rarement parasitaires ou fongiques),
- et les suppurations pleuro-pulmonaires ;
- d’un point de vue pragmatique, il est plus habituel de distinguer parmi les pneumonies, les pneumonies communautaires, nosocomiales et de l’immunodéprimé
1. Bronchites
D’origine virale ou viro-bactérienne, et bénignes.
Elles ont un potentiel de gravité :
- aux âges extrêmes de la vie ;
- par une diffusion éventuelle des lésions aux bronchioles ;
- par leur survenue chez l’insuffisant respiratoire ou cardiaque ;
- par les séquelles (rares) qu’elles peuvent entraîner (bronchectasies, bronchiolite oblitérante).
1.1 - Définition
Conséquence d’une inflammation aiguë (souvent descendante, rhino-pharyngo-laryngo-trachéo-bronchique), en général par des virus qui détruisent les cellules ciliées de l’épithélium bronchique et provoquent une hypersécrétion de la muqueuse.
L’inhibition des processus de défense anti-inflammatoire par les virus peut aboutir à une surinfection bactérienne, surtout sur certains terrains (patient âgé, bronchitique chronique, alcoolisme...).
Les principaux germes de surinfection sont
- Haemophilus influenzae
- et Streptococcus pneumoniae.
1.2 - Aspects cliniques
1.2.1 - Bronchite aiguë virale de l’adulte sain
Signe d’appel principal : la toux (quinteuse, rauque, douloureuse, incessante, insomniante).
Souvent précédée d’une atteinte des voies aériennes supérieures (coryza, pharyngite avec dysphagie, laryngite).
Initialement non productive (sèche), s’accompagnant d’une sensation de cuisson rétro-sternale pénible, elle devient productive en quelques jours avec une expectoration muqueuse ou muco-purulente parfois striée de sang.
La fièvre atteint rarement 39 ° c.
Elle s’accompagne du cortège des signes d’une infection virale (céphalées, myalgies, arthralgies, asthénie, troubles digestifs).
L’examen révèle des ronchi et des sibilants.
Les examens complémentaires ne sont pas justifiés.
L’évolution est bénigne, avec une disparition progressive de la toux dans un délai de deux semaines.
Celle-ci peut persister plus longtemps (jusqu’à 3 mois), temps nécessaire à la cicatrisation complète des abrasions épithéliales post-virales.
1.2.2 - Formes cliniques
Selon l’agent causal (Plus de 180 virus ont été répertorié)
| Virus |
Bactéries |
Influenza A et B
Para-Infuenzae
Virus respiratoire syncytial
Rhinovirus e
Adénovirus, coxsackie virus
Coronavirus |
Haemophilus influenzae
Streptococcus pneumoniae
Mycoplasma pneumoniae
Chlamydia pneumonia
Moraxella catarrhalis
Bordetulla pertussis |
| Toxiques |
|
Tabac - Pollution atmosphérique et industrielle
Fumées - Produits chimiques (amoniaque, chlore) |
|
Selon l’évolution
- En dehors d’un terrain fragilisé, une évolution grave compliquée d’une détresse respiratoire aiguë par bronchiolite ou pneumopathie extensive est exceptionnelle. Elle peut se voir au cours d’épidémies de grippe ou d’infections à virus respiratoire syncytial.
Selon le terrain
- L’âge, les maladies chroniques favorisent la surinfection bactérienne, le risque de pneumonie et d’insuffisance respiratoire aiguë.
- La bronchite aiguë d’origine infectieuse est responsable de la majorité des exacerbations de bronchite chronique et de broncho-pneumopathie chronique obstructive (BPCO)
- Chez l’asthmatique, l’insuffisant respiratoire chronique (restrictif ou obstructif) ou en cas d’insuffisance cardiaque, la bronchite aiguë peut être à l’origine d’une décompensation.
1.2.3 - Le nourrisson et l’enfant
Pas de particularités sauf : la bronchiolite et la coqueluche
La bronchiolite aiguë désigne un état pathologique en relation avec des lésions inflammatoires spécifiques de la bronchiole, en règle chez un enfant de moins de 2 ans.
1.3 - Traitement
1.3.1 - Bronchite aiguë de l’adulte sain
Traitement est symptomatique
1.3.2 - Exacerbation de bronchite chronique (EABC)
L’antibiothérapie est significativement plus efficace quand sont réunis les trois signes suivants:
- Une majoration de la dyspnée,
- Une augmentation du volume de l’expectoration,
- Une purulence des crachats (exacerbation de type I d’anthonisen). La purulence des crachats d’apparition ou d’aggravation récente est le meilleur signe d’orientation bien que non spécifique d’une infection bactérienne.
1.3.3 – La bronchiolite du nourrisson
La Société de pathologie infectieuse de langue française a proposé à l’issue d’une Conférence de consensus des recommandations suivantes figurant sur le tableau.
| |
Première intention |
Evolution |
| Bronchite aiguë du sujet sain |
Pas d’antibiotiques |
|
| EABC sans SVO |
Pas d’antibiotiques |
Si échec à partir de J5
amoxicilline
C1G orale
macrolide
doxycycline |
EABC
SVO modéré à modérément
sévère (VEMS < 80 % et > 35 % ou dyspnée d’effort à l’état basal) |
amoxicilline
C1G orale
macrolide
doxycycline |
Si ATB récente pour EABC :
amoxicilline + acide clavulanique
cefuroxime-axétil
cefpodoxime-proxétil
céfotiam-hexétil
fluoroquinolone |
EABC .
SVO sévère
ou poussées d’EABC
fréquentes (> 4 / an) |
amoxicilline + acide clavulan
cefuroxime-axétil
cefpodoxime-proxétil
céfotiam-hexétil
fluoroquinolone |
Si échec ou si Pseudomonas spp :
autres molécules (dont ciprofloxacine)
seules ou en association |
|
EABC : exacerbation aiguë de bronchite chronique
SVO : syndrome ventilatoire obstructif
|
Le traitement est symptomatique :
- position proclive dorsale,
- désobstruction nasale avec aspiration de sécrétions nasopharyngées,
- oxygénation éventuelle (par les lunettes nasales),
- kinésithérapie respiratoire fondamentale biquotidienne,
- hydratation insuffisante
MDT: ß2+ controversés, corticothérapie indiquée dans les formes trainantes avec hyperréactivité bronchique, antibiothérapie en cas de surinfection bactérienne
2. Pneumonies
Définition
La symptomatologie, les agents pathogènes en cause, les modalités de la prise en charge diagnostique et thérapeutique opposent les pneumonies communautaires et les pneumonies nosocomiales.
Le terme de pneumonie communautaire, traduction littérale de la locution community acquired pneumonia, a été consacré par l’usage et désigne l’ensemble des pneumonies contractées en milieu citadin et rural, hors de structures de soins.
A l’opposé, une pneumonie nosocomiale est une pneumonie contractée à l’occasion d’un séjour dans un établissement de soins, se manifestant au delà de 72 heures après l’admission.
2.1- Pneumonies communautaires
1 % de l’ensemble des infections respiratoires
Hospitalisation de 15 à 20 %
Mortalité
- 0 et 5 % pour les formes les moins sévères, (traitées au domicile) ;
- 10 et 20 % pour les formes graves hospitalisées
| Pneumonies communautaires |
Pneumonies nosocomiales |
| Fréquents |
Streptococcus pneumoniae
Haemophilus influenzae
Mycoplasma pneumoniae
Chlamydia pneumoniae
Legionella pneumophila
Virus grippal |
Staphylocococcus aureus
Pseudomonas aeruginosa
Acinetobacter spp
Entérobactéries |
| Rares |
Staphylococcus aureus
Entérobactéries
Germes rares |
Streptococcus pneumoniae
Haemophilus influenzae
Champignons
Germes rares |
Les principales formes anatomo-cliniques
- Pneumonie franche alvéolaire aiguë
- Pneumonie interstitielle
- localisée (atypique ou hilifuge)
- diffuse
- Bronchopneumonie
- Formes mixtes, composites
- Pneumonie d'aspiration
Les principaux diagnostics différentiels
- Tuberculose pulmonaire
- Embolie pulmonaire
- Poumon cardiaque
- Cancer broncho-pulmonaire
- Pneumopathie immuno-allergique
2.2 - Aspects cliniques
De manière schématique, la pneumonie peut revêtir trois tableaux anatomo-cliniques
2.2.1 - la pneumonie alvéolaire systématisée: début brutal (horaire)
ou survenant après un à deux jours d’indisposition, + fièvre à 40° C, un malaise général intense, un point de côté bloquant la respiration, une toux sèche, une dyspnée progressive. L’examen clinique, pauvre dans les premières heures, est riche au 2ème ou 3ème jour.
2.2.2 - la pneumonie interstitielle:
Début plus progressif, souvent précédée d’une infection rhino-pharyngée, avec un cortège de signes fonctionnels riches (toux, douleurs thoraciques, céphalées, myalgies), un examen clinique pauvre. Elle peut revêtir en fonction de la diffusion des signes deux aspects : soit celui de la pneumonie atypique ou pneumonie hilifuge; soit les signes sont plus étendus, sous la forme d’opacité réticulaires et micronodulaires bilatérales. C’est souvent le tableau d’une pneumopathie virale ou à germe intra-cellulaire (Mycoplasma pneumoniae, Chlamydia pneumoniae).
2.2.3 - la bronchopneumonie:
Elle est la conséquence d’une bronchio-alvéolite caractérisée par un début souvent brutal ou en deux temps après une phase de bronchite aiguë. La fièvre est désarticulée ou en plateau ; les signes généraux intenses ; l’expectoration purulente et abondante ; la dyspnée marquée.
L’entité pneumonie d’aspiration est caractérisée par un tableau généralement torpide, à l’occasion d’un trouble de déglutition passager (alcoolisme aigu, intervention sur les voies aériennes supérieures, anesthésie) ou chronique (paralysie du voile, sénilité). Elle siège en règle dans les zones déclives, elle est rapidement abcédée, les agents les plus communément en cause sont des entérobactéries, Staphylococcus aureus et surtout des germes anaérobies.
2.3 – Traitement
Le traitement antibiotique au cours d’une pneumonie communautaire prise en charge au domicile est probabiliste, empirique, en raison des difficultés du diagnostic microbiologique. En cas d’hospitalisation , surtout s’il s’agit d’une forme grave d’emblée ou aggravée, des investigations microbiologiques doivent être effectuées.
Le germe n’est pas identifié
Le repos au lit, une bonne hydratation, l’administration d’aspirine et d’un anti-inflammatoire non hormonal à visée antipyrétique et antalgique constituent le traitement de base de tous les malades. La présence de signes d’insuffisance respiratoire est une indication à l’oxygénothérapie (à la sonde nasale ou au masque) et à l’hospitalisation. La persistance sous oxygène d’une hypoxie inférieure à 60 mmHg est une indication à la ventilation assistée. Le choix probabiliste de l’antibiotique repose sur quelques principes :
- aucun antibiotique actuellement disponible n’a un spectre et une tolérance tels qu’il puisse être un traitement de référence exclusif ;
- en présence d’une pneumonie alvéolaire, l’antibiothérapie de première intention doit être active sur S. pneumoniae ;
- le choix d’une antibiothérapie de spectre élargi ou d’une association de deux antibiotiques en première intention dépend de la gravité symptomatique et de facteurs de co-morbidité ou de maladies chroniques susceptibles d’élargir l’éventail des micro-organismes présumés en cause ;
- l’antibiothérapie de deuxième intention doit combler les lacunes de spectre du traitement antibiotique initial inefficace ;
Pneumonie communautaire (PC), adulte ambulatoire présumé sain, sans signe de gravité
| Antibiothérapie de première intention |
Absence d’amélioration à 48 heures |
| ≥ 40 ans Amoxicilline ( 1 g x 3/24 h) |
Macrolide (substitution ou association ) ou quinolone à visée antipneumococcique per os (monothérapie) |
< 40 ans Macrolide (sauf azithromycine)
et PC d’allure atypique |
Amoxicilline (substitution ou association)
ou quinolone à visée antipneumococcique
per os (monothérapie |
Pneumonie communautaire, adulte ambulatoire, avec comorbidités, sans signe de gravité (âge > 65 ans et/ou comorbidités et/ou éthylisme chronique)
| |
Premier choix |
Alternative |
| Cas général |
amoxicilline-acide clavulanique
1 g x 3/24 h, per os |
Ceftriaxone 1 g/24 h IV/IM |
Suspicion d’intra cellulaire
et apparentés (légionellose) |
[amoxicilline-acide clavulanique
1 g x3/24 h, per os + macrolide]
ou [amoxilline + ofloxacine] |
[ceftriaxone 1 g/24 hIV/IM + macrolide] ou [quinolone à visée antipneumococcique per os] |
| Suspicion d’inhalation |
amoxicilline-acide clavulanique
1 g x 3/24 h |
C3G injectable (ceftriaxone 1 g/24 h parentéral IV/IM) + métrodinazole |
Pneumonie communautaire, adulte requérant une hospitalisation en médecine
| |
Premier choix |
Alternative |
| Cas général |
amoxicilline-acide clavulanique 1 g x 3/24 h, per os |
C3G parentérale (ceftriaxone 1 g/24 h céfotaxime 1 g/8 h) |
| Suspicion cellulaire et apparentés (légionellose) |
[amoxicilline-acide clavulanique 1 g x3/24 h, per os + macrolide] ou [amoxilline + ofloxacine] |
[C3G parentérale (ceftriaxone 1 g/24 d’intra céfotaxime 1 g/8h) + macrolie ] ou [quinolone à visée antipneumococcique orale ou injectable] |
| Suspicion d’inhalation |
amoxicilline-acide clavulanique
1 g x 3/24 h parentéral |
C3G injectable (ceftriaxone 1 g/24 h,
céfotaxime 1 g/8 h) + métrodinazole IV |
Pneumonie communautaire, adulte requérant une hospitalisation en secteur de soins intensifs/réanimation
| |
Premier choix |
Alternative |
| Cas général |
[amoxicilline-acide clavulanique IV* injectable ou C3G injectable (ceftriaxone 1-2 g/24 h , céfotaxime 1-2 g/8 h)
et [macrolide injectable ou quinolone injectable (ofloxacine, ciprofloxacine, quinolone à visée antipneumococcique)] |
| Si suspicion de Legionella |
+ rifampicine IV |
| * Il est possible de recourir à une posologie de 1 à 1,5 g/4-6 h chez l’adulte par voie intraveineuse (correspondant à 100 à 150 mg/kg d’amoxicilline) |
2.2 Pneumonies Nosocomiale
Mortalité atteint 20 à 50 %.
Les pneumonies nosocomiales précoces (dans les 5 premiers jours de l’hospitalisation) sont habituellement dues à des bactéries du milieu extra-hospitalier (S. Pneumoniae, H. Influenzae, S. Aureus méthicilline sensibles) ;
En revanche les pneumonies nosocomiales tardives sont dues à des germes sélectionnés par les antibiotiques, multirésistants ; elles sont souvent polymicrobiennes (S. Aureus méticilline résistant, P. Aeruginosa , entérobactéries).
Le diagnostic est suspecté sur l’existence d’une fièvre, de sécrétions trachéo-bronchiques purulentes, d’une image radiologique nouvelle ou aggravée.
Confirmé par l’examen bactériologique des sécrétions bronchiques
Pneumonies nosocomiales – Facteurs prédisposants (d’après C. BRUN BUISSON)
| Intrinsèques |
Extrinsèques (en relation avec l’AMAR) |
- Age
- Antécédents broncho-pulmonaires
- Œdème pulmonaire
- Coma
- Choc
- Sepsis, acidose
- Insuffisance rénale
|
- Anesthésie
- Chirurgie abdominale haute et/ou thoracique
- Ventilation artificielle (intubation, trachéotomie)
- FIO2 élevée
- Sonde naso-gastrique, alimentation entérale
- Anti H2, anti-acides
- Sédatifs, barbituriques
|