Pr.GUENDOUZ Ahmed (Anatomopathologiste)
La pression artérielle :
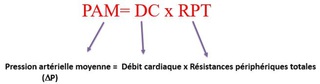
Le but de l’homéostasie est d’assurer un débit tissulaire et donc un apport en substrats et en oxygène suffisant quel que soit l’état hémodynamique
Le contrôle de la PA est donc essentiel à l’homéostasie et ce sont les mécanismes qui assurent ce contrôle que nous allons décrire.
Pression du sang dans les artères.
On parle aussi de tension artérielle, car cette pression est aussi la force exercée par le sang sur la paroi des artères
Que signifient les chiffres?
Le chiffre supérieur est la pression lorsque le cœur se contracte (Pression artérielle systolique PAS)
Le chiffre inférieur est la pression lorsque le cœur se relâche (Préssion artérielle diastolique PAD)
Régulation de la pression artérielle
A.REGULATION A COURT TERME
Principal acteur : le système nerveux autonome (sympathique et parasympathique).
Son action s’exerce préférentiellement par le biais du baroréflexe dont les deux composantes, artérielle et cardiaque, agissent pour tamponner les fluctuations de la pression artérielle avec une cinétique extrêmement courte (quelques secondes).
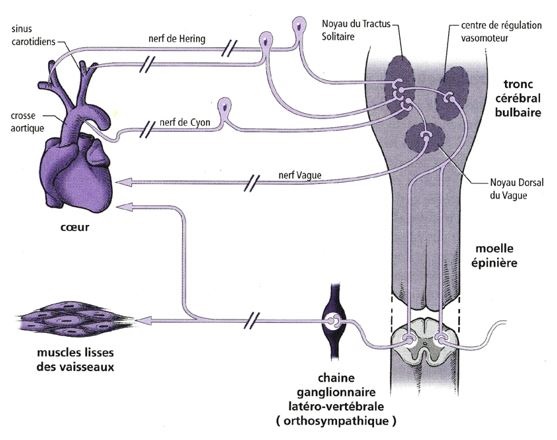
Description du baroréflexe cardiaque
boucle de régulation à trois niveaux :
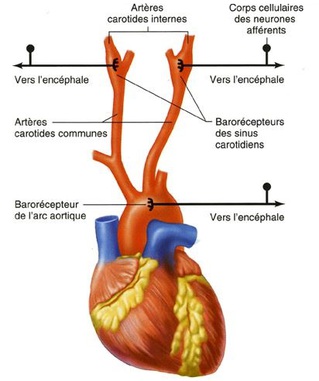
Les afférences comprennent des récepteurs sensibles à l’étirement (barorécepteurs) présents au niveau des sinus carotidiens et de l’arche aortique et connectés au système nerveux central par des nerfs cheminant dans le nerf de Hering (branche du pneumogastrique).
Les centres intégrateurs sont bulbaires et représentés par le Noyau du Tractus Solitaire. Des connections avec d’autres centres du tronc cérébral faisant intervenir différents types d’inter-neurones ont été mis en évidence mais ne seront pas détaillées ici.
Les efférences sont de deux types : sympathique et parasympathique.
Elles ont également deux destinations distinctes : le cœur, c’est le baroréflexe cardiaque et les vaisseaux, c’est le baroréflexe artériel. Les fibres à destinée cardiaque sont de type mixte sympathique et parasympathique, alors que les fibres à destinée vasculaire sont exclusivement sympathiques.
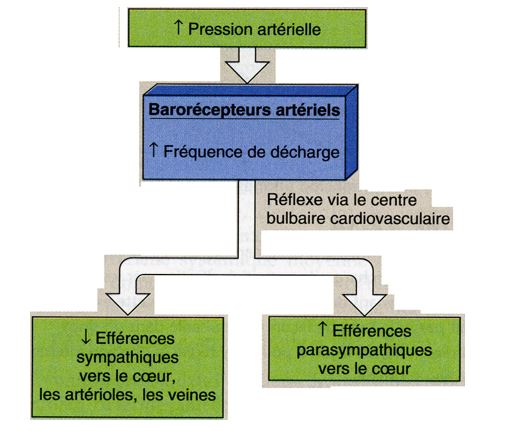
Effets du baroréflexe cardiaque
Au niveau du tissu cardiaque, modulation de la fréquence cardiaque et de la contractilité.
Au niveau vasculaire, ce système sera responsable de la modulation des résistances périphériques : diminution du tonus sympathique et vasodilatation en cas d’élévation de la PA et inversement élévation du tonus sympathique et vasoconstriction en cas de baisse tensionnelle.
Si ce baroréflexe est très efficace dans la régulation à court terme de la PA, il n’est, en revanche, d’aucune importance dans la régulation à long terme .
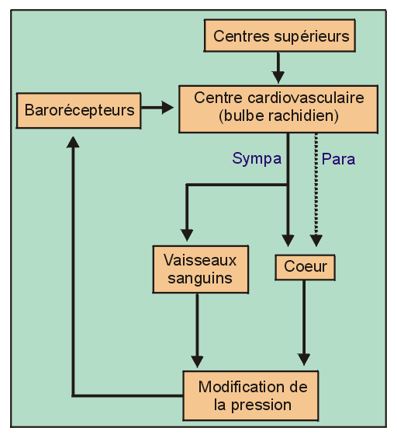
Une personne ayant subi une grave hémorraagie devient très pâle (peau blanche et froide) et son cœur bat très vite. Pourquoi ?
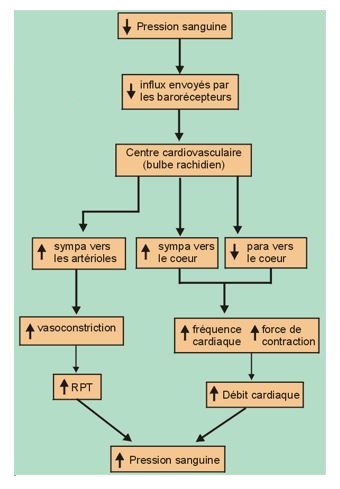
Lorsque la pression augmente, les barorécepteurs sont stimulés et envoient des influx au centre cardio-vasculaire. Si la pression diminue, l’activité des barorécepteurs diminue.
Autres réflexes impliquant le SNA
les récepteurs sont soit des barorécepteurs cardio-pulmonaires soit des chémorécepteurs carotidiens et aortiques. Ils peuvent aussi moduler l’activité sympathique et donc intervenir dans le contrôle de la PA.
le système nerveux sympathique n’intervient pas que pour limiter la variabilité tensionnelle mais qu’il peut également entraîner des poussées hypertensives.
C’est typiquement le cas lors d’un stress mental ou d’un effort physique où par une mise en jeu centrale, le système nerveux sympathique peut entraîner une élévation de PA.
Ceci répond à une augmentation de la demande métabolique tissulaire qui passe à l’échelon systémique par une augmentation du niveau tensionnelle moyen.
B.REGULATION DIFFEREE (moyen terme)
•Cette régulation qui intervient à moyen terme (quelques minutes à quelques heures) fait surtout intervenir les régulations hormonales par leur effet vasomoteur systémique (angiotensine II, aldostérone, vasopressine, facteur atrial natriurétique...)
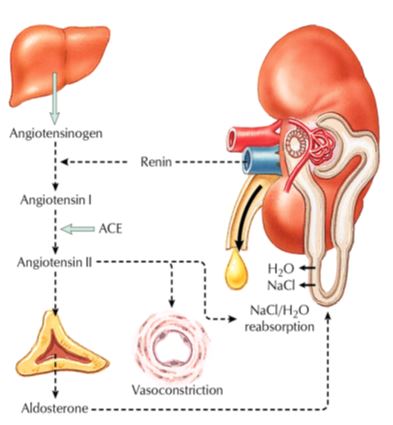
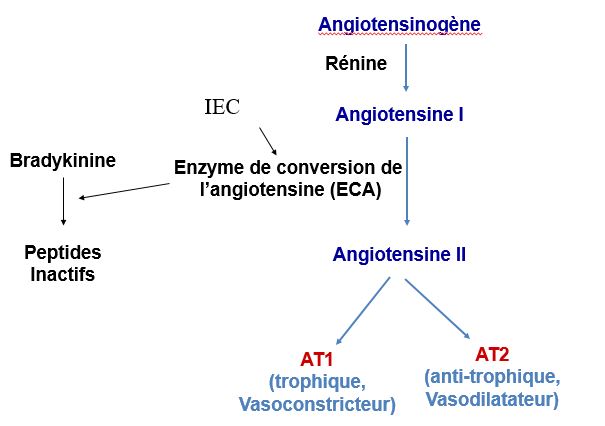
Système rénine-angiotensine
L’organisation de ce système fait intervenir un peptide effecteur, l’angiotensine II, généré dans la circulation par une cascade enzymatique; celle-ci est initiée par la rénine synthétisée au niveau de l’appareil juxta-glomérulaire du rein clivant l’angiotensinogène d’origine hépatique en un décapeptide inactif, l’angiotensine I qui, activé à son tour par l’enzyme de conversion, conduira à l’angiotensine II.
La sécrétion de rénine est régulée de façon très fine ; quatre mécanismes jouent un rôle essentiel : la pression de perfusion rénale, la concentration en sodium maculaire, la stimulation nerveuse sympathique via les récepteurs ß et le rétrocontrôle négatif par l’angiotensine II.
La sécrétion de l’enzyme de conversion, au contraire, n’est pas régulée et ne catalyse donc pas une étape limitante de cette cascade protéolytique.
L’angiotensine II est un puissant vasoconstricteur grâce à son effet sur la mobilisation du calcium intracellulaire. Il entraîne une augmentation des résistances périphériques. Enfin à plus long terme elle possède un effet trophique qui se manifeste au niveau cardiaque et vasculaire et qui au niveau des vaisseaux participe à l’augmentation des résistances observée dans tous les états où ce système est activé, comme par exemple l’hypertension réno-vasculaire.
Autres hormones
Le facteur atrial natriurétique (ANF), qui trouve son origine au niveau des cavités cardiaques et plus particulièrement au niveau des oreillettes, est vasodilatateur et augmente la natriurèse. Sa sécrétion est essentiellement soumise à une action locale : étirement de la paroi auriculaire.
La vasopressine d’origine hypophysaire est sécrétée en réponse à une augmentation de l’osmolalité plasmatique.Elle possède un effet vasoconstricteur et entraîne également une rétention d’eau libre.
Le monoxyde d’azote est un puissant vasodilatateur d’origine endothéliale et dont l’effet rapide s’exerce à tous les niveaux.
C.REGULATION A LONG TERME :
La régulation à long terme s’exerce essentiellement sur la volémie. Elle fait intervenir un organe essentiel, le rein et un système majeur le système rénine-angiotensine
Natriurèse de pression
Lorsque la volémie augmente, la PA augmente aussi. Cette élévation tensionnelle a un effet direct sur le rein qui conduit à une augmentation de l’excrétion d’eau et d’électrolytes via une augmentation de la filtration :
c’est la relation pression-natriurèse qui est fondamentale dans le contrôle à long terme de la PA. Elle s’observe très bien sur un rein isolé et perfusé privé de tout environnement hormonal.
En pratique clinique ce type de situation qui se rencontre dans tous les états de choc et d’hypovolémie où l’hypoperfusion rénale entraîne une oligurie..
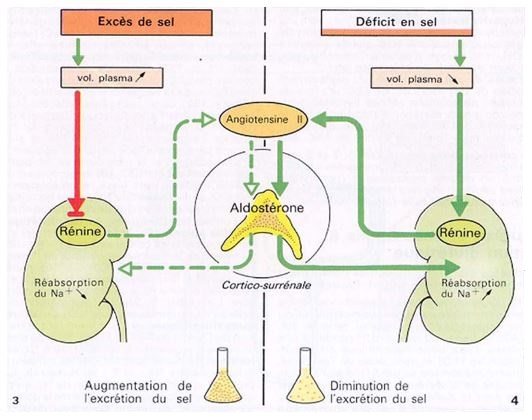
Une augmentation de l’apport en sel (et donc de volémie et de PA) entraînera une élévation de l’excrétion liquidienne et sodée. La déplétion volumique qui en résultera aura tendance à corriger l’élévation tensionnelle.
En réalité, le système rénine-angiotensine n’est pas fixe mais il est modulable. Si l’on se place dans la situation où l’apport sodé augmente, la baisse de l’activité du système rénine-angiotensine permettra un réajustement de la relation pression-natriurèse entraînant l’augmentation de l’excrétion sodée sans variations de PA.
Inversement lors d’une diminution de l’apport sodé, une activation du système rénine-angiotensine permettra de diminuer l’excrétion sodée sans baisse tensionnelle.
Ce mode de régulation complexe fait que lorsque le système rénine-angiotensine est opérant, le niveau tensionnel est théoriquement peu influencé par l’apport en sel.
Cet effet de l’angiotensine II sur la rétention d’eau et de sel passe par un effet direct sur les structures du rein dont le plus important est probablement la constriction artériolaire. Il passe aussi par un effet indirect via la sécrétion d’aldostérone dont l’angiotensine II est le plus puissant stimulant. L’aldostérone par ses effet tubulaires va également favoriser la réabsorption de sodium.
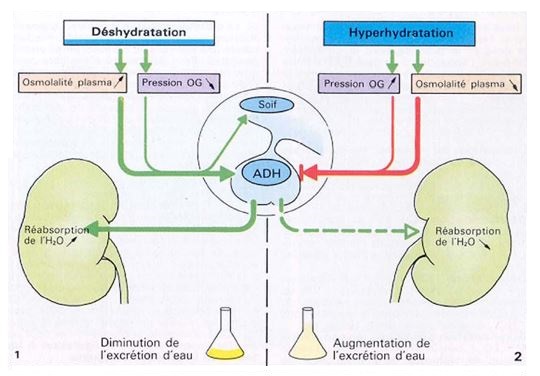
Hormone antidiurétique
Ajustement rapide des reins pour le maintien du volume d’eau de l’organisme
Si la concentration en eau diminue : diminution du volume sanguin = diminution de la PA = diminution du volume urinaire → Sécrétion de l’ADH
ADH agit au niveau des tubules rénaux et collecteurs pour une réabsorption accrue de l’eau
La tension artériel
Dans la circulation sanguine circule du sang à haute et basse pression.
Haute pression ou Maxima =140 mmHg : à partir du ventricule gauche, la totalité des artères et des artérioles. Ses principales caractéristiques sont :
Sa faible capacité, environ 15% du volume sanguin total. Son rôle de réservoir à haute pression placé à la sortie du cœur et tout près du lieu d’utilisation.
Le pouls est la manifestation tangible de la pression artériel dans ce circuit à haute pression. A chaque systole ventriculaire une onde se propage dans les artères dont la paroi élastique se dilate au passage de cette onde, qui donne naissance au pouls.
On pourra sentir le pouls sur différents endroit du corps, mais toujours sur une artère ou une artériole.
Basse pression ou Minima = 80 mmHg : C’est le circuit restant composé des capillaires et du système veineux. Ce différentiel entre Maxima et Minima fait circuler le sang.
HTA : Définition
L’hypertension artérielle (HTA) est définie comme :
une pression artérielle systolique
(PAS)> 140 mmHg et/ou
une pression artérielle diastolique
(PAD) > 90 mmHg.
Chez le diabétique
HTA si PA > 130/80 mmHg
Mesurée en mm Hg (millimètres de mercure)
Par exemple 124/82 mm Hg
Systolique = 124 mm Hg
Diastolique = 82 mm Hg
Un problème de santé publique
«50% des malades ne savent pas qu’ils sont hypertendus », c’est ce qu’a déclaré, samedi dernier, à Sétif, le professeur Ahcène Chibane en marge du 12e congrès annuel de la Société algérienne d’hypertension artérielle (Saha). S’appuyant sur les statistiques de 2004 et celles de deux récentes études, le spécialiste a précisé qu’un tiers des Algériens souffrent d’hypertension artérielle et que 50% des malades ignorent leur maladie en raison de l’absence de symptômes.
Augmente avec l’âge : 40 % des hommes de plus de 65 ans.
Principale cause de mortalité cardiovasculaire.
Méthodes de mesure
Invasive :
nécessite une ponction artérielle (humérale, fémorale) et un cathéter relié à une tête de pression.

Méthodes de mesure non invasives
Méthode palpatoire,
du pouls radial ou huméral.
Permet uniquement de connaître la PAS avec une précision limitée.
Méthode auscultatoire,
se réfère aux bruits artériels de Korotkow perçus en aval du brassard, le plus souvent au pli du coude.
L’apparition des premiers bruits détermine la PAS
La disparition des bruits détermine la PAD.
Méthodes de mesure

Méthode auscultatoire
La méthode courante en pratique clinique a été inventée en 1905 par Korotkow.
Elle consiste à mesurer au manomètre la contre pression exercée sur une artère par un brassard gonflable tout en auscultant l'artère.
Sphygmomanométre

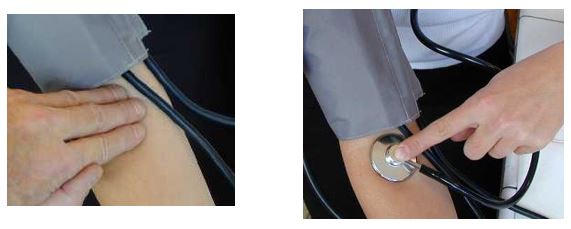
Pour une bonne mesure :
Rigueur pour minimiser les erreurs dues à l'observateur
Matériel adapté: brassard adapté
Sujet allongé ou assis depuis 5 mn,
Dégonflage lent (2-3 mmHg/s) a l'approche des valeurs de PAS et PAD
Lecture à la graduation la plus proche (2 mmHg)
Faire une mesure sur chaque bras et prendre la moyenne des deux.
Si l'on échoue à mesurer la pression artérielle sur un bras, recommencer sur l'autre bras.
Laisser un temps de repos suffisamment long entre deux mesures sur le même bras.
Eviter les vêtements compressifs
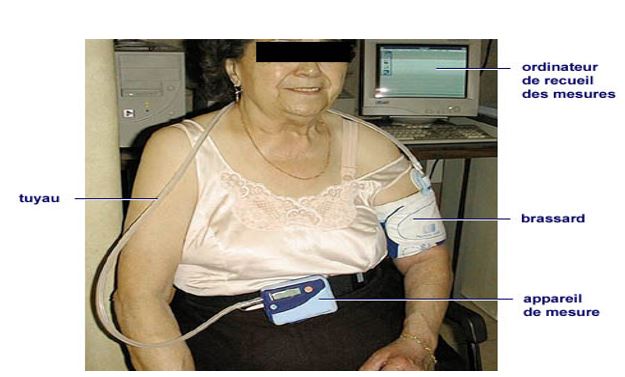
MAPA
Mesure ambulatoire PA :
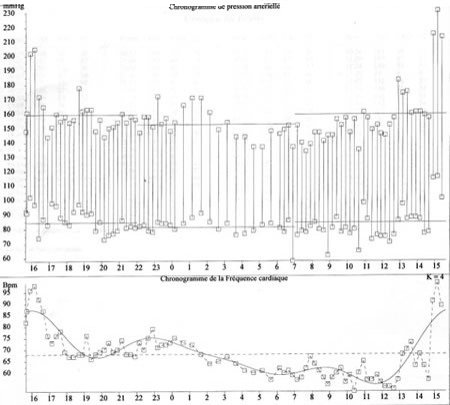
Réalisée sur 24 heures avec un appareillage portatif
Met en évidence un rythme circadien avec des valeurs de PA plus basses la nuit (moins 15 à 30 mmHg).
Valeurs de référence inférieures à celles notées au cabinet médical : < 135/85 mmHg.
Permet d’éliminer un effet « blouse blanche ».
Indications automesure ou MAPA
Avant de débuter un traitement antihypertenseur médicamenteux +++
si PA compris entre 140-179/90-109 mmHg
(en l’absence d’une atteinte des organes cibles)
chez le sujet âgé
A tout moment de la prise en charge :
En cas d’HTA résistante et dans l’évaluation thérapeutique
Elle constitue un facteur d’amélioration de l’observance au tt
Indications plus spécifiques à la MAPA :
évaluer le mode de variation de la PA nocturne,
rechercher une variabilité inhabituelle de la PA (dysautonomie diabétique ou primitive, syndrome d’apnée du sommeil ou insuffisants rénaux chroniques).
dans les cas où l’automesure n’est pas réalisable.
La mesure d’effort :
Au cours d’un effort dynamique
Sur bicyclette ergométrique ou sur tapis roulant.
Permet de définir un profil tensionnel d’effort par rapport à un profil établi sur une population témoin
QUE FAIRE DEVANT UNE HTA DIAGNOSTIQUEE ?
A. Etude du retentissement de l’HTA
1. Le bilan OMS :
Le bilan minimum proposé par l’OMS doit être effectué impérativement :
Dosages sanguins : créatininémie et calcul de la clairance de la créatininémie (modèle de Cockcroft), kaliémie, glycémie, cholestérol total, HDL-cholestérol, triglycérides avec calcul du LDL (formule de Friedwald). (Cockcroft : 140 – âge x poids/créatininémie x k (1.23 chez l’homme, 1.04 pour la femme) ; (Friedwald : cholestérol total – HDL – triglycérides/5 ; exprimé en g/l).
Examens urinaires : recherche d’hématurie, de protéinurie par bandelette réactive
ECG,
le FO a surtout de l’intérêt dans l’HTA grades 2 et 3 dans l’éventualité de signes de décompensation (hémorragies, exsudats) liés à la rétinopathie hypertensive.
2. L’atteinte des organes cibles (retentissement viscéral)
Retentissement cardiaque :
On recherche des signes d’insuffisance cardiaque ou d’insuffisance coronarienne.
L’ECG doit être effectué à la recherche d’une hypertrophie auriculaire, d’une hypertrophie ventriculaire gauche, de signes de surcharge systolique VG.
Une radiographie du thorax peut préciser le volume cardiaque.
L’échocardiographie plus sensible que l’ECG peut apporter des renseignements d’un grand intérêt ; son usage ne peut être préconisé de façon systématique, mais elle sera effectuée chez les patients symptomatiques présentant une dyspnée, une douleur thoracique et un souffle cardiaque et dans les populations les plus à risque.
La mesure ambulatoire de la PA des 24 h possède une meilleure valeur pronostique, apprécie la variabilité nycthémérale des 24 h,
Retentissement cérébral :
Une complication peut avoir été la circonstance révélatrice de l’HTA ;
Il faut savoir rechercher un accident ischémique transitoire, des signes neurosensoriels.
L’étude du fond d’oeil est classique (stade I et II : artères fines, irrégulières voire spasmées avec signes du croisement, stade III: hémorragies exsudats, stade IV: œdème papillaire).
Retentissement rénal :
Il comprend le dépistage urinaire par bandelette (labstix) de la protéinurie, d’une hématurie complété s’il y a lieu du culot urinaire, du compte d’addis et du dosage de la protéinurie des 24 h.
La détermination de la fonction rénale par la créatininémie est systématique.
La recherche de la micro albuminurie par réactif pourrait s’avérer un bon marqueur rénal du risque cardiovasculaire, ceci est déjà validé chez l’hypertendu diabétique non-insulino-dépendant et l’intérêt s’est confirmé dans l’HTA essentielle, avec une applicabilité plus limitée, non systématique.
Le dépistage de l’athérosclérose :
Il est évidemment clinique à recherche de manifestations angineuses, d’une claudication des membres inférieurs, la palpation des pouls, et l’auscultation des axes vasculaires : l’aorte , les artères rénales, fémoro-iliaques, et carotidiennes.
Une anomalie clinique et/ou un contexte multirisques peut conduire au dépistage de plaques athéromateuses par échographie vasculaire.
3. L’évaluation du risque cardiovasculaire absolu.
Au niveau individuel après avoir établi un diagnostic d’HTA il est nécessaire de situer l’ensemble des facteurs de risque cardiovasculaire associés.
On individualise les facteurs de risque non modifiables (l’âge, le sexe, la prédisposition génétique) et des facteurs de risque modifiables (l’HTA elle-même, l’hypercholestérolémie, l’obésité, le diabète, la sédentarité).
Des grilles ont été établies issues d’études épidémiologiques, en particulier celle de Framingham, puis européennes permettant en fonction du sexe, homme ou femme, de l’âge, du niveau de cholestérolémie, et du niveau de PAS, d’évaluer le risque cardiovasculaire du patient.
Ainsi, on peut opposer l’homme de la cinquantaine, fumeur, hypercholestérolémique, hypertendu à haut risque cardiovasculaire et la femme de la quarantaine présentant une HTA légère isolée, en l’absence de tout autre facteur de risque dont le risque cardiovasculaire est faible.
Il existe une authentique “régionalisation” du risque cardiovasculaire à prendre en compte dans l’intervention thérapeutique.
Les recommandations européennes 2003 ESH et HAS 2005 proposent d’évaluer le niveau de risque CV, en “croisant” la sévérité de l’HTA selon son grade manométrique et l’association de facteurs de risque CV (tableau 7). Ainsi on définit un niveau de risque CV faible, moyen, élevé ( voire très élevé) correspondant à une évaluation adaptée à la pratique clinique du risque de présenter une complication cardiovasculaire dans les 10 ans à venir, à savoir 30 %.
La société européenne de Cardiologie (recommandations ESC 2003) a mis à disposition une estimation informatisée du risque CV en fonction des pays (Nord et Sud de l’Europe), avec un seuil d’intervention situé à 5% à 10 ans, en terme de mortalité.
B. Le dépistage d’une HTA secondaire :
L’interrogatoire est un élément essentiel de l’approche clinique de l’HTA.
Il permet de situer des antécédents familiaux d’HTA et de complications cardiovasculaires non seulement chez les parents, mais également dans la fratrie en faveur d’une éventuelle origine génétique.
Il permet d’éliminer une cause toxique : réglisse, vasoconstricteurs nasaux, contraception oestroprogestative, alcool.
Il permet d’orienter vers une cause uronéphrologique, de suspecter une origine rénovasculaire athéromateuse devant une HTA récente chez un homme de la cinquantaine, tabagique, ou par fibroplasie de l’artère rénale chez une femme jeune avec une HTA persistante à l’arrêt du contraceptif et en l’absence d’antécédents familiaux .
On s’assure de l’absence de signes d’hypercorticisme, de paroxysmes tensionnels, de la triade céphalées tachycardie- sueurs.
Enfin il est essentiel de disposer d’une détermination de la kaliémie effectuée au laboratoire sans garrot avec une ponction franche pour ne pas méconnaître une hypokaliémie même limite , susceptible d’évoquer une HTA secondaire.
Le bilan de l’hypertendu peut aller du plus simple au plus compliqué et l’ensemble de ces examens ne saurait être systématique.
Les contraintes économiques et le “bon sens” ne sauraient d’ailleurs permettre un tel bilan .
Diagnostic étiologique
1. L’HYPERTENSION ARTERIELLE ESSENTIELLE :
Correspond à environ 90% des HTA;
Elle constitue un des éléments du risque cardiovasculaire, justifiant sa prise en charge thérapeutique.
Probablement une origine multifactorielle, avec une participation:
Des systèmes endocriniens, avec un rôle majeur du système Rénine Angiotensine Aldostérone
Du système nerveux autonome
De la fonction rénale, avec déficit d'excrétion sodée avec rôle probable du système hypothalamo-hypophysaire, via l'intervention d'hormones anti diurétiques
D'un facteur pariétal vasculaire, favorisant une hausse des résistances vasculaires périphériques
Génétiques
Ces inadaptations de mécanismes de régulation sont toutefois mineures,
Il faut retenir que la cause primaire de l'HTA essentielle est la surconsommation sodée.
En effet, la dose sodée journalière recommandée est de 6 g de NaCl, alors que la consommation dans les pays développés est évaluée entre 8 et 20 g par jour, avec des pics de consommation dans certaines populations pouvant atteindre 60 g/j.
L'étude INTERSALT et l'étude CARDIAC ont mis en évidence une très nette corrélation entre le niveau tensionnel d'une population et sa consommation sodée journalière.
D'autres études, interventionnelles (Kempner, DASH sodium), ont quant à elles démontré la causalité de l'apport sodé dans l'hypertension.
2. L’HYPERTENSION ARTERIELLE SECONDAIRE
L’HTA secondaire concerne 5 % des HTA.
L’ étiologie est surrénalienne, rénale ou toxique ;
Sa mise en évidence autorise un traitement spécifique pouvant permettre la cure de l’HTA.
Les HTA d’origine surrenalienne :
Le phéochromocytome :
Le phéochromocytome est une tumeur médullo-surrénalienne secrétante de catécholamines volontiers révélé par une HTA paroxystique ou permanente.
Bien que son incidence ne soit que de 0,5 % des hypertendus sa reconnaissance est d’une particulière importance du fait de son accessibilité à la chirurgie.
On doit prendre en compte la possibilité de formes familiales, de tumeurs multiples, bilatérales, extra surrénaliennes, voire extra abdominales.
Enfin, le phéochromocytome peut s’intégrer dans le cadre d’une néoplasie endocrinienne multiple ou d’une phacomatose (neurofibromatose de Recklinghausen et le syndrome de Von Hipple-Lindau)
Anatomie-Physiopathologie
Le phéochromocytome est une tumeur développée aux dépens du tissu chromaffine médullo-surrénalien.
Le terme est à réserver à la localisation surrénalienne, les formes extra surrénaliennes étant dénommées paragangliomes.
Typiquement, il s’agit d’une tumeur rouge sang virant à la couleur brune, d’aspect hétérogène avec flaques hémorragiques et parfois tissu nécrotique.
Au plan physiopathologique, les phéochromocytomes synthétisent la noradrénaline, l’adrénaline et la dopamine.
Les catécholamines en excès exercent leurs effets cardiovasculaires par la stimulation des récepteurs alpha et béta adrénergiques à l’origine de leur désensibilisation.
La conjonction de la désensibilisation des récepteurs alpha, et de l’hypovolémie, fréquente, peut être à l’origine d’une hypotension orthostatique.
Parallèlement, les activités enzymatiques impliquées dans le catabolisme des catécholamines sont réduites favorisant ainsi l’accumulation hormonale.
Le phéochromocytome est caractérisé par un grand polymorphisme clinique à l’origine d’un diagnostic souvent difficile.
La triade céphalées-palpitations-sueurs est caractéristique.
Son absence permet d’exclure le diagnostic avec une grande probabilité.
Les modifications de la PA sont généralement au devant la scène et orientent vers le diagnostic.
Il s’agit volontiers d’une labilité tensionnelle avec alternance de paroxysmes et d’hypotension, de modifications de la PA notées lors d’une anesthésie, d’une artériographie ou lors de l’établissement d’un traitement psychotrope.
Le phéochromocytome peut également évoluer sous le masque d’une HTA du diabète ou d’une HTA réfractaire ;
Enfin des troubles du rythme supraventriculaire ou ventriculaire, une insuffisance cardiaque et un œdème pulmonaire peuvent révéler le phéochromocytome.
HTA d’origine corticosurrénalienne :
1.L’hyperaldostéronisme primaire ou syndrome de Conn :
Il faut distinguer l’hyperaldostéronisme primaire tumoral (adenome de CONN) curable par surrénalectomie de l’hyperaldostéronisme qualifié d’idiopathique par hyperplasie surrénalienne bilatérale, généralement rebelle à la chirurgie.
Une forme génétique d’hyperaldostéronisme primaire rapportée à un gène chimérique de l’aldostérone synthase a été identifée, sensible à l’administration de Dexaméthasone, le “GRA” (glucocorticoïd remediable aldosteronism).
Classiquement évoqué en présence d’une HTA avec céphalées et asthénie,
elle est plus souvent à considérer devant une HTA mal contrôlée, réfractaire, notamment à l’usage des bétabloqueurs et des IEC.
L’orientation diagnostique dépend de la seule hypokaliémie obtenue par un prélèvement effectué sous régime normosodé après arrêt du traitement.
La mise en évidence de l’hypokaliémie sous traitement peut également être suggestive de ce diagnostic si elle s’avère anormalement importante pour une faible dose de diurétique ou si elle est constatée sous un traitement par IEC, et alors très inhabituelle.
2 Le syndrome de Cushing :
L’HTA au cours du syndrome de Cushing est estimée à 80% des cas , et concerne plus volontiers le carcinome surrénalien ou la sécrétion ectopique d’ACTH.
Pour l’expliquer, on évoque l’élévation de l’angiotensinogène sous l’influence des glucocorticoïdes (naturels et exogènes).
Le faible pouvoir minéralocorticoide du cortisol peut du fait de concentrations élevées, intervenir dans la réabsorption de sodium au niveau du tubule rénal proximal, à l’origine d’une augmentation du volume plasmatique ; en outre au cours du syndrome de Cushing ACTH-dépendant, des minéralocorticoides différents de l’aldostérone ont été mis en évidence tels que la déoxycorticostérone (DOC) et la corticostérone (B), susceptibles de favoriser le développement de l’HTA et d’expliquer l’hypokaliémie .
3. Les blocs enzymatiques cortico-surrenaliens de l’adulte
Les altérations de la stéroidogenèse par déficits enzymatiques partiels dépassent le cadre pédiatrique des blocs de la 11 et 17 hydroxylase;
ils peuvent être responsables chez l’ adulte de formes dissociées où l’HTA constitue la circonstance de découverte.
Le cas le mieux indivualisé est celui de la jeune femme, hypertendue modérée, porteuse de signes discrets d’hyperandrogénie et/ou d’un trouble de la fécondité, atteinte d’un bloc incomplet de la 11 bétahydroxylase.
Les hta d’origine toxique ou medicamenteuse:
L’HTA induite par les oestroprogestatifs :
La contraception oestroprogestative élève la PA des femmes normotendues et hypertendues.
Elle est en mesure de révéler une HTA essentielle génétique chez une jeune femme normotendue issue de parents hypertendus ou déjà porteuse d’une HTA limite.
Cette éventualité ne doit pas faire omettre la recherche d’une autre étiologie par exemple une fibrodysplasie de l’artère rénale, ou un adénome de Conn
normokaliémique.
La contraception oestroprogestative est à l’origine de quelques observations d’HTA malignes ; ailleurs l’HTA est généralement bénigne et peut céder après 3 mois d’interruption de l’oestroprogestatif.
HTA due aux vasoconstricteurs nasaux
Le tableau peut simuler un phéochromocytome avec une HTA paroxystique ou réfractaire, associée à un syndrome adrénergique.
C’est le cas de l’HTA induite par les vasoconstricteurs nasaux alpha 1 mimétiques (type DETURGYLONE® ou ATURGYL® ).
Hypercorticisme iatrogene
Un traitement glucocorticoide au long cours peut s’accompagner d’une HTA dans 20 % des cas, réalisant un tableau de Cushing iatrogène.
Intoxication à la glycyrrhizine
La réglisse simule un hyperminéralocortisisme ; elle est responsable d’une inhibition enzymatique de la 11 bétahydroxy-déshydrogénase, à l’origine d’une HTA avec hypokaliémie.
Les anti-inflammatoires non stéroidiens
Les anti-inflammatoires non stéroïdiens (AINS) constituent une cause fréquente de résistance au traitement de l’HTA chez les consommateurs chroniques (personnes âgées, rhumatismes inflammatoires).
La réduction de l’effet des antihypertenseurs est médiée par l’inhibition des prostaglandines rénales et vasculaires, et en cas de déplétion associée il existe un risque d’insuffisance rénale.
Enfin, on peut observer un tableau de néphropathie interstitielle chronique liée à la consommation prolongée d’AINS.