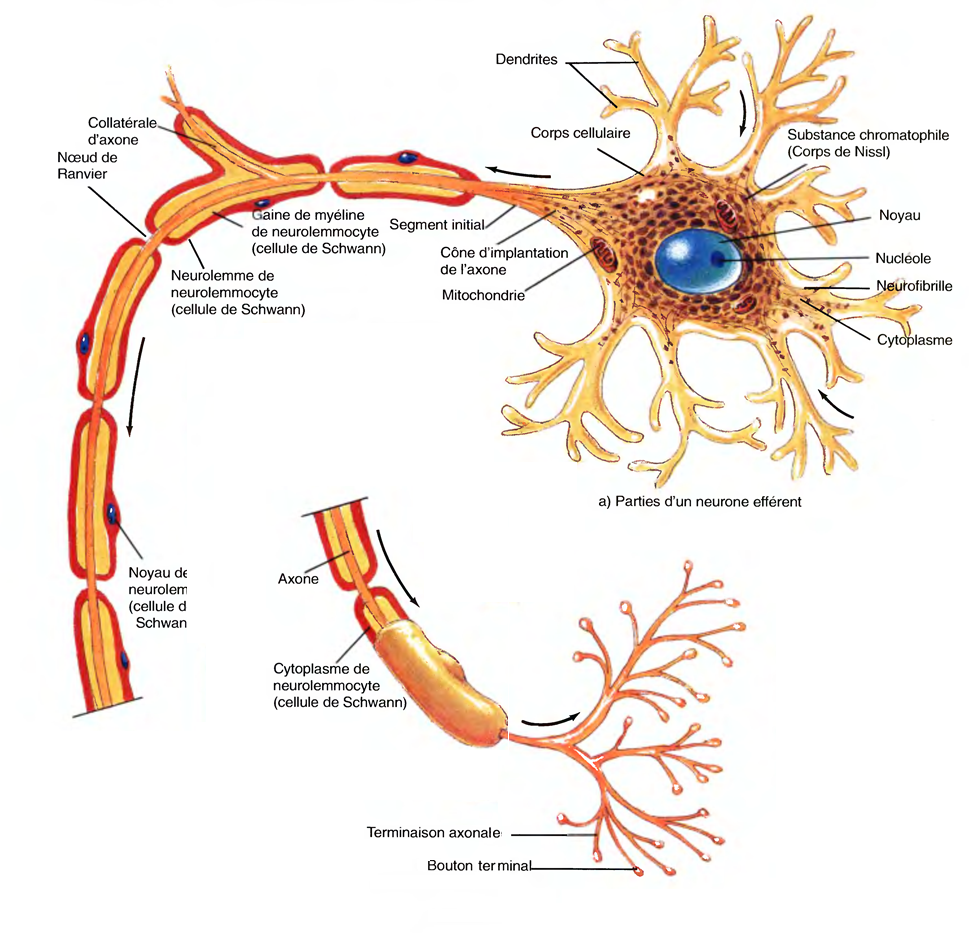
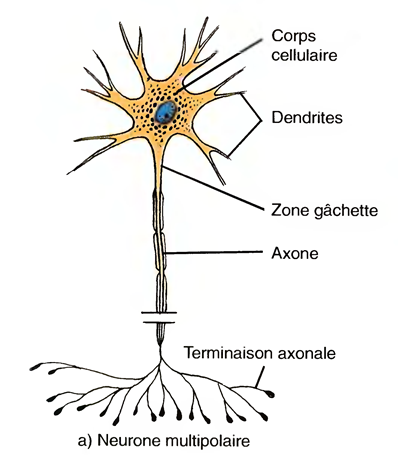
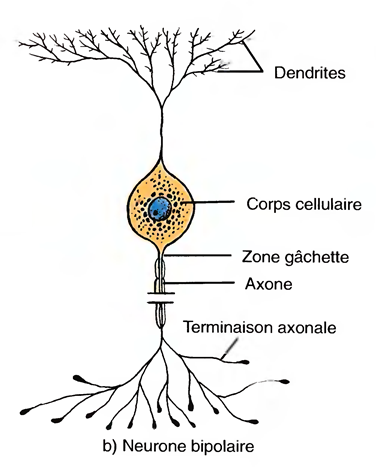
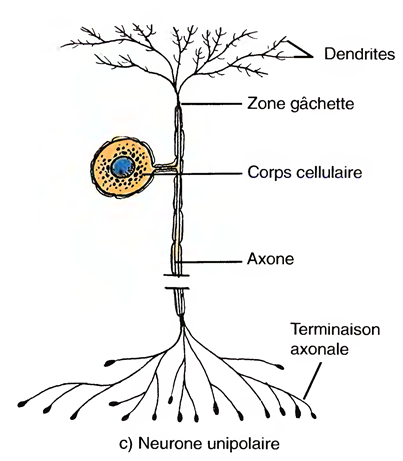
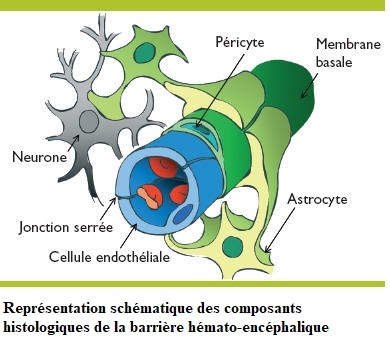
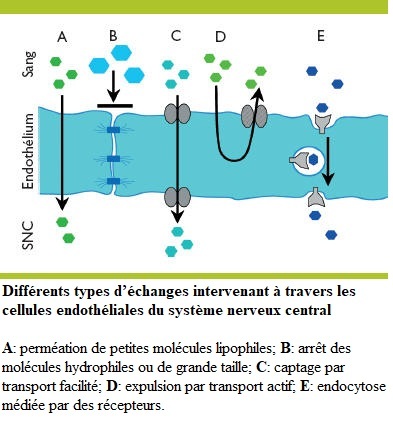
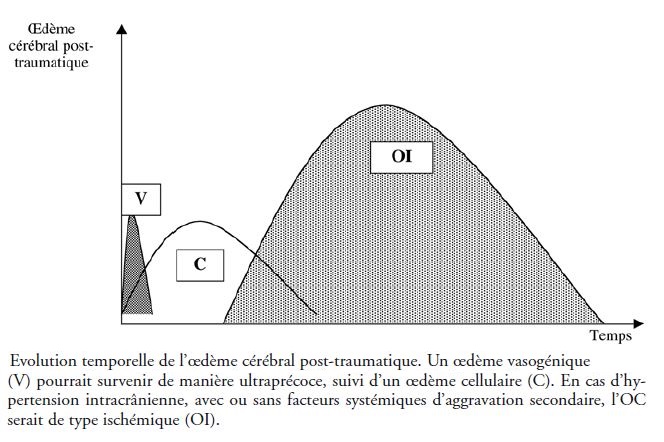
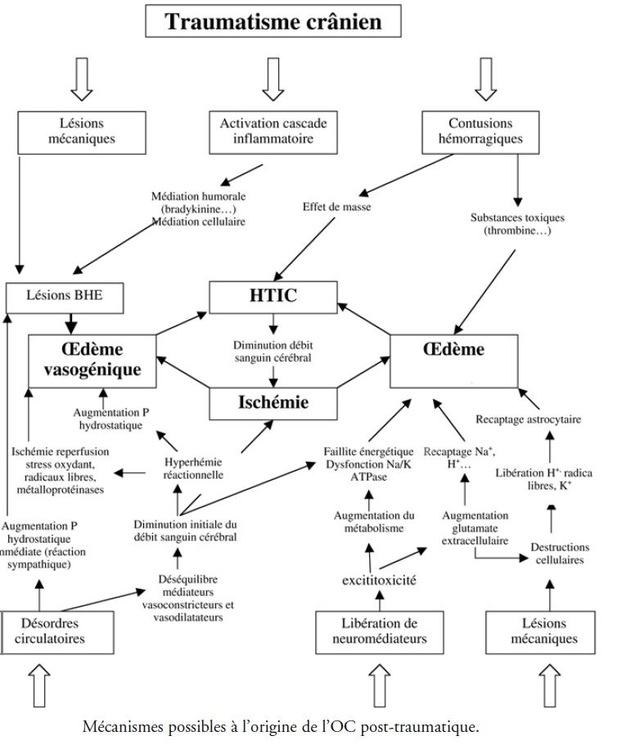
Le Sommeil Physiologique
Introduction
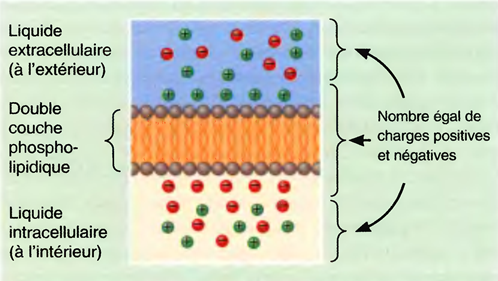
Dictionnaire médical- 2009 Elsevier Masson : État physiologique actif de restauration caractérisé par la suspension, périodique et réversible de la conscience et de la vie de relation et répondant à un besoin de repos de l’organisme.
Dictionnaire Larousse: État physiologique périodique de l'organisme (notamment du système nerveux) pendant lequel la vigilance est suspendue et la réactivité aux stimulations amoindrie.
Il existe un continuum entre les différents niveaux de vigilance, oscillant grossièrement entre la veille, le sommeil à ondes lentes et le sommeil paradoxal.
À chacun de ces états de vigilance correspond un certain niveau d’activité des structures corticales, lequel peut être étudié par l’EEG.
Il est important de préciser le rôle important du thalamus dans la genèse des ondes corticales.
En effet, l’enregistrement simultané de l’activité électrique d’un noyau thalamique et de celle de l’EEG de l’aire corticale de projection de ce noyau révèle le synchronisme de ces deux activités.
Les effets des différentes structures du système nerveux central sur l’état de vigilance s’exercent donc, dans une large mesure, directement ou indirectement en modulant la rythmicité des interactions entre le thalamus et le cortex.
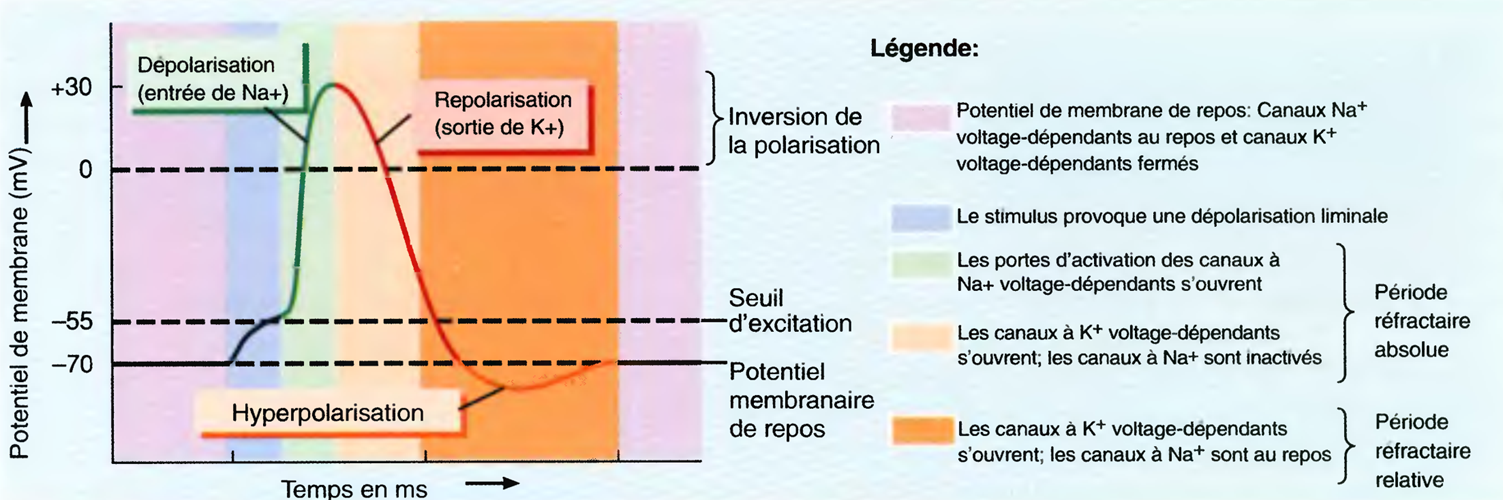
Globalement, le tracé EEG est d’autant plus rapide et désynchronisé que le niveau de vigilance est élevé .
À l’inverse, lors du sommeil lent, il est d’autant plus synchronisé que le sommeil est profond.
Ce synchronisme cortical est le reflet du fonctionnement du “pacemaker” thalamique qui n’apparaît que lorsque le noyau réticulaire du thalamus n’est plus soumis à l’action, directe ou indirecte par la formation réticulée, des afférences sensitives et sensorielles.
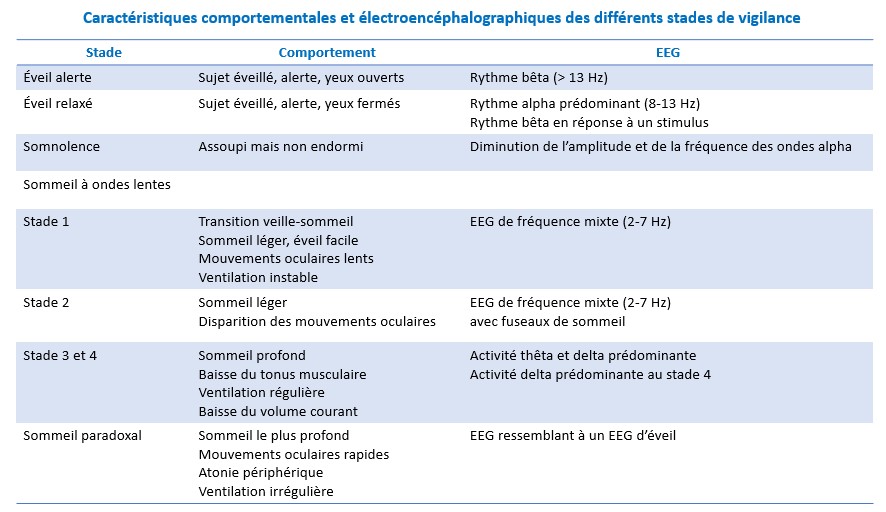
Structure du sommeil
Une classification précise du sommeil en différents stades a été élaborée en 1968 par Rechtschaffen et Kales.
Elle repose à la fois sur des données EEG , EMG et EOG (électro-oculographiques) et subdivise le sommeil en
sommeil à ondes lentes (comprenant lui-même 4 stades)
et en sommeil paradoxal
NB: Important à assimiler pour bien comprendre les bases du BIS
Sommeil à ondes lentes
Stade 1
Il s’agit d’un stade de transition veille-sommeil, caractérisé par une activité EEG de fréquence mixte (de 2 à 7 Hz) et de bas voltage. D’un point de vue comportemental, il existe, lors de la transition veille-sommeil, des mouvements oculaires lents signant une perte de contrôle volontaire de ces mouvements.
Stade 2
Ce stade est caractérisé par une nouvelle diminution de la fréquence des ondes EEG, par une augmentation de leur amplitude et par l’apparition périodique de bouffées d’ondes de haute fréquence (de 12 à 14 Hz) durant de 1 à 2 secondes appelées « fuseaux de sommeil ».
Ce stade est un stade de sommeil léger.
Stade 3
Il est défini par la présence d’ondes lentes delta (≤ 2 Hz) de grande amplitude. C’est un stade de sommeil profond.
Stade 4
Il est défini par la présence d’au moins 50 % d’ondes lentes delta. C’est le stade de sommeil le plus profond.
Les stades 3 et 4 sont souvent cotés ensembles en tant que sommeil lent profond (slow wave sleep des Anglo-Saxons).
Sommeil paradoxal
Après une période de sommeil à ondes lentes, l’EEG se modifie de façon radicale pour ressembler à un EEG de veille, traduisant le passage en sommeil paradoxal (ou REM-sleep pour rapid eye movement).
Il est défini par l’apparition concomitante d’une activité EEG de bas voltage et de fréquence mixte (de 2 à 7 Hz), de bouffées de mouvements oculaires rapides et d’une atonie musculaire.
L’EEG comprend également des ondes thêta pointues (ondes en « dents de scie ») et des séquences de rythme alpha (de 8 à 12 Hz).
Répartition temporelle des différents stades de sommeil
Un cycle de sommeil correspond à la succession d’une période de sommeil lent et d’une période de sommeil paradoxal.
La durée de ce cycle est de 60 à 90 minutes et une nuit de sommeil comprend 5 ou 6 cycles successifs.
Le sujet entre d’abord dans le stade 1 du sommeil à ondes lentes pendant quelques minutes, puis lui succède le stade 2 pendant 10 à 25 minutes. Les stades 3 et 4 suivent ensuite pour une durée de 20 à 40 minutes.
Le premier épisode de sommeil paradoxal survient alors pour une courte durée (entre 4 et 8 minutes), éventuellement précédé d’un bref retour au stade 2. Un nouveau cycle de sommeil commence ensuite.
La durée des différents stades de sommeil au sein d’un cycle de sommeil se modifie au cours de la nuit.
Ainsi, le sommeil lent profond (stades 3 et 4) se situe essentiellement pendant la première partie de la nuit, tandis que les derniers cycles sont plus riches en sommeil paradoxal.
Au total, le sommeil à ondes lentes représente de 75 à 80 % de la durée du sommeil (stade 1 : 5 %, stade 2 : 50 %, stades 3 et 4 : de 15 à 20 %).
Cycle circadien veille-sommeil et horloge biologique
L’« horloge » biologique est située dans l’hypothalamus antérieur.
Elle reçoit des afférences de photorécepteurs spécifiques.
C’est en modulant la sécrétion de mélatonine par la glande pinéale, ou épiphyse, qu’elle synchroniserait le cycle veille-sommeil avec le cycle lumière-obscurité.
Structures anatomiques et neurotransmetteurs impliqués dans l’éveil
Plusieurs structures semblent jouer un rôle important dans la régulation veille-sommeil :
les noyaux cholinergiques du tronc cérébral et du prosencéphale sous-frontal,
les projections histaminergiques de l’hypothalamus postérieur,
les noyaux noradrénergiques (en particulier du locus coeruleus) et les projections dopaminergiques et sérotoninergiques provenant du tronc cérébral.
L’influence de ses différentes structures est médiée en grande partie, mais non exclusivement, par le thalamus qui joue donc un rôle central.
1.Neurones cholinergiques
Particulièrement actifs lors de la veille mais aussi, lors du sommeil paradoxal.
Deux systèmes (neurones) cholinergiques s’intègrent ainsi dans le système d’éveil :
celui issu du tronc cérébral et projetant vers des structures sous-corticales, notamment thalamiques,
et celui du prosencéphale sous-frontal projetant également vers le thalamus mais aussi directement vers le cortex.
2.Norépinéphrine et locus coeruleus
Des neurones synthétisant de la norépinéphrine sont présents dans le locus coeruleus du tronc cérébral.
Ces neurones sont actifs lors de l’éveil et provoquent une activation corticale.
Cependant, le système noradrénergique paraît être ni indispensable ni suffisant pour entraîner une activation corticale et semble donc agir en association avec les autres structures du système d’éveil.
3.Sérotonine et raphé dorsal
Considérée dans les années 1960 comme le neurotransmetteur du sommeil, elle a ensuite été considérée comme un neurotransmetteur de l’éveil.
Les neurones du raphé dorsal et médian du tronc cérébral sont les sources principales de la sérotonine.
Les récepteurs impliqués sont 5-HT1A et 5-HT2, lesquels pourraient avoir une action différente.
La sérotonine pourrait par exemple moduler l’activité thalamique (dans le sens de l’éveil) via les récepteurs 5-HT2 . Ces récepteurs sont également présents au niveau des cellules corticales.
Les récepteurs 5-HT1A, notamment présents au niveau des dendrites des neurones sérotoninergiques (autorécepteurs), pourraient quant à eux favoriser le sommeil en diminuant la libération de sérotonine par ces mêmes neurones.
4.Histamine et noyau tubéro-mamillaire de l’hypothalamus postérieur
L’action de l’histamine au niveau du SNC est médiée par les récepteurs postsynaptiques H1 et H2 d’une part, et par les autorécepteurs H3 contrôlant la synthèse et la libération d’histamine d’autre part.
Exclusivement produit par les neurones du noyau tubéro-mamillaire situés dans l’hypothalamus postérieur.
Projections sont extrêmement larges, notamment vers les structures jouant un rôle important dans le contrôle de l’état de vigilance comme le cortex, le thalamus, l’aire préoptique de l’hypothalamus antérieur, et les structures mono-aminergiques et cholinergiques du tronc cérébral et du prosencéphale.
Activation corticale directe ou indirecte, respectivement par les projections corticales et par le système thalamo-cortical, et activation d’autres structures d’éveil comme le système cholinergique.
5.Dopamine et éveil comportemental
Les neurones produisant de la dopamine sont abondants dans le locus niger, dans le tegmentum, dans l’hypothalamus postérieur et dans plusieurs noyaux du tronc cérébral. Ils projettent notamment vers le striatum, le cortex frontal et le thalamus.
Favorise l’éveil cortical et surtout comportemental.
Les mécanismes de modulation du cycle veille-sommeil par la dopamine sont cependant complexes et encore mal connus.
6.Hypocrétines (orexines) et activation des systèmes aminergiques de l’éveil
De découverte récente, les hypocrétines 1 et 2 (Hcrt-1 et Hcrt-2, également appelées orexines A et B) sont deux neuropeptides issus du même précurseur dont la synthèse est exclusivement assurée par des neurones de l’hypothalamus latéral et postérieur
Nombre limité à seulement quelques milliers mais très larges projections vers les différentes régions du SNC.
Rôle des neurones hypocrétinergiques et du noyau préoptique ventro-latéral dans la régulation veille-sommeil, en « orchestrant » l’activité des différents systèmes d’éveil.
D’un point de vue physiopathologique, les hypocrétines ont été impliquées dans la narcolepsie.
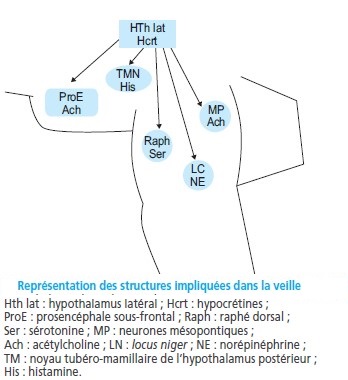
Les structures sous-tendant l’éveil sont centrées sur le système réticulaire activateur ascendant du tronc cérébral.
Les neurones de cette structure projettent sur l’hypothalamus postéro-latéral, le système thalamique et le prosencéphale sous-frontal.
Grâce à leurs projections, ces trois formations anatomiques peuvent entraîner une activation corticale.
Ces différentes structures de l’éveil agissent donc en association et sont largement interconnectées.
Régulation du sommeil
Contrôle du sommeil lent : rôle de l’hypothalamus
Des neurones du noyau préoptique ventro-latéral de l’hypothalamus antérieur particulièrement actifs pendant le sommeil lent produisent de l’acide gamma-amino-butyrique (GABA) et de la galanine, neurotransmetteurs inhibiteurs, inhibant ainsi grâce à leurs projections les différentes structures de l’éveil (noyau tubéro-mamillaire histaminergique, locus coeruleus noradrénergique, raphé dorsal sérotoninergique, noyaux cholinergiques mésopontins).
Réciproquement, ces neurones GABAergiques sont inhibés par le système d’éveil mono-aminergique (noradrénergique et sérotoninergique) et cholinergique.
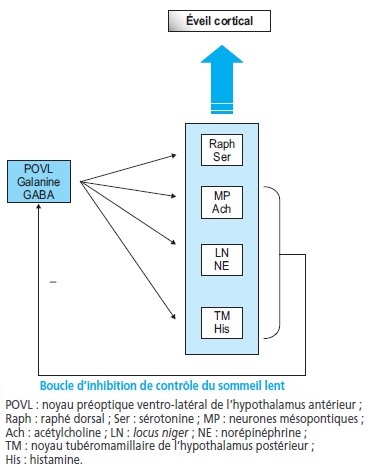
Contrôle du sommeil paradoxal
Deux populations de neurones mises en jeu dans l’alternance sommeil à ondes lentes-sommeil paradoxal ont été décrites :
les neurones cholinergiques de la jonction pont-mésencéphale, appelés neurones « SP-on » car actifs lors du sommeil paradoxal,
et les neurones noradrénergiques et sérotoninergiques (« SP-off »), situés respectivement dans le locus coeruleus et dans le raphé dorsal, inactifs lors du sommeil paradoxal.
Ces deux populations de neurones s’inhiberaient mutuellement.
Neuromodulateurs favorisant le sommeil
Action de l’adénosine sur le système cholinergique et le noyau préoptique ventro-latéral de l’hypothalamus
L’adénosine est un nucléoside issu de la dégradation de l’adénosine triphosphate (ATP), principal substrat énergétique du système nerveux.
La veille, période de grande activité cellulaire cérébrale, s’accompagne donc d’une consommation importante d’ATP avec accumulation progressive d’adénosine.
Il a été dit que l’adénosine avait des propriétés « somnogènes », participant ainsi à la survenue du besoin de dormir en fin de journée.
Une des fonctions du sommeil serait alors la reconstitution du stock énergétique cérébral.
Par ailleurs, l’adénosine augmente l’excitabilité des neurones du noyau préoptique ventro-latéral de l’hypothalamus, structure qui, comme nous l’avons vu, favorise le sommeil en inhibant par ses projections les structures d’éveil.
Tout ceci permet de proposer un schéma de modulation veille-sommeil ou l’adénosine aurait un rôle important :
elle favoriserait l’induction du sommeil par inhibition du système d’éveil cholinergique d’une part,
et par désinhibition des neurones du noyau préoptique ventro-latéral de l’hypothalamus d’autre part.
Prostaglandines D2 (PGD2).
En effet, les fluctuations de ses concentrations dans le liquide céphalo-rachidien sont parallèles au cycle veille-sommeil.
L’induction du sommeil est un phénomène actif, lié à l’inhibition des systèmes cholinergiques et monoaminergiques du système d’éveil par les neurones galalinergiques et GABAergiques du noyau préoptique ventro-latéral de l’hypothalamus antérieur.
La transition sommeil à ondes lentes-sommeil paradoxal est liée à l’interaction de deux systèmes s’auto-inhibant : un système cholinergique facilitateur du sommeil paradoxal, situé à la jonction pont-mésencéphale, et un système noradrénergique et sérotoninergique inhibiteur du sommeil paradoxal.
Plusieurs neuromodulateurs favorisent par ailleurs l’induction du sommeil. L’adénosine inhibe le système cholinergique. La libération d’adénosine pourrait elle-même être favorisée par l’action de la PGD2.
Rôles du sommeil
Le sommeil indispensable à la survie et, en outre il est impliqué dans les phénomènes de mémorisation et de plasticité cérébrale.
En effet , Il est désormais admis qu’au-delà des premières années de vie, la neurogenèse se poursuit chez l’adulte au sein de zones cérébrales spécifiques, notamment au niveau de l’hippocampe, structure cérébrale pivot de la mémorisation et du repérage spatial.
Il à un impact sur le plan immunologique, endocrinien et cardiovasculaire.
La privation prolongée de sommeil chez l’homme peut entraîner la survenue d’hallucinations, de convulsions, une instabilité émotionnelle, voire l’apparition de troubles psychotiques.
Sommeil et Anesthésie Générale
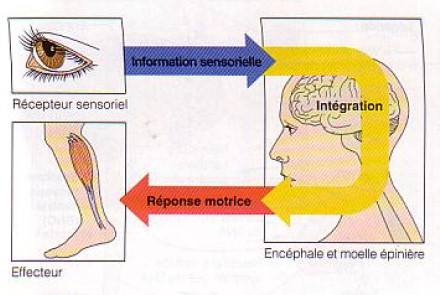
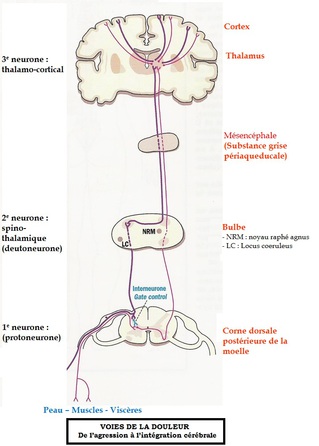
Le Système Réticulaire Activateur Ascendant (SRAA), localisé dans le tronc cérébral, reçoit les informations sensorielles. Il se projette sur 3 structures (thalamus, hypothalamus et le cerveau basal antérieur) et active les structures corticales.
Il existe 3 stades de vigilance :
Veille ;
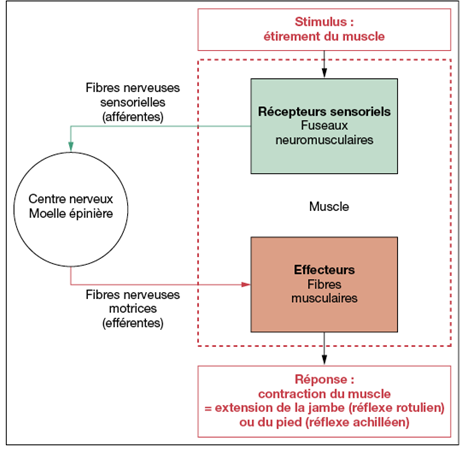
Sommeil Ondes Lentes (SOL) : son rôle « réparateur » sur la somnolence et la fatigue permet la reconstitution des réserves (↓ métabolisme) et la sécrétion d'hormones de croissance :
stade d'endormissement (5 %) : ↓ FC qui est régulière, quelques apnées, quelques mouvements oculaires, tonus musculaire (fréquence : 2–7 Hz),
stade sommeil léger (50 %) : FC régulière, quelques apnées, ↓ fréquence des ondes EEG, pas de mouvement oculaire, ↓ tonus,
stade sommeil profond et
stade plus profond (25 %) : FC et FR stables, pas de mouvement oculaire, faible tonus ;
Sommeil paradoxal (20 %) : son rôle est la réactivation des comportements innés, et l'apprentissage : stockage dans la mémoire à long terme (EEG en veille, mouvements oculaires rapides, atonie musculaire) : FC et FR irrégulières.
La mélatonine a une influence sur la qualité et la durée du sommeil et dans la régulation d'autres rythmes circadiens, ce qui peut expliquer les troubles du sommeil post-opératoires.
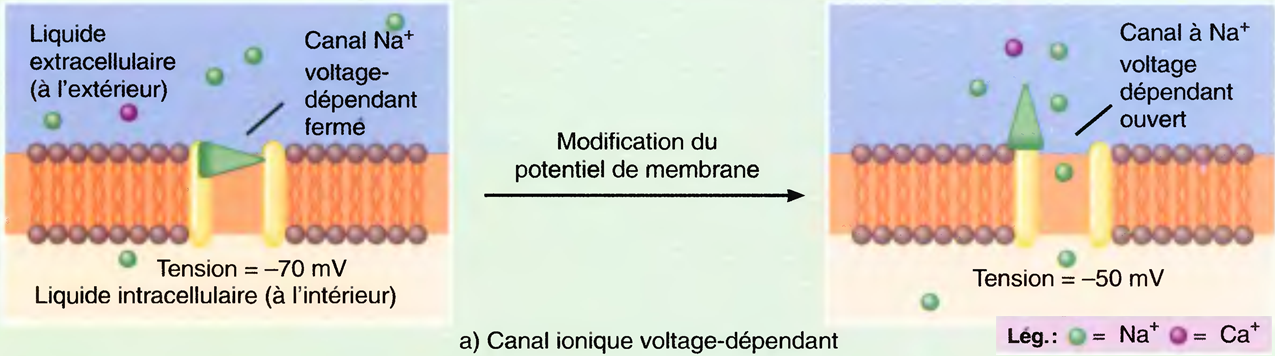
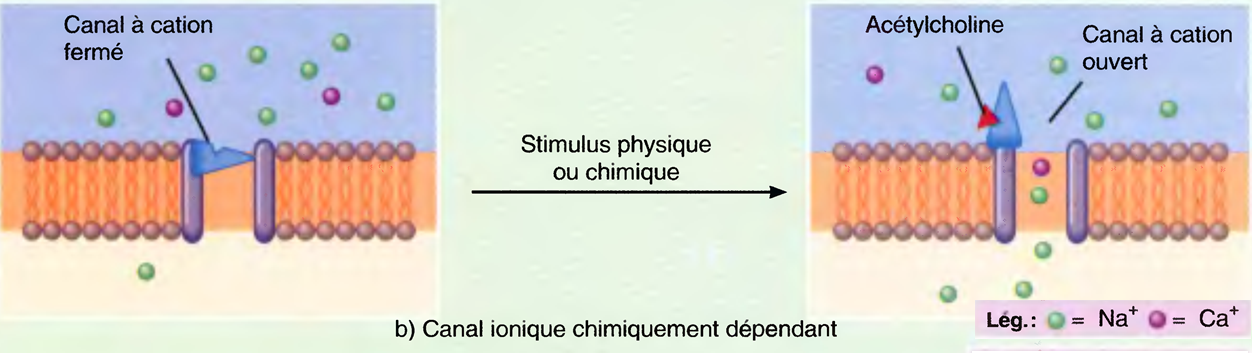
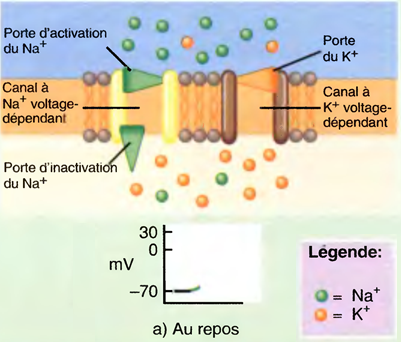
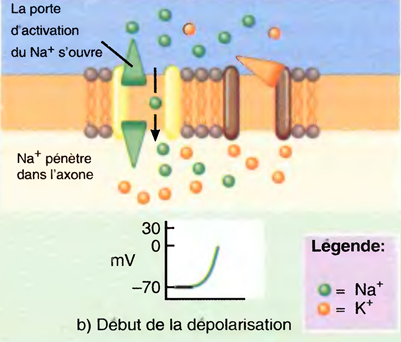
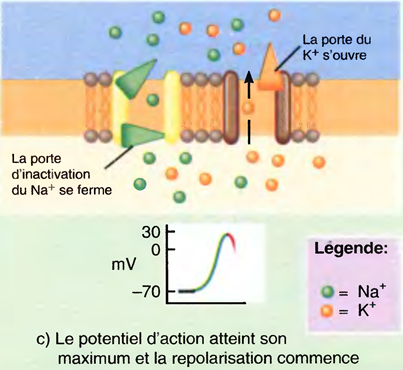
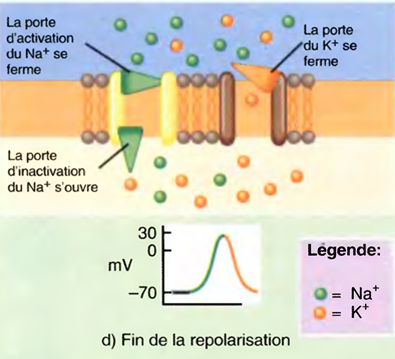
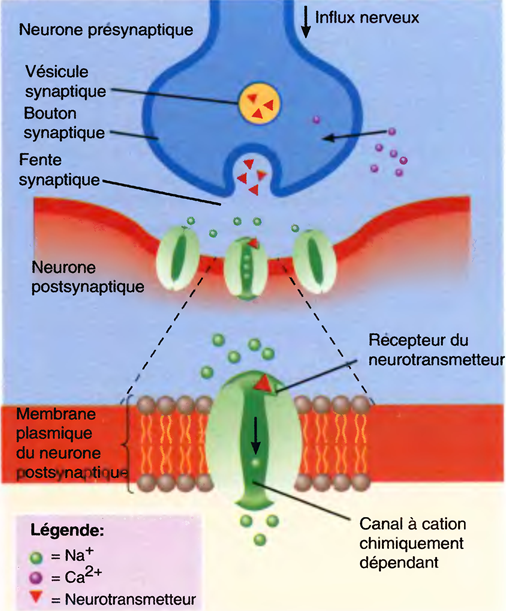
L'induction du sommeil (par les anesthésiques) provoque l'inhibition des systèmes d'éveil cholinergique et noradrénergique par les neurones GABAergiques de l'hypothalamus antérieur : ↓ de l'activation corticale. Tous les anesthésiques (sauf la Kétamine®) potentialisent les effets du GABA sur les récepteurs.
L'indice bispectral de l'EEG (BIS) est issu d’une analyse informatisée du signal EEG associant plusieurs fonctions. Ces mesures sont combinées par un algorithme afin :
d'optimiser la corrélation entre EEG et effets cliniques de l'anesthésie,
et de quantifier l'index BIS au moyen d’une zone de valeurs (anesthésie optimale : 40–60).
Son objectif est d'éviter le surdosage d'hypnotiques (hypoTA, apnée, coût, NVPO, durée en SSPI, surmortalité) et le sous-dosage (hyper TA, laryngospasme, mémorisation)
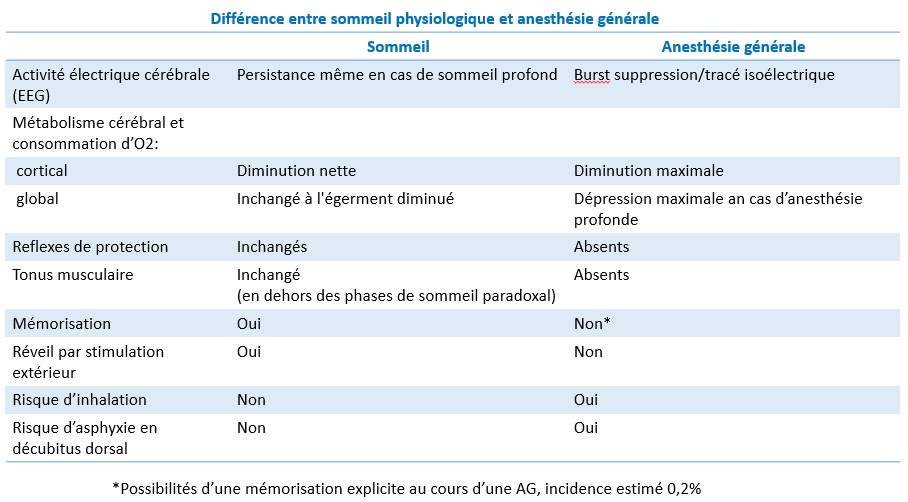
L’état du sommeil physiologique est très différent de celui d’une anesthésie générale,
La différence réside dans le fait qu’une AG déprime quasiment toute l’activité électrique du cerveau, alors que le sommeil n’affecte que les seuls composantes corticales.
Le métabolisme fonctionnel est aboli en anesthésie profonde, seul le métabolisme basal cellulaire, indispensable pour la survie persiste.
Lors de l’anesthésie comme pour les coma, aucune impression sensorielle externe n’est perçue, les stimulus d’éveil perdent leurs efficacité.
La perte de tonus des muscles du plancher buccal, provoque en décubitus dorsal, une chute de la langue en arrière avec obstructions des voies aériennes supérieurs (risque d’asphyxie).
Troubles du sommeil de l’enfant et de l’adulte
INSOMNIES ET HYPNOTIQUES
Définition
Étymologiquement, le terme « insomnie » signifie absence de sommeil. Mais il n’existe pas d’insomnie à proprement parler.
En moyenne, les « insomniaques » ont un temps total de sommeil et une stabilité de sommeil moindres que les « bons dormeurs », mais avec un très large recouvrement entre les deux groupes, de telle sorte qu’individuellement la structure du sommeil ne permet pas de différencier un « insomniaque » d’un « bon dormeur ».
La définition de l’insomnie est donc purement subjective. Il y a insomnie quand le sujet ressent son sommeil comme difficile à obtenir, insuffisant ou non récupérateur.
=> aucun examen complémentaire de confirmation diagnostique : les examens complémentaires et, notamment, les enregistrements polygraphiques au cours du sommeil n’ont d’intérêt que pour la recherche d’une étiologie particulière.
On différencie deux types d’insomnie :
les insomnies transitoires ou occasionnelles
et les insomnies chroniques qui posent des problèmes diagnostiques et thérapeutiques très différents.
Insomnie transitoire
L’insomnie transitoire fait partie de la vie normale mais parfois risque de se pérenniser ;
En rapport avec des causes occasionnelles réversibles :
une mauvaise hygiène de sommeil ;
des facteurs environnementaux : niveau sonore, climat, altitude… ;
un stress psychique : contrariété, deuil, contraintes… ;
un stress physique : contrainte liée à une affection physique, douloureuse;
un phénomène de rebond à l’arrêt d’un traitement tranquillisant ou hypnotique ;
une prise aiguë de toxiques.
Insomnie chronique
On différencie les insomnies chroniques
d’origine physique,
d’origine psychique
et les insomnies persistantes primaires (les plus fréquentes) qui ne reconnaissent pas de cause spécifique.
1.Insomnie chronique d’origine physique
Certaines dyssomnies :
mouvements périodiques du sommeil,
impatience des membres inférieurs à l’éveil,
syndrome d’apnées du sommeil
Sont plus souvent responsables de somnolence diurne, et décrites dans le chapitre correspondant.
D’autres étiologies sont le plus souvent facilement identifiées :
pathologies douloureuses ou inflammatoires, notamment cancéreuses et rhumatismales ;
maladies neurologiques (Parkinson, démences, etc.) ;
toxiques (alcool entre autres).
2.Insomnie chronique d’origine psychique
Se sont les affections psychiatriques :
Les troubles thymiques :
Dépression : l’insomnie est une plainte précoce du dépressif, souvent associée à une clinophilie (il « se réfugie » dans son lit) ;
Etat maniaque, avec une difficulté d’endormissement et une diminution du temps de sommeil dont le patient ne se plaint pas habituellement ;
Les troubles anxieux : une des causes les plus importantes ;
Les psychoses : l’insomnie se voit surtout lors des épisodes féconds, dont elle est d’ailleurs un signe précoce ;
Les démences où il y a une « inversion du rythme nycthéméral » avec somnolence diurne et éveil nocturne.
3.Insomnie persistante primaire
C’est l’insomnie « maladie », appelée aussi insomnie « psychophysiologique ».
L’insomnie est souvent apparue à un moment précis dans l’histoire du patient à l’occasion d’un deuil, d’une séparation ou d’une autre circonstance pénible, mais le retour au sommeil normal ne se produit pas, même lorsque la cause occasionnelle a disparu.
Elle comporte des difficultés d’endormissement et un trouble du maintien du sommeil, le sommeil devient une appréhension.
Le sommeil est perçu comme non réparateur, mais paradoxalement, et malgré l’impression de fatigue, il n’y a pas de somnolence diurne ; les tentatives de sieste « réparatrice » échouent en raison de la même difficulté d’endormissement que pour le sommeil de nuit ; la présence d’une somnolence est un argument contre le diagnostic d’insomnie persistante primaire et doit faire rechercher une étiologie spécifique. démontre l’absence de perturbation.
Diagnostic différentiel
Erreur d’hygiène de sommeil : l’augmentation du temps passé au lit
Troubles du rythme circadien :
le syndrome de retard de phase ;
le syndrome d’avance de phase, rare ;
les vols transméridiens ;
le travail posté (les « 3 huit »).
Bilan et conduite à tenir
1.Interrogatoire
Reconstituer l’histoire actuelle et passée du patient, la chronologie et les mécanismes de l’insomnie ;
Laisser le patient se raconter et raconter comment, où, dans quel environnement il s’endort (par exemple, rechercher s’il s’endort en regardant la TV dans son lit, quel type d’activité il a dans la soirée, comment il ménage la transition de la veille au sommeil…, etc.) ;
Cerner le contexte psychique du patient ;
Définir son environnement, ses habitudes, les contraintes auxquelles il est soumis ;
Répertorier ses antécédents, tant pathologiques que thérapeutiques ;
Rechercher une pathologie du sommeil (notamment un syndrome d’impatience des membres inférieurs ou un syndrome d’apnées du sommeil).
Tenue d’un agenda de sommeil→ appréciation de l’écart entre le regard du patient et la réalité.
2.Examens complémentaires
a)Enregistrement actimétrique:
Au moyen d’un accéléromètre porté au poignet, il permet d’établir le rythme activité-repos sur plusieurs semaines et donc d’objectiver les données (subjectives) de l’interrogatoire ou de l’agenda de sommeil.
b)Polysomnographie au laboratoire
Elle n’apporte guère de renseignements, d’autant que le patient affirme (souvent à raison) qu’il a passé au laboratoire une nuit d’une exceptionnelle bonne qualité. Ils ne sont indiqués que si l’on suspecte une étiologie spécifique.
Traitement
1.Traitement étiologique
Lorsqu’une étiologie est identifiée (syndrome des apnées du sommeil, des mouvements périodiques du sommeil, maladie psychiatrique ou organique…, etc.).
2.Traitement symptomatique
L’hypnotique idéal :
doit entraîner une induction rapide de sommeil ;
doit maintenir le sommeil pendant au moins 7 heures ;
doit respecter l’architecture du sommeil ;
ne doit pas avoir d’effet résiduel (au réveil, pendant la journée) ;
ne doit pas induire d’accoutumance ni de tolérance ;
ne doit pas induire de syndrome de sevrage ;
doit avoir une bonne marge de sécurité ;
ne doit pas avoir d’interactions médicamenteuses.
Aucun hypnotique ne réunit toutes ces propriétés : l’hypnotique idéal n’existe pas.
BEZODIAZEPINES à 1/2t courtes ou analogues (zolpidem, Stilnox® et zopiclone, Imovane®)
Approche cognitivo-comportementale
SOMNOLENCE EXCESSIVE ET TROUBLES DE L’ÉVEIL
Préoccupation médicale d’émergence relativement récente
On lui a attribué certaines des catastrophes majeures qui ont menacé la survie et l’équilibre écologique de tout ou partie de notre planète (Three Mile Island, Tchernobyl, Exxon-Valdez) et elle est responsable de nombreux accidents (les endormissements sont actuellement la première cause d’accidents sur les autoroutes).
Définition de la somnolence
1.Approche subjective
La première définition proposée était entièrement introspective, fondée sur l’impression du sujet, qui était le seul à pouvoir évaluer sa somnolence.
2.Approche objective
On peut définir la somnolence par la survenue d’un endormissement objective. un endormissement est pathologique lorsqu’il se produit « anormalement » rapidement dans des circonstances standardisées ou lorsqu’il se produit dans des circonstances inappropriées
Évaluation
Témoignage du sujet et de son entourage
L’interrogatoire accident ou incident lié à la somnolence lui en ait fait prendre conscience.
Questionnaires: questionnaire d’Epworth
Techniques instrumentales utilisant l’EEG
Causes de la somnolence
1.Sommeil insuffisant ou perturbé :
perturbations socioprofessionnelles (environnement, travail posté, vols transméridiens, restriction de sommeil…) ;
perturbations pathologiques (douleurs, cancers…) ;
événements pathologiques liés au sommeil : syndrome d’apnées du sommeil, mouvements périodiques du sommeil.
2.Pathologie intrinsèque touchant les mécanismes générateurs du sommeil :
narcolepsie-cataplexie ;
hypersomnie idiopathique.
Syndrome des apnées du sommeil (SAS) et syndrome de résistance des voies aériennes supérieures (SRVAS)
1. Définitions
Une apnée est une interruption de la ventilation ; par convention, on ne prend en compte chez l’adulte que les apnées d’une durée minimum de 10 secondes.
Une hypopnée est une diminution de la ventilation d’une durée minimum de 10 secondes.
On peut définir différents types d’événements respiratoires (hypopnées ou apnées) suivant qu’ils s’associent ou non à une interruption des efforts respiratoires.
Le syndrome de résistance des voies aériennes supérieures est une variante du SAOS : il se traduit par une augmentation progressive de l’effort respiratoire, mais :
sans variation du débit oronasal ;
sans hypoxémie ;
suivie d’un microéveil qui permet la normalisation de la respiration, mais fragmente le sommeil.
2. Physiopathologie du SAOS
Le pharynx peut être assimilé à un tuyau mou, interposé entre deux segments rigides, les fosses nasales et l’arbre trachéobronchique.
À l’inspiration, la pression s’exerçant sur les parois pharyngées est négative, d’où une tendance au collapsus du pharynx durant l’inspiration.
Tout dépend alors de la manière dont se font les interactions entre le système du sommeil et le système respiratoire.
Chez le ronfleur simple, le rétrécissement pharyngé est responsable d’un écoulement d’air turbulent générateur de vibrations, source de bruit : le ronflement.
S’il s’y associe une augmentation de l’effort respiratoire, celui-ci peut, en l’absence de diminution de la ventilation (sans hypopnée ou apnée), constituer un stimulus éveillant, responsable d’une fragmentation du sommeil et d’une somnolence diurne : c’est le syndrome de résistance des voies aériennes supérieures.
Dans les syndromes d’apnées du sommeil « classique », le collapsus est complet, il y a interruption du débit : c’est une apnée.
Comme au cours du SRVAS, c’est l’augmentation de l’effort respiratoire (de lutte contre l’obstacle que constituent les voies aériennes supérieures collabées), qui est responsable de l’éveil.
Cet éveil est à la fois salutaire, car il permet la reprise respiratoire, mais aussi délétère, car il fragmente le sommeil, du fait de la répétition des apnées qui sont couramment plusieurs centaines au cours d’une nuit.
3. Clinique
a) Signes fonctionnels
L’association somnolence diurne + ronflement doit à elle seule faire suspecter un SAS.
La somnolence diurne est parfois majeure, responsable d’endormissements intempestifs dans des circonstances très diverses, mais parfois modérée, voire absente ou niée par le patient qui a souvent oublié ce qu’est une vigilance normale et ne percevra l’importance de ces symptômes qu’après leur disparition sous traitement.
Le ronflement est sonore, souvent très ancien, et l’entourage observe souvent l’interruption répétée du ronflement à l’occasion des apnées, suivie d’une reprise respiratoire, particulièrement sonore, et accompagnée d’une agitation.
Il existe d’autres symptômes moins spécifiques :
troubles cognitifs (mémoire, attention, fonctions exécutives) ;
troubles du caractère (irritabilité) ;
problèmes sexuels (baisse de la libido) ;
sommeil agité ;
sudation nocturne ;
polyurie nocturne, énurésie (rare chez l’adulte) ;
céphalées matinales.
b) Examen clinique
70% des patients atteints de SAS sont obèses .
On retrouve le plus souvent un morphotype particulier, bréviligne, avec un cou court, épais, et une conformation mandibulaire particulière avec micrognathie et/ou rétrognathie, en particulier chez les patients qui ne sont pas obèses.
50 % des cas, s’y associe aussi une HTA => impact cardio-vasculaire
4. Diagnostic
Repose sur l’enregistrement polygraphique du sommeil
5. Épidémiologie du SAOS
2 et 5 % de la population générale adulte.
L’affection a une très forte prédominance masculine (de l’ordre de 90 %)
6. Traitement
Outre la correction des facteurs aggravants (réduction pondérale, arrêt des benzodiazépines et de l’alcool), le traitement du SAOS repose essentiellement, à l’heure actuelle, sur la pression positive continue (PPC)
L’uvulo-palatopharyngoplastie (UPPP) a été proposée mais effet inconstant
Le traitement chirurgical maxillofacial
La correction d’une hypertrophie amygdalienne et/ou d’une déviation de la cloison nasale peut être un élément thérapeutique adjuvant, voire suffisant chez l’enfant
Impatience des membres inférieurs (IMI) et mouvements périodiques du sommeil (MPS)
1. Impatience des membres inférieurs
Définition et aspects cliniques
caractérisé par :
oune compulsion à bouger les membres inférieurs souvent associée à (ou causée par) des paresthésies ;
maximum au repos et à l’inactivité (le plus souvent assis ou couché) ;
soulagée ou améliorée par le mouvement (marche ou étirement, au moins tant que dure l’activité) ;
maximum le soir ou la nuit (au moins au début, indépendamment du niveau d’activité).
La physiopathologie reste mal comprise
2. Mouvements périodiques du sommeil (MPS)
Définition et aspects cliniques :
Les MPS sont de constatation fréquente dans la population générale (environ 5 %) et leur prévalence augmente de façon importante avec l’âge.
Il s’agit de mouvements brefs stéréotypés des membres inférieurs, plus rarement des membres supérieurs, qui se répètent au cours du sommeil, à intervalles réguliers habituellement compris entre 15 et 40 secondes.
Ils surviennent en général par épisodes d’une durée de quelques minutes à plusieurs heures
3. Explorations complémentaires
Le diagnostic de MPS repose sur l’enregistrement polygraphique nocturne comportant un électromyogramme des muscles jambiers antérieurs qui objective les mouvements en flexion à prédominance distale.
4. Traitement
Les benzodiazépines ont un effet encore discuté et ne nous paraissent pas souhaitables pour une utilisation au long cours.
L’action thérapeutique des opiacés est connue de longue date dans le syndrome des jambes sans repos et a été démontrée ensuite dans les MPS, mais leur utilisation est délicate.
La L-Dopa, à une dose de 50 à 200 mg par jour, ou les agonistes dopaminergiques, tels que la bromocriptine, le piribédil, le ropinirole, ou le pramipexole sont également actifs
Narcolepsie-cataplexie (syndrome de Gelineau)
1. Définition
La narcolepsie est une somnolence diurne excessive comportant des accès de sommeil quasi irrépressibles qui surviennent par vagues au cours de la journée.
2. Physiopathologie
D’origine au moins en partie génétique.
Une atteinte des neurones hypocrétinergiques hypothalamiques y joue un rôle fondamental.
Elle peut être vue comme une maladie du sommeil paradoxal, notamment :
la cataplexie comme une intrusion de l’atonie musculaire en pleine veille ;
les paralysies hypnagogiques et hypnopompiques comme une intrusion de l’atonie musculaire à la jonction veille-sommeil ;
les hallucinations hypnagogiques comme une intrusion de l’imagerie des rêves.
Mais c’est aussi une maladie du sommeil lent :
dyssomnie par fragmentation du sommeil lent ;
les épisodes narcoleptiques ne correspondent pas toujours à des endormissements en sommeil paradoxal, et n’impliquent parfois que le sommeil lent.
3. Diagnostic clinique
La tétrade narcoleptique
a) Les attaques de cataplexie sont des accès de résolution du tonus musculaire
b) Les paralysies du sommeil surviennent au moment de l’endormissement (hypnagogiques) ou du réveil (hypnopompiques).
c) Les hallucinations hypnagogiques
d) une dyssomnie : le sommeil est en effet souvent de mauvaise qualité
4. Épidémiologie
La prévalence de la narcolepsie-cataplexie est d’environ 50 pour 100 000 habitants, du même ordre que la sclérose en plaques.
L’affection débute habituellement dans la 2e décennie.
Elle est très largement sous-diagnostiquée.
5. Traitement
Siestes programmées, qui permet de restaurer plus ou moins durablement la vigilance.
Elle peut également être combattue par divers produits stimulants.
Le modafinil (Modiodal®)
Les amphétaminiques (Ritaline®) ne sont utilisés qu’en cas d’échec du modafinil
Petites doses d’antidépresseurs (tricycliques ou inhibiteurs de recapture de la sérotonine, indications hors AMM).
Hypersomnie idiopathique
1. Tableau clinique
Sommeil nocturne anormalement prolongé suivi d’une très grande difficulté à se réveiller (ivresse du sommeil), survient en général chez des sujets jeunes.
2. Diagnostic
Le diagnostic repose avant tout sur l’interrogatoire, complété par un agenda de sommeil
3. Traitement
Répond particulièrement bien au traitement par Modiodal®
MANIFESTATIONS MOTRICES PAROXYSTIQUES DU SOMMEIL
1. Manifestations épileptiques
a) Crises partielles ou généralisées : présentes au cours de la veille peuvent aussi survenir pendant le sommeil et ne sont pas différentes des crises comitiales survenant lors de la veille.
b) Dystonie paroxystique nocturne (DPN) : Dénommée également éveils paroxystiques ou déambulations nocturnes épisodiques, sa description est relativement récente (une dizaine d’années). Initialement considérée comme une nouvelle forme de parasomnie, reconnue aujourd’hui comme une forme d’épilepsie frontale, dont les crises su rviennent exclusivement au cours du sommeil.
2. Parasomnies
« Parasomnie » signifie à côté du sommeil. Les parasomnies regroupent donc toutes les manifestations qui accompagnent le sommeil:
Sursauts hypnagogiques
Rythmies
Bruxisme
Sommeil lent profond (SLP)
Somnambulisme: éveil dissocié
Terreurs nocturnes
Énurésie
Paralysies du sommeil
Cauchemars
Troubles du comportement du sommeil paradoxal
Somniloquie: le fait de parler pendant le sommeil.
Références:
 2015-Purpan: 37, Allées Jules Guesde - 31000 Toulouse
2015-Purpan: 37, Allées Jules Guesde - 31000 Toulouse
PHYSIOLOGIE HUMAINE APPLIQUÉE Claude Martin Bruno Riou Benoît Vallet-John Libbey Eurotext, Paris, 2017.
ATLAS DE POCHE ANESTHÉSIE Norbert Roewer Holger Thiel 2017, Lavoisier, Paris.
Arrangement BMS.
 Impressionné par la qualité et la présentation des contenus du site !
Impressionné par la qualité et la présentation des contenus du site ! je voudrais faire une demande d'admission
je voudrais faire une demande d'admission cherche des cours pour AMAR
cherche des cours pour AMAR Merci pour les informations
Merci pour les informations Je suis un assistant en anesthésie réanimation
Je suis un assistant en anesthésie réanimation Bienvenu.
Bienvenu.