1- Considérations théoriques
Tout médicament possède, à des niveaux variables, les 3 effets suivants :
- Effets pharmacodynamiques caractérisant l’activité du ou des principes actifs = effets thérapeutique attendu.
- Effets indésirables : manifestations nocives, connues, non recherchées, dont la fréquence est variable
- Effets toxiques : manifestation dose-dépendante (zone toxique) = pour doses supérieures aux doses thérapeutiques = toxicovigilance.
Ensemble des techniques d’identification, d’évaluation et de prévention du risque d’effet indésirable (EI) des médicaments mis sur le marché, ou tout autre problème pouvant être relié à la prise de médicaments »
Elle comprend:
- Le signalement des EI et le recueil des informations les concernant• L’enregistrement, l’évaluation et l’exploitation de ces informations dans un but de PREVENTION
- La réalisation d’études ou de travaux concernant la SECURITE d’EMPLOI des médicaments
- La MISE EN PLACE D’ACTIONS: modification(s) des informations destinés aux professionnels de santé et patients, suspension voire retrait d’AMM,…
La pharmacovigilance correspond à la phase IV (post AMM) des essais cliniques d’un médicament. En effet, une fréquence faible d’effets indésirables nécessite un nombre important de sujets pour être mis en évidence. Les essais de phase II et III impliquent au maximum quelques milliers de patients, de plus sélectionnés (critères d’exclusion).
La phase IV correspond à une utilisation « pratique » : nombre important, durée de traitement variable et croissante, patients tout-venant, conditions de vie variables, polymédication…
On multiplie ainsi les « chances » d’observer l’effet = élargissement de la population
Buts de la Pharmacovigilance
- Obtenir des indications systématiques sur les liens de causalité entre les médicaments et les effets indésirables dans une population
- déceler les effets indésirables passés inaperçus dans les études cliniques et expérimentales, Diminuer leur fréquence et Minimiser leur gravité
- Médicament nouveau
- Médicament dans de nouvelles indications
⇒ système de surveillance
But ultime
Amélioration du rapport bénéfice/risque
« Prise en considération du bénéfice thérapeutique (observé ou escompté) pour juger du caractère acceptable ou non du risque encouru avec une stratégie thérapeutique, médicamenteuse »
- Échelon individuel: choisir le traitement le mieux adapté à un patient donné
- Échelon population: maintenir ou non un médicament sur le marché, informer les prescripteurs de ses risques potentiels,…
2. Historique
1961 Drame de la thalidomide
1962 : 15ème Assemblée de l’OMS (WHO). Echanges de renseignements sur les médicaments entre pays
1967 : 20ème Assemblée de l’OMS (WHO) => Mise en place d’un système international de détection des «réactions adverses aux médicaments»
1971 Création du WHO Drug Monitoring Center (Genève)
1972 Définition de la PV par l’OMS « toute activité tendant à obtenir des indications systématiques sur les liens de causalité probables entre médicaments et réactions adverses dans une population »
1978 WHO Collaborating Center for International Drug Monitoring (Uppsala, Suède)
1995 : Création de l’Agence Européenne des Médicaments (EMA) à Londres

3. Champ d'application
La pharmacovigilance s’exerce sur les médicaments et les produits à finalité sanitaire à usage humain suivants :
- Spécialité pharmaceutique
- Préparation magistrale
- Préparation hospitalière
- Préparation officinale
- Médicaments immunologiques (allergènes, vaccins sérum,…)
- Produit de thérapie cellulaire si AMM
- Médicament radiopharmaceutique,
- Médicament homéopathique
- Préparation de thérapie génique
- Certains produits diététiques
- …
Réglemantation
En France :
- Arrêté du 28 avril 2005 relatif aux bonnes pratiques de pharmacovigilance
- édition d’un guide « Bonnes pratiques de pharmacovigilance »
4. Méthodologie
Une méthodologie rigoureuse est indispensable :
- Implication de santé publique
- Implications économiques
Notifications:
- L’outil essentiel de la pharmacovigilance est le recueil des effets
- La notification est la déclaration d’un effet secondaire.
- La notification doit être faite par tout professionnel de santé : médecin, pharmacien, sage-femme, chirurgien dentiste.
- Cette notification est obligatoire, ce qui ne veut pas dire qu’elle est réalisée (pas de contrôle possible, ni sanction)
La notification se fait :
- Sur un document « déclaration d’effets indésirable susceptible d’être dû à un médicament »
- Au « Centre Régional de pharmacovigilance » (CRPV) dont dépend le praticien
En Algérie:
Au « Centre national de pharmacovigilance et de matériovigilance « (Cnpm)
La notification fait figurer :
- Des renseignements sur le patient (nom, sexe, poids),
- Des renseignements sur les antécédents (ATCD) et facteurs favorisants (IRC, alcoolisme,…),
- Des renseignements sur le traitement (nom, posologie,…),
- Des renseignements sur la gravité,
- La description de l’effet.




Quand on soupçonne un effet indésirable il convient de préciser:
– Son imputabilité : l’événement est-il lié et imputable au médicament X?
Il faut établir une relation cause-effet.
La notion de chronologie des évènements est essentielle :
- Début du traitement
- Date d’apparition de l’effet
- Disparition des effets à l’arrêt du traitement
- Reproduction de celui-ci à la réintroduction
- Caractère connu ou inconnu
L’imputabilité est une caractéristique difficile à certifier :
- Incertitudes sur la réalité des prises et des doses
- Association médicamenteuses = 1 effet/plusieurs médicaments
- Rôle des excipients
- Mode d’administration (vitesse, concentration…)
Sa fréquence :
L’importance pratique d’un effet indésirable dépend de :
- Sa gravité
- Sa fréquence (incidence, prévalence)
Ex : antalgiques A dont l’incidence des agranulocytoses est de 1/3000 malades traités vs antalgique B dont la fréquence est de 1/100 000
Il est donc indispensable de déterminer la prévalence et l’incidence des effets indésirables = problèmes pratiques très complexes.
Imputabilité intrinsèque:
A partir des données de l’observation du patient:
- Établit la relation de cause à effet entre chaque médicament pris pa un malade donné et la survenue d’un événement clinique ou para clinique déterminé.
- Doit être établie de manière indépendante pour chaque médicamenpris par le malade avant la survenue de l’événement
- n’est pas influencée par le degré d’imputabilité des médicaments associés
Repose sur sept critères répartis en deux groupes:
- critères chronologiques (3)
- critères sémiologiques (4)
LES CRITERES CHRONOLOGIQUES (C)
- Délai de survenue Evénement Indésirable par rapport à la prise du médicament
- Evolution de l’événement indésirable après arrêt du médicament
- Ré administration du médicament
I.1. DÉLAI DE SURVENUE DE L’ÉVÉNEMENT (scores)
- Très suggestif: ex: choc anaphylactique après quelques minutes
- Incompatible: délai insuffisant pour que l’événement apparaisse ; événement apparu avant prise médicament
- Compatible: autres cas
I.2. ÉVOLUTION DE L’ÉVÉNEMENT APRÈS L’ARRÊT DU MÉDICAMENT (DÉCHALLENGE)
- Evolution Suggestive: Régression de l ’événement à l’arrêt du médicament
- Evolution Non concluante
- lorsqu'il n'est pas établi de relation entre la régression de l'événement et l'arrêt du traitement (régression retardée par rapport à l’arrêt)
- ou provoquée par un traitement symptomatique non spécifique réputé efficace sur ces troubles,
- ou évolution inconnue,
- ou recul insuffisant
- ou lésions de type irréversible
- ou médicament non arrêté
- ou Survenue d’un décès
- Evolution Non suggestive: allant à l’encontre du rôle du médicament
- absence de régression d’un événement de type réversible (cytolyse hépatique ne régresse pas après un délai de 30 jours )
- ou régression complète malgré la poursuite du médicament
I.3. INFLUENCE D’UNE ÉVENTUELLE RÉEXPOSITION AU MÉDICAMENT(RECHALLENGE)
- R+ : réadministration positive, l ’événement récidive,
- R0 : réadministration non faite ou non évaluable
- R- : réadministration négative, l ’événement ne récidive pas
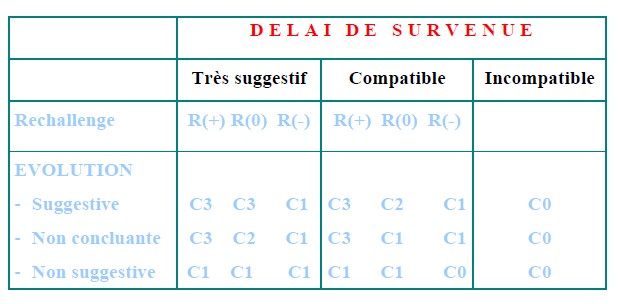
| |
Délai de survenue |
| |
Très suggestif |
Compatible |
Incompatible |
| Réadministration |
R(+) R(0) R (-) |
R(+) R(0) R (-) |
R(+) R(0) R (-) |
|
Evolution
• Suggestive
• Non concluante
• Non suggestive
|
C3 C3 C1
C3 C2 C1
C1 C1 C1
|
C3 C2 C1
C3 C1 C1
C1 C1 C1 |
C0
C0
C0 |
C3 : Chronologie vraisemblable
C2 : Chronologie plausible
C1 : Chronologie douteuse
C0 : Chronologie incompatible
CRITERES SEMIOLOGIQUES (S)
Ils prennent compte :
- Sémiologie évocatrice ou non du rôle du médicament ou présence de facteurs favorisants (surdosage sous IR)
- Recherche de causes non médicamenteuses à EI (diagnostic différentiel)
- Existence d’examens de laboratoire spécifiques prouvant la cause médicamenteuse
- Existence ou non d’une explication pharmacologique(mécanisme d ’action)
| |
Sémiologie |
| |
Evocatrice d’un médicament
ou facteurs favorisants
|
Autres situations |
| Test spécifique |
L(+) L(0) L(-) |
L(+) L(0) L(-) |
Cause non médicamenteuse
• Absente
• Possible (ou non recherchée) |
S3 S3 S1
S3 S2 S1
|
S3 S2 S1
S3 S1 S1
|
S0 : sémiologie douteuse - S1 : sémiologie plausible - S3 : sémiologie vraisemblable
SCORE D’IMPUTABILITE INTRINSEQUE
Les résultats des 2 tables de décision précédentes servent d’entrée à une troisième table finale qui donne l’imputabilité intrinsèque avec 5 scores possibles de I0 à I4.
Imputation au médicament
| Sémiologie |
S1 |
S2 |
S3 |
| Chronologie |
I0
I1
I2
I3
|
I0
I1
I2
I3
|
I0
I2
I3
I4
|
C0
C1
C2
C3 |
L'association des critères chronologiques et sémiologiques permet de déterminer le score d'imputabilité intrinsèque I :
- I0 : paraît exclue
- I1: Douteuse
- I2 : Plausible
- I3 : Vraisemblable
- I4 : Très vraisemblable
5. Organisation de la pharmacovigilance
5.1. Rôle des Professionnels de santé (et correspondants)
1/ DECLARER
- Déclaration obligatoire
- des évènements indésirables (EI) graves ou inattendus ( mésusage).
- Il est vivement conseillé de déclarer :
- Tout cas de surdosage,
- Toute exposition au cours de la grossesse,
- Toute observation de perte d’efficacité (notamment avec les vaccins, les contraceptifs,…)
- Tout autre effet ou situation ayant une conséquence néfaste, potentielle ou avérée pour la santé,
- Tout effet qu’il juge pertinent de déclarer.
2/ MISE A DISPOSITION DU CENTRE NATIONAL DE PHARMACOVIGILANCE
- De toutes les informations…
3/ CONSERVER LES DOCUMENTS SOURCES ET INFORMER LE PATIENT
- Des déclarations
- De leur droit d’accès
4/ COOPERER AVEC LES STUCTURES DE PHARMACOVIGILANCE