Jamil Hamza: Praticien hospitalier, DES en anesthésie-réanimation-Paul Sacquin: Attaché, département d'anesthésie-réanimation -Lionel Simon: Chef de clinique-assistant, département d'anesthésie-réanimation -Hôpital Saint-Vincent-de-Paul, 82, avenue Denfert-Rochereau, 75014 Paris France 36-640-A-10 (1995)
Arrangement : BMS
Introduction
La connaissance des caractéristiques physiologiques hémodynamiques, respiratoires, rénales et de l'importance de la régulation thermique chez le nouveau-né est le préalable indispensable à la compréhension et à la mise en place des grandes règles de l'anesthésie pédiatrique, tout particulièrement en période néonatale.
Adaptation circulatoire à la naissance
- La naissance va donner lieu à une modification physiologique fondamentale :
- le poumon du nouveau-né doit assumer seule la fonction d'oxygénation réservée jusqu'alors au placenta.
- L'expansion pulmonaire entraîne une chute majeure des résistances artérielles pulmonaires d’ou
- augmentation du débit sanguin pulmonaire et donc
- augmentation retour veineux pulmonaire.
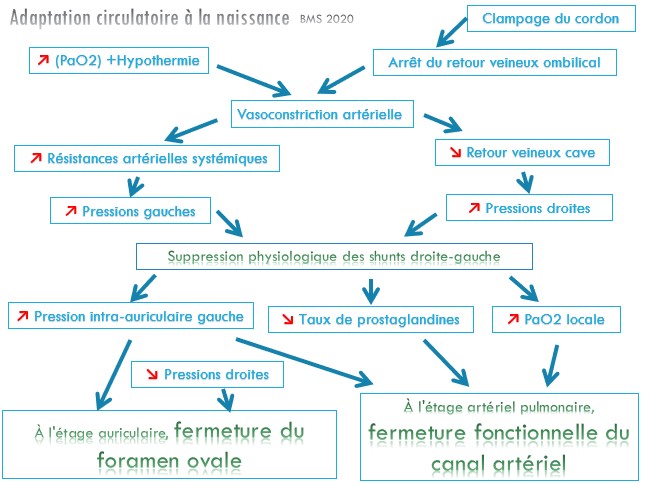
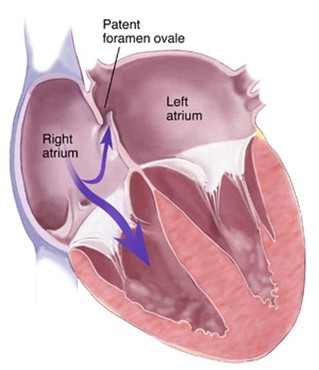
- Si, fonctionnellement, l'état circulatoire du nouveau-né se rapproche alors de celui de l'adulte, il en va différemment sur le plan anatomique :
- le canal artériel ne disparaît définitivement que vers la 3e semaine de vie
- le foramen ovale n'est clos que vers le 4e mois de vie
- pendant ce laps de temps, tous les stimuli (hypoxémie, acidose) entraînant une augmentation des résistances artérielles pulmonaires peuvent provoquer une réouverture des shunts droite-gauche avec retour à une circulation de type fœtal ;
- la conséquence principale en est la survenue d'une hypoxémie qui aggrave elle-même le phénomène.
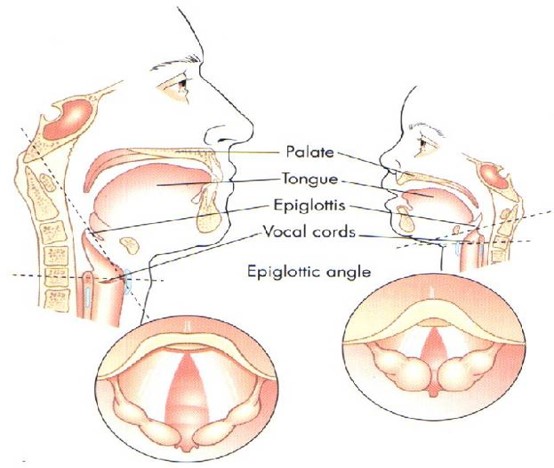
Particularités anatomiques du nouveau-né
La respiration est exclusivement nasale jusqu'à l'âge de 3 mois.
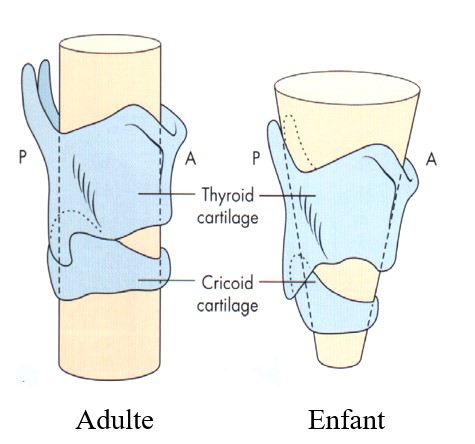
Le cou est court, le larynx court, la bouche petite, la langue grosse, l'épiglotte allongée, le larynx haut situé (en regard de la vertèbre C2 vs C6 chez l'adulte).
Le larynx est de forme conique à pointe inférieure.
La partie la plus étroite du larynx est le défilé cricoïdien.
La trachée est courte (4-5 cm).
Conséquences pratiques
La pose d'une sonde naso-gastrique ampute de 50 % la filière respiratoire du nouveau-né.
L'intubation est délicate chez le nouveau-né.
L'intubation du nouveau-né est plus aisée avec une lame droite.
Il faut être prudent avec les grosses sondes d'intubation chez le nouveau-né (risque de sténose sous-glottique).
Le risque d'intubation sélective est grand (trachée courte).
Le risque d'extubation accidentelle est d'autant plus élevé que la trachée est courte.
Le risque d'extubation est augmenté en cas d'hyperextension.
Lors de la ventilation au masque et lors de l'intubation, il faut éviter l'hyperextension du cou qui entraîne facilement un écrasement des cartilages trachéaux.
1 mm d'œdème divise par deux le diamètre de la trachée et réduit de 75 % la surface de sa section transversale.
La pauvreté en fibres musculaires de type I rendent difficile voire impossible le maintien d'une augmentation prolongée du travail ventilatoire.
Les côtes sont horizontales, ce qui limite l'expansion antéro-postérieure et transversale du thorax lors de l'inspiration.
Particularités physiologiques du nouveau-né
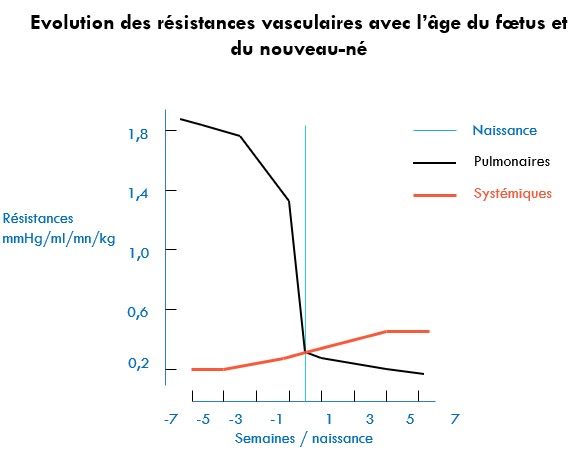
À la naissance, le liquide intra-pulmonaire est expulsé lors du passage de la filière génitale (environ 25 ml/kg). La CRF s'établit au cours des premières inspirations. On observe une diminution des résistances vasculaires pulmonaires et une augmentation du débit sanguin pulmonaire.
Le diaphragme, principal muscle inspiratoire, garde un tonus à la fin de l'expiration afin de conserver une pression positive intra-pulmonaire télé-expiratoire. Cette dernière est aussi favorisée par le rétrécissement de la filière sous-glottique.
La compliance de la paroi thoracique est très élevée. Les intercostaux jouent donc le rôle de maintien de la stabilité de la cage thoracique au cours de l'inspiration.
La compliance pulmonaire est faible à la naissance (tendance à la rétraction pulmonaire). Elle rejoint celle de l'adulte à 8 jours de vie (1 à 2 ml/cm H2O/kg). À l'équilibre, la tendance est plutôt à la baisse de la CRF et à la fermeture des petites voies aériennes (volume de fermeture > CRF).
La consommation d'oxygène est très importante ; les volumes pulmonaires sont identiques à l'adulte. Toute augmentation de la VO2 se traduira par une augmentation de la fréquence respiratoire.
Le nouveau-né a de très faibles réserves en oxygène (rapport VA/CRF très élevé).
Les chémorécepteurs périphériques et centraux sont bien développés chez le nouveau-né et permettent une réponse adaptée des centres ventilatoires. La réponse à l'hypoxie est mature en quelques semaines. La réponse à l'hypercapnie est mature quelques heures après la naissance.
Conséquences pratiques
Le captage et l'élimination des agents anesthésiques sont plus rapides chez le jeune enfant.
Lors de l'induction, une respiration paradoxale et un risque d'obstruction peuvent survenir.
Il faut assurer une pression inspiratoire élevée pour assurer une ventilation adéquate.
La désaturation survient très rapidement.
Le risque d'apnées est important chez le prématuré ce d'autant que l'âge gestationnel est bas et que l'âge post-conceptionnel (âge gestationnel + âge post-natal) est bas. Elles peuvent être centrales, obstructives ou mixtes.
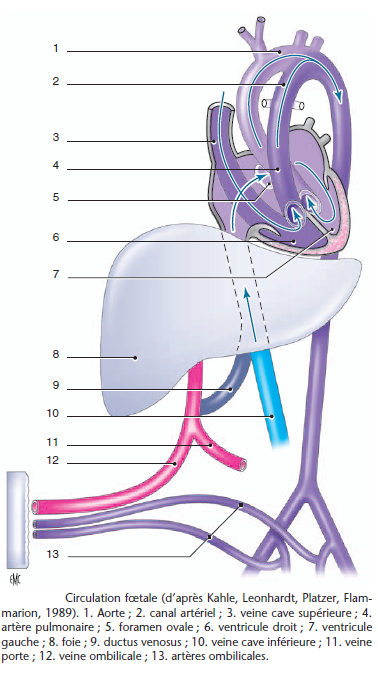
Spécificité du nouveau-né : les trois shunts (foramen ovale, canal artériel et canal dArantius) se ferment progressivement à la naissance par divers mécanismes. Dans des situations particulières qui favorisent la vasoconstriction pulmonaire (hypoxie, hypovolémie, hypothermie, sepsis), ils peuvent se réouvrir et instaurer le retour à la circulation fœtale. Celle-ci peut entraîner un cercle vicieux vasoconstriction pulmonaire => hypoxie => vasoconstriction pulmonaire.
Pendant les premiers mois de vie, il est possible de retrouver un shunt droit- gauche via le foramen ovale lors de l'anesthésie profonde par chute de la pression artérielle systémique.
Elle passe par 3 phases distinctes :
I. l'élimination du liquide intra pulmonaire : une grande partie est éliminée lors du passage de la filière génitale, la pression de 40 à 100 cmH2O qui s'exerce alors sur le thorax réalisant la vidange pulmonaire . Le reste du liquide sera éliminé par la circulation lymphatique pulmonaire durant les premiers jours de vie ;
II. la première aération pulmonaire : elle nécessite la mise en jeu par le nouveau-né d'une pression négative respiratoire majeure de -40 à - 100 cmH2O ; son importance s'explique par la résistance élevée des voies aériennes, la persistance de liquide intra pulmonaire, la résistance du parenchyme à l'étirement. Cette première aération permet la constitution de la capacité résiduelle fonctionnelle ;
III. le maintien de la capacité résiduelle fonctionnelle : indispensable car elle permet de diminuer les pressions nécessaires pour les inspirations suivantes en maintenant les alvéoles ouvertes en fin d'expiration .
Deux mécanismes en sont à l'origine :
- la présence du surfactant qui équilibre les tensions pariétales intra-alvéolaires
- l'existence d'un frein physiologique expiratoire laryngé qui réalise un phénomène d'auto-PEEP (" positive end-expiratory pressure ").
Par ailleurs, l'aération pulmonaire entraîne une chute des résistances artérielles pulmonaires indispensables aux modifications cardiocirculatoires néonatales.
Evolution des volumes pulmonaires après la naissance
La capacité pulmonaire totale varie de 60 à 65 ml/kg chez le nouveau-né tandis que la capacité vitale oscille entre 80 et 120 ml/kg.
Le volume courant varie de 16 à 20 ml,
la capacité résiduelle fonctionnelle de 15 à 18 ml/kg.
On constate le faible volume de la capacité résiduelle fonctionnelle, ce qui a plusieurs conséquences sur la ventilation : chez l'enfant de moins de 6 ans, le volume de fermeture excède la capacité résiduelle fonctionnelle en position allongée, entraînant un collapsus alvéolaire.
Comme nous l'avons vu, l'existence d'un frein expiratoire laryngé permet d'éviter ce collapsus ; cependant, ce mécanisme peut disparaître, notamment lors du sommeil paradoxal ou sous anesthésie générale, exposant alors l'enfant à un risque accru d'hypoxie.
De plus, l'importance de la ventilation alvéolaire rapportée à la capacité résiduelle fonctionnelle limite les réserves en oxygène et explique que l'apnée entraîne une hypoxie plus rapidement que chez l'adulte.
L'induction anesthésique est donc une période particulièrement exposée à ce risque d'hypoxie puisque les 2 phénomènes sus-décrits sont réunis. A partir de l'âge de 1 an, la capacité résiduelle fonctionnelle augmente de 15 à 25 ml/kg, ce qui réduit ce risque hypoxique
La ventilation alvéolaire se situe entre 100 et 150 ml/kg/min.
Mécanique ventilatoire après la naissance
Résistance des voies aériennes
La résistance des voies aériennes distales ne représente que 10 % des résistances totales, essentiellement représentées par les résistances des voies aériennes supérieures et des grosses bronches. Elle est cependant plus importante chez l'enfant (à l'âge de 5 ans, elles sont 4 fois plus élevées que chez l'adulte), tout particulièrement chez le nouveau-né prématuré. Cependant, le volume d'air à mobiliser est plus faible chez l'enfant que chez l'adulte, si bien que la conductance (inverse de la résistance) qui traduit la facilité des gaz à se déplacer, est en fait identique chez l'enfant et l'adulte, lorsqu'elle est rapportée au volume pulmonaire
Compliance thoracique
La compliance thoracique est très élevée chez le nouveau-né pour plusieurs raisons :
- l'absence d'ossification costale qui assure la rigidité de la cage thoracique,
- le faible tonus des muscles intercostaux,
- la persistance d'une pression intra-abdominale positive.
Cette compliance élevée fait que le thorax ne peut s'opposer à la rétraction élastique du poumon : la conséquence en est une diminution majeure des volumes en fin d'expiration tendant au collapsus.
Le maintien d'une ventilation alvéolaire efficace nécessite alors une augmentation du travail ventilatoire. Celui-ci peut représenter 10 % du métabolisme de base chez le nouveau-né prématuré.
Pour ces différentes raisons (volume de fermeture élevé, grande compliance thoracique), l'enfant doit, pour maintenir sa ventilation minute tout en minimisant son travail ventilatoire, respirer avec un faible volume courant mais une fréquence respiratoire élevée.
Contrôle de la ventilation
Le niveau de vigilance joue un rôle essentiel dans le contrôle de la ventilation chez le nouveau-né. Le nouveau-né à terme dort environ 17 heures par jour réparties en 50 % de sommeil paradoxal (appelé sommeil agité chez le nouveau-né) et 50 % de sommeil lent (appelé sommeil calme).
Le pourcentage de sommeil agité est encore plus élevé chez le nouveau-né prématuré. Or, l'activité des muscles intercostaux est inhibée durant la phase de sommeil agité conduisant à une respiration paradoxale avec une augmentation compensatoire de la course diaphragmatique à l'inspiration.
Ceci tend à augmenter la pression négative pharyngée ce qui favorise les apnées obstructives. De plus, cette respiration paradoxale caractéristique du sommeil agité augmente le travail ventilatoire et diminue la réponse ventilatoire à l'inhalation de CO2 et à l'hypoxie. Enfin, une étude récente a montré que la dépression respiratoire néonatale induite par certains morphiniques (péthidine) administrés à la mère pouvait dépendre des stades de sommeil et ne se révéler ainsi qu'en phase de sommeil agité .
La réponse ventilatoire à l'inhalation de CO2 est peu différente de celle de l'adulte chez le nouveau-né à terme, mais nettement diminuée chez le prématuré . En effet, le volume courant augmente mais la fréquence respiratoire, après une brève augmentation revient rapidement à sa valeur de base.
La réponse ventilatoire à l'hypoxie est particulière chez le nouveau-né : l'augmentation initiale transitoire de la ventilation est suivie d'une dépression ventilatoire dont les mécanismes sont encore mal connus . Chez le nouveau-né prématuré humain, la réponse à l'hypoxie est plus faible, surtout lors du sommeil agité . En outre, en cas d'hypoxie, la réponse ventilatoire au CO2 est déprimée chez le nouveau-né contrairement à ce qui se passe chez le nourrisson plus âgé.
Les mécanismes réflexes de régulation de la ventilation jouent un rôle important chez le nouveau-né :
- le réflexe d'Hering et Breuer (inhibition de l'inspiration et prolongation de l'expiration en réponse à une inflation pulmonaire) est présent chez le nouveau-né et permet de moduler la durée de l'expiration en fonction du volume pulmonaire ;
- les réflexes d'origine pharyngolaryngée sont responsables d'épisodes apnéiques : chez le nouveau-né, en réponse à une stimulation laryngée par divers solutés (eau, lait) il y a survenue d'une apnée obstructive brève suivie d'une apnée centrale prolongée ; de même, la stimulation des récepteurs pharyngés sensibles aux variations de pression peut entraîner une apnée.
-
En pratique, les particularités du contrôle de la ventilation chez le nouveau-né permettent d'expliquer, en particulier chez le prématuré, la fréquence des apnées.
Celles-ci peuvent être centrales, liées à l'immaturité des récepteurs et du système nerveux central, ou obstructives d'origine pharyngolaryngée.
L'anesthésie, par ses effets dépresseurs centraux et son retentissement sur les réflexes à point de départ pharyngolaryngé accroît encore le risque d'apnée postopératoire.
C'est pourquoi le risque accru d'apnée postopératoire chez l'ancien prématuré conduit à privilégier l'anesthésie locorégionale isolée (rachianesthésie) car la sédation complémentaire (kétamine) associée à une anesthésie caudale suffit à augmenter notablement l'incidence des apnées
-
Fonction myocardique
-
La capacité d'augmentation du débit cardiaque néonatal en réponse à un accroissement de la demande (surcharge volémique, augmentation des résistances artérielles systémiques) est très limitée.
Du fait d'une demande cardiovasculaire majeure (V ° O2 [consommation d'oxygène] = 15 ml/kg/min, débit cardiaque = 400 ml/kg/min), la stimulation sympathique est en effet maximale lors des premiers jours de vie.
La mauvaise compliance et la faible contractilité du ventricule gauche expliquent également sa capacité limitée à supporter une surcharge volémique .
-
Cependant, les performances myocardiques du nouveau-né s'accroissent ensuite très rapidement pour atteindre un niveau comparable à celui de l'adulte au bout de 3 semaines de vie.
L'adaptation de la masse myocardique aux conditions de charge entraîne une croissance cardiaque rapide permettant une amélioration de la compliance et une meilleure contractilité ; cette croissance se fait essentiellement au profit du ventricule gauche dont la masse triple par rapport à celle du ventricule droit durant les 3 premières semaines de vie.
D'autre part, la baisse de moitié de la V ° O2 et du débit cardiaque durant les 6 premières semaines permet au myocarde d'augmenter ses performances en réponse à un accroissement des besoins.
-
Volémie et pression artérielle systémique
Contrairement à l'adulte, ces deux paramètres sont étroitement liés chez le nouveau-né ; ceci tient essentiellement à l'immaturité du système sympathique qui porte principalement sur la composante alpha. Ainsi, en réponse à l'hypovolémie, le nouveau-né ne pourra que faiblement augmenter ses résistances artérielles systémiques afin de maintenir sa pression artérielle.
L'absence de rétrocontrôle négatif du nombre de récepteurs bêta chez le nouveau-né explique que ceux-ci s'expriment de façon plus importante que chez l'enfant plus grand. Ceci est important car le débit cardiaque du nouveau-né dépend essentiellement de la fréquence cardiaque.
La prévention et le traitement d'une bradycardie sont donc particulièrement importants en anesthésie-réanimation néonatale car toute bradycardie est source de bas débit cardiaque.
Maturation des structures de la perception douloureuse
En résumé, sur un plan anatomique et physiologique, le nouveau-né possède toutes les structures nécessaires à la perception d'un stimulus nociceptif : récepteurs, voies de conduction du message, structures corticales pour l'intégration.
L'expérience clinique vient conforter les résultats de ces travaux à l'aide d'un ensemble de manifestations cliniques et/ou biologiques caractéristiques chez le nouveau-né auquel est appliqué un stimulus douloureux.

Jonction neuromusculaire
La maturation de la jonction neuromusculaire s'effectue durant les 2 premiers mois suivant la naissance.
Le nouveau-né présente une diminution de l'amplitude de la réponse au train de quatre ainsi qu'une fatigabilité plus importante après stimulation tétanique.
Cette maturation progressive explique que le nouveau-né soit plus sensible aux curares non dépolarisants et à l'inverse moins sensible aux curares dépolarisants.
La grande variabilité dans la vitesse de maturation est responsable des différences de curarisation observées entre 2 nouveau-nés et ce pour une même posologie de myorelaxant.
Enfin, notons que, chez le nouveau-né, l'ensemble de la fibre musculaire est sensible à l'action de l'acétylcholine.
Filtration glomérulaire
La filtration glomérulaire est basse chez le nouveau-né avec une clairance de l'ordre de 20 ml/min contre 125 ml/min chez l'adulte. Celle-ci augmente progressivement du fait de l'augmentation du débit sanguin rénal et surtout du fait de sa redistribution vers le cortex externe sous l'influence de la diminution de la stimulation du système rénine-angiotensine ; le caractère progressif de cette diminution constituerait un mécanisme de protection contre une perte en chlorure de sodium (NaCl) trop brutale qui serait observée en cas d'augmentation trop rapide de la filtration glomérulaire face à un tubule limité dans ses capacités de réabsorption de NaCl.
La limitation de la filtration glomérulaire limite l'adaptation néonatale à une surcharge hydrique. D'autre part, la demi-vie des produits à élimination rénale est allongée
Pendant la croissance intra-utérine, le fœtus n'a pas besoin d'assumer sa régulation thermique. Sa température se situe en effet entre 0,3 et 0,5 °C au-dessus de la température maternelle. A la naissance, le nouveau-né est précipité d'un milieu liquide et chaud dans un environnement froid et aérique entraînant une déperdition thermique importante (de l'ordre de 2 à 3 °C).
Les mécanismes de déperdition sont principalement de deux ordres : pertes par radiation, prépondérantes du fait d'un rapport surface cutanée/volume élevé (2,7 fois celui d'un adulte) et pertes par évaporation, mécanisme prédominant chez le prématuré.
Cette déperdition doit être prévenue, d'autant plus que les capacités de thermogenèse sont limitées chez le nouveau-né pour plusieurs raisons :
- l'absence de frisson qui deviendra le mécanisme de thermogenèse essentiel chez le grand enfant ;
- le mode de production de chaleur qui se fait par l'intermédiaire d'une oxydation des acides gras libres (AGL) issus des triglycérides. L'origine de ces triglycérides se trouve dans la graisse brune qui constitue 5 % du poids du corps du nouveau-né à terme. La libération des AGL nécessite l'action d'une lipase dont l'activité est modulée par la sécrétion catécholaminergique. Le coût métabolique de ce mode de production de chaleur peut aboutir à un triplement de la consommation d'oxygène de base.
Cette demande accrue peut être impossible à réaliser chez un nouveau-né présentant une détresse respiratoire.
Conclusion
La connaissance et la compréhension des bases physiologiques de la maturation des principales fonctions vitales du nouveau-né et de l'enfant est le préalable indispensable à une approche raisonnée et objective de l'anesthésie pédiatrique et plus particulièrement de l'anesthésie néonatale.
La connaissance des grands principes de la physiologie cardiovasculaire, respiratoire et rénale, essentiels pour prévenir la morbidité grave, sont en règle bien connus. Il paraît aujourd'hui essentiel d'insister sur la nécessité de reconnaître la douleur néonatale car l'étude de la maturation des structures impliquées dans la douleur ne laisse plus de doute quant à la réalité de celle-ci et au devoir de la traiter.