Barbara Sneyers, est pharmacienne en milieu hospitalier, Cliniques Universitaires St Luc, Bruxelles, Belgique
Marc M. Perreault, Pharm.D., BCPS, est pharmacien à l’Hôpital général de Montréal et professeur agrégé de clinique à la Faculté de pharmacie de l’Université de Montréal
Introduction
Le propofol est utilisé depuis les années 1980 comme agent anesthésique, et son usage est reconnu pour la sédation en soins intensifs depuis les années 1990. Il est souvent un agent de première intention pour la sédation du patient en soins intensifs et particulièrement pour le patient ayant des atteintes neurologiques, sa courte durée d’action permettant de réveiller rapidement le patientaprès l’arrêt de la perfusion pour une évaluation neurologique.
D’ailleurs, les recommandations de la Society of Critical Care Medicine (SCCM) sur l’analgésie et la sédation de 2002 préconisent son utilisation en première intention chez les patients nécessitant un éveil rapide1.
Parmi ses effets indésirables fréquents, on retrouve l’hypotension, la bradycardie, la dépression respiratoire et l’acidose métabolique. De plus, de par sa formulation particulière (émulsion lipidique), il présente un risque d’infections, d’irritation veineuse et d’hypertriglycéridémie.
La tolérance aux effets sédatifs du propofol a été rapportée comme entraînant une augmentation des doses utilisées pour le maintien de l’effet sédatif2. Plus rarement, des cas de pancréatites ont été rapportés3. Finalement, le Propofol related infusion syndrome ou le PRIS est un effet indésirable rare mais souvent fatal du propofol4.
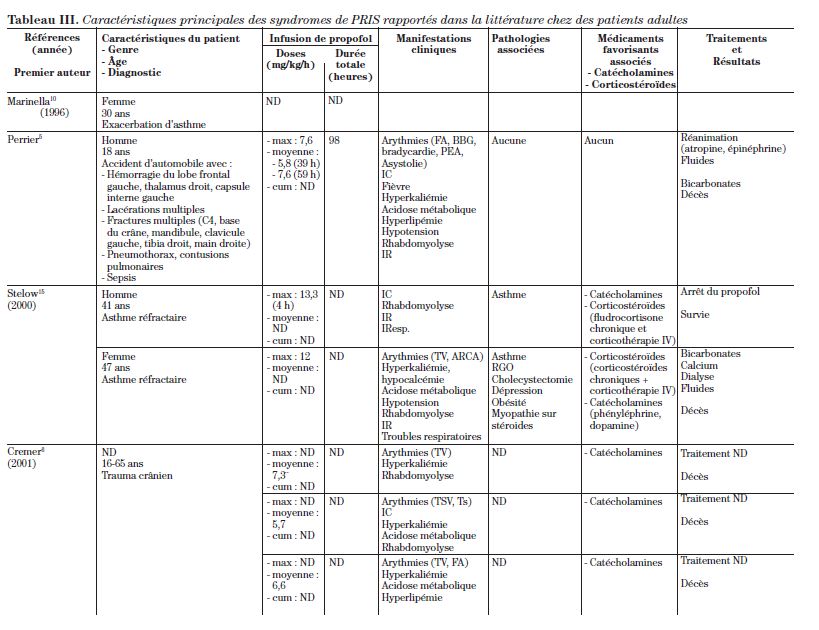
La définition initiale du syndrome comprend les critères suivants : bradycardie aiguë réfractaire, évoluant souvent vers une asystolie ou un choc cardiogénique, acidose métabolique avec excès de base de moins de 10 mmol/l, lyse musculaire (augmentation des enzymes créatinine phosphokinases, myoglobinurie), hyperlipémie, hépatomégalie ou stéatose hépatique et insuffisance rénale aiguë5-11. Certains proposent de remplacer, dans la définition, la bradycardie par l’insuffisance cardiaque et l’arythmie, étant donné que certains rapports font état de tachycardie plutôt que de bradycardie. Les tableaux I et II décrivent respectivement les principales caractéristiques biochimiques et cliniques du PRIS.
Ce syndrome a d’abord été décrit chez des enfants depuis 1992. Il a été source d’inquiétude pour certaines autorités en matière de sécurité des médicaments, comme la Food and Drug Administration (FDA)12. Lors d’une étude randomisée contrôlée menée auprès de 327 patients pédiatriques, qui comparait la sédation au propofol 1 % et 2 % versus d’autres agents (lorazépam, kétamine, fentanyl), une tendance non significative à l’augmentation du taux mortalité à 28 jours, a été notée dans le groupe propofol. À la suite de cette étude, la FDA a publié un avis contre l’utilisation du propofol chez les patients pédiatriques pour une sédation aux soins intensifs8. Cette augmentation de la mortalité dans le groupe propofol était plus importante avec la concentration de 2 % qu’avec celle de 1 % (11 % versus 8 %) comparativement à la mortalité de 4 % du groupe contrôle. Depuis 1996, des rapports de cas ont également été publiés concernant les adultes10.

On rapporte une faible incidence de ce syndrome, mais elle est probablement sous-estimée. Dans une revue de tous les cas pédiatriques et d’adultes de PRIS, une mortalité de 64 % est rapportée autant chez les adultes que les enfants9. Une évaluation récente des cas de mortalité à la suite de l’administration de propofol à long terme indique que, dans 70 % des cas pédiatriques et 30 % des cas adultes, on y retrouve les mêmes symptômes que dans le PRIS13. Fong et coll. ont récemment évalué les facteurs prédictifs de la mortalité auprès des patients chez qui on suspecte un PRIS à partir de la banque de données MEDWATCH11. Ils ont noté une mortalité de 30 % auprès de cette population. La présence des facteurs suivants prédisaient de façon significative le risque de mortalité :
- l’âge ≤ 18 ans (rapport de cote 2,3),
- le sexe masculin (rapport de cote 1,3),
- l’administration d’un vasopresseur (rapport de cote 1,8) ou la manifestation cardiaque (rapport de cote 3,8),
- l’acidose métabolique (rapport de cote 3,7),
- l’insuffisance rénale (rapport de cote 1,9),
- l’hypotension (rapport de cote 1,8),
- la rhabdomyolyse (rapport de cote 1,8)
- et la dyslipidémie (rapport de cote 2,0)11.
Le rôle du propofol dans le développement du syndrome du PRIS est controversé. Ahlen et coll. suggèrent que ce syndrome est possiblement attribuable à d’autres causes, telles que l’inadéquation des apports en oxygène et de sa capture, ce qui expliquerait l’acidose métabolique et les atteintes d’organes (rhabdomyolyse, insuffisance cardiaque, rénale et hépatique), et que certaines des pathologies ou autres médicaments associés chez ces patients peuvent aussi expliquer leur symptomatologie14.
Toutefois, même si la relation causale entre le propofol et la survenue d’un syndrome PRIS n’a pas encore été démontrée, une association très claire existe entre les deux, et les caractéristiques de causalité suivantes doivent être prises en compte :
- Consistance : différents rapports de cas et de séries decas mentionnent un syndrome similaire.
- Spécificité : le syndrome n’est pas rapporté lors de l’usage d’autres médicaments.
- Relation temporelle : le syndrome apparaît dans les jours qui suivent le début de l’administration du médicament (dans les deux à trois jours après le début de l’administration du médicament).
- Relation dose dépendante : le syndrome apparaît plus fréquemment avec l’utilisation de fortes doses de médicament.
- Explication biologique : des données toxicologiques proposent une explication plausible au syndrome clinique.
Discussion
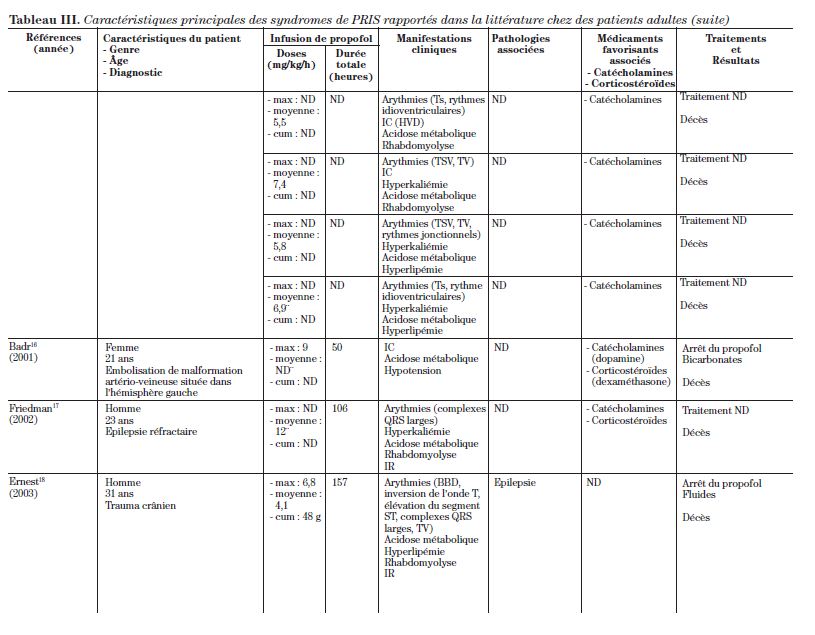
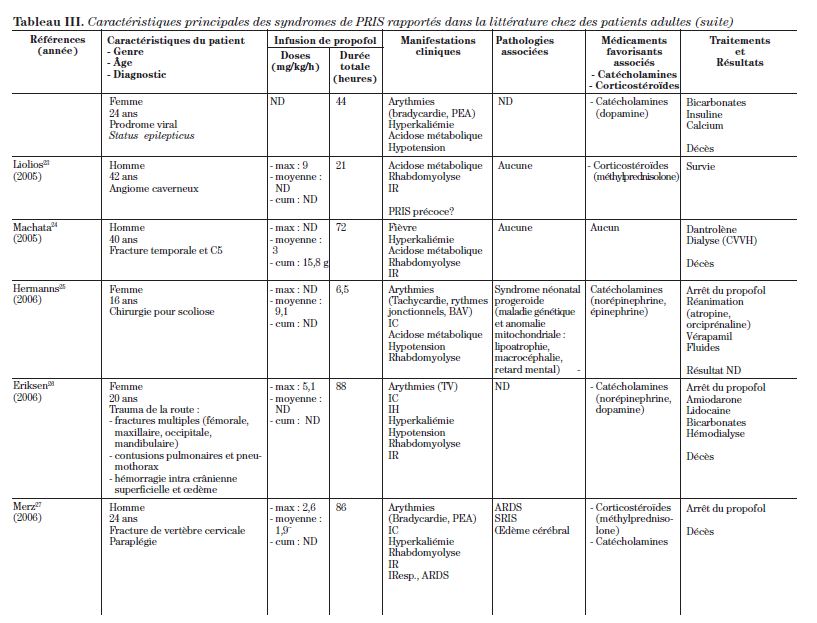
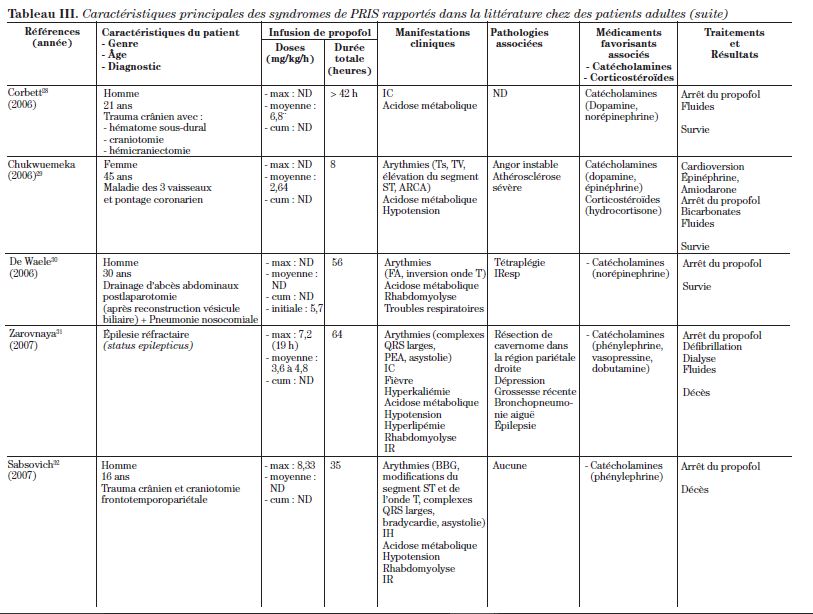
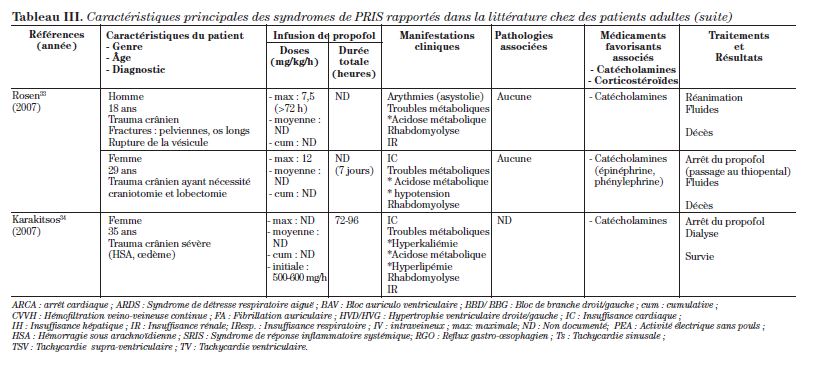
Cet article est une revue de la littérature de 34 cas qui s’étendent sur plus de 16 ans, rapportés à ce jour dans la littérature d’anesthésiologie et de soins intensifs. La description de ces 34 cas se retrouve dans le tableau III.
Physiopathologie
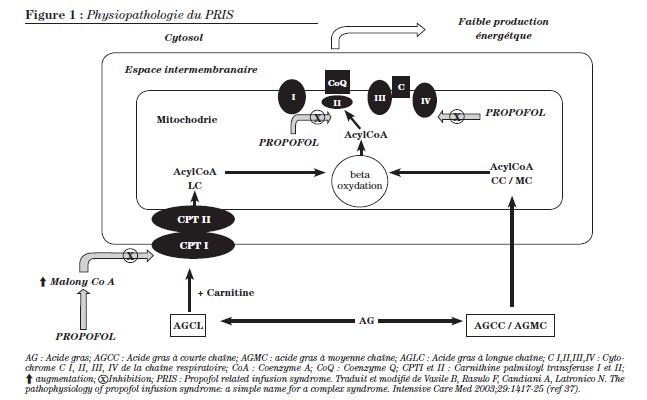
La pathophysiologie du PRIS n’est pas totalement élucidée et est sans doute multifactorielle. Il existe différentes hypothèses quant à son mécanisme d’action.
- Comme le démontre la figure 1, le propofol occasionne un découplage de la phosphorylation oxydative au niveau du complexe IV des mitochondries et inhibe ainsi la production d’énergie, tel qu’il a été démontré in vitro35 et in vivo7. Les cellules musculaires squelettiques et cardiaques seraient particulièrement sensibles à ces effets étant donné leurs besoins élevés en ATP. Le propofol cause en outre une altération de l’utilisation des acides gras. En effet, il augmente l’activité du malonyl coenzyme A, tel que le démontre la concentration élevée de malonylcarnitine et de C5 acylcarnitine retrouvée chez un patient7. Le malonyl coenzyme A inhibe à son tour le transporteur carnitine palmityl transférase I : l’entrée intramitochondriale des acides gras à longue chaîne est ainsi réduite. Par ailleurs, si les acides gras à courte et à moyenne chaîne pénètrent les cellules par diffusion, le propofol induit une altération de la chaîne respiratoire mitochondriale au complexe II, ce qui inhibe la b oxydation des acides gras à courte et moyenne chaîne7. Les acides gras libres étant une source importante d’énergie pour le tissu musculaire squelettique et cardiaque dans des situations de stress, il est facile de comprendre pourquoi le propofol peut, dans ces situations critiques ou de jeûne, causerune lyse et une nécrose musculaire. De plus, les acides gras libres ayant des propriétés proarythmogènes36, leur accumulation peut expliquer les arythmies observées lors du PRIS. La figure 1 décrit la physiopathologie du PRIS37.
- Le propofol est rapidement métabolisé par le foie au moyen du cytochrome 2B6 essentiellement et de la glucuronoconjugaison en métabolites inactifs (4-sulfate conjugué du 2,6-diisopropyl 1,4 quinol, 1- et 4-glucuronide conjugués du 2,6-diisopropyl 1,4 quinol et dérivé glucuronoconjugué). Il semblerait que le propofol lui-même et ses métabolites (intermédiaires di-hydroxylés)miment les quinones toxiques. Des variants génétiques dans la clairance expliqueraient la différence d’effets selon les individus.
- Du fait de ses propriétés antioxydantes et de ses effets de stimulation de la protéine kinase C, le propofol seraitinducteur d’apoptose, du moins dans certains types de cellules (neutrophiles et monocytes)38.
- Il semblerait que l’émulsion lipidique elle-même puisse être responsable des symptômes du PRIS. Tout d’abord, les lipides peuvent induire des altérations de la b oxydation chez certains patients prédisposés, notamment les patients déficients en carnitine et en hydrates de carbone. En effet, ces deux substances jouent un rôle essentiel dans la b oxydation lipidique39.Les patients des soins intensifs semblent être prédisposés à des déficiences en carnitine en raison de causes multiples : synthèse de carnitine altérée chez les patients cirrhotiques ou insuffisants rénaux chroniques,malabsorption, excrétion augmentée dans les urines lors d’acidose tubulaire aiguë et administration d’acide valproique40. D’autre part, chez certains patients décédés de PRIS, des concentrations élevées de propofol ont été retrouvées tandis que celles des métabolites étaient situés dans un écart normal41. Cela pourrait indiquer qu’une lipémie importante agirait comme réservoir pour le propofol, l’empêchant ainsi d’atteindre ses sites d’action. Ceci engendrerait l’escalade
des doses, qui constitue un facteur de risque important.
Facteurs de risque
On distingue deux types de facteurs : ceux prédisposants et ceux déclenchants, tels que l’instauration de l’administration du propofol. Le fait que les deux types de facteurs soient nécessaires au développement du syndrome explique pourquoi celui-ci est peu décrit en anesthésie, où les patients sont pour la plupart en bonne santé. Des cas où les patients avaient déjà subi plusieurs anesthésies préalables avec du propofol sans développer un PRIS montrent l’importance des facteurs prédisposants25.