M. Le Guen, T. Baugnon. EMC Conférences d'actualisation de la SFAR 1997 JC Otteni, F Collin, S Fournier
introduction
Le protoxyde d’azote est un agent volatil utilisé dans le domaine médical depuis plus de 150 ans. Ses propriétés pharmacologiques en font toute la particularité puisqu’il présente à la fois des propriétés analgésiques, de type non morphinique passant par une action supraspinale, des propriétés euphorisantes lui valant la dénomination de « gaz hilarant » et des propriétés anxiolytiques, voire anesthésiques faibles, le faisant largement proposer comme agent anesthésique volatil adjuvant.
Cet agent ancien possède néanmoins un certain nombre de contre-indications à son emploi, parmi lesquelles se trouvent les patients présentant des déficits connus ou probables en vitamine B12, ou en folates, et les épanchements aériques de cavités non extensibles. Enfin, un certain nombre d’effets indésirables, tels les nausées et vomissements postopératoires, les effets neurotoxiques, etc., sont rapportés justifiant finalement son emploi raisonné et probablement restreint.
Propriétés pharmacologiques
Pharmacodynamie – pharmacocinétique
La cinétique du N2O détermine trois de ses caractéristiques majeures :
- la vitesse d'induction, c'est-à-dire la possibilité d'induire l'anesthésie au masque ;
- sa diffusion dans les cavités closes ;
- la vitesse du réveil, c'est-à-dire la possibilité de l'utiliser chez le patient ambulatoire
Absorption se fait très rapidement par voie pulmonaire (gaz inhalé).
La concentration alvéolaire du N2O approche la concentration inhalée en quelques minutes car grande diffusibilité et faible solubilité.
La distribution se fait ensuite uniquement sous forme dissoute dans le sang (absence de combinaison sur l’hémoglobine) vers les tissus richement vascularisés, surtout cerveau.
Pas de métabolisme, élimination pulmonaire.
Gaz incolore, inodore, avec discrète saveur sucrée et qui est dépresseur du système nerveux central avec un effet dose-dépendant.
Effet anesthésique à CAM =104 % .
Ne peut être utilisé sans oxygène pour une AG.
Le faible coefficient de solubilité dans l’eau ou l’huile explique un début d’action et une élimination rapides à l’arrêt de toute administration.
Effet deuxième gaz.
Si association avec d’autres agents volatils (halogénés notamment) Il s’agit des modifications de composition d’un mélange gazeux au sein de l’alvéole pulmonaire.
Ainsi, le protoxyde d’azote diffuse plus vite de l’alvéole au compartiment sanguin lorsqu’il est ajouté secondairement à un mélange de gaz contenant un agent halogéné.
La concentration de cet halogéné est alors augmenté, ce qui permettrait d’accélérer la vitesse d’induction.
Ceci est vrai même à bas débit de gaz frais.
À l’inverse, à l’arrêt de l’administration de protoxyde d’azote, les concentrations alvéolaires s’élèvent rapidement par une diffusion rapide du sang vers l’alvéole et peuvent conduire à une hypoxémie en cas d’hypoventilation d’adjonction alvéolaire et/ou en l’absence d’oxygène au mélange de gaz inspiré.
Ce phénomène d’hypoxémie de diffusion est à l’origine d’une morbidité anesthésique non négligeable par le passé mais encore rencontrée de nos jours.
Propriétés anesthésiques
Faible pouvoir anesthésique => adjuvant des anesthésiques, (inhalé +++).
Épargne ≈ 30 % les halogénés
Épargne ≈ 25 % propofol
=> économie de 20 % du coût pharmacologique de l’anesthésie.
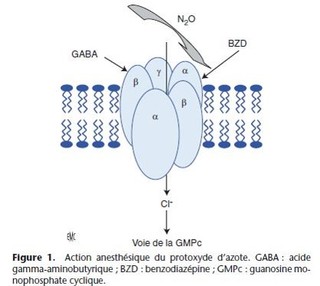
Trois cibles du protoxyde d’azote ont été récemment suggérées.
- Facilitation de la neurotransmission GABAergique inhibitrice par une action directe du protoxyde d’azote sur la sous-unité alpha des récepteurs aux benzodiazépines (canal ionique à 5 sous-unités ligand-dépendant) .
- Hyperpolarisation du neurone par de la conductance potassique après activation des K+
- Action sur les récepteur NMDA (inhibition par le N2O) = inhibition des courants transmembranaires.
Trois cibles du protoxyde d’azote ont été récemment suggérées.
Propriétés analgésiques
Effet analgésique est dose-dépendant et apparaît à partir d’une concentration inspirée de 10 %.
Au-delà de 40 %, l’action hypnotique du gaz prédomine
L’équivalence analgésique [N2O] à 20% = 15 mg morphine en S/C.
Tolérance rapide aux effets analgésiques :
- Effet maximal après 20-30 mn
- Disparait après 150 minutes d’exposition.
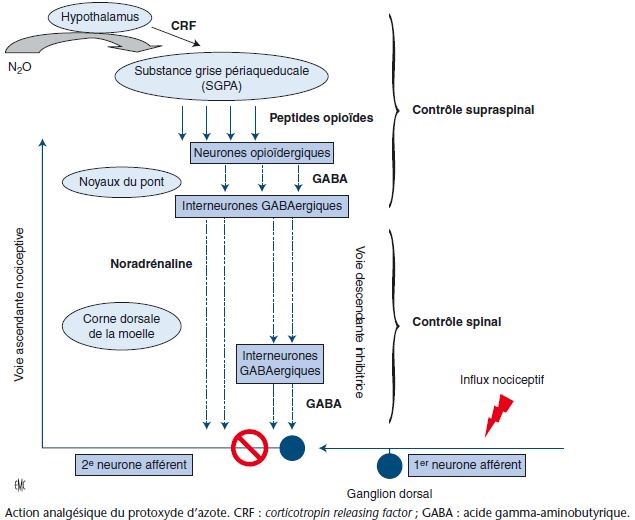
Ces phénomènes analgésiques sont liés à une action spinale et/ou supraspinale avec intervention probable des voies opioïdes (réversibilité de l’analgésie après administration de naloxone)
Effets secondaires indésirables
Nausées - Vomissements postopératoires
l’augmentation de l’incidence des NVPO (chirurgie gynécologique +++) ,
Relation entre l’augmentation des pressions dans l’oreille moyenne et l’incidence des NVPO.
Traitement préventif visant à limiter les NVPO pourrait éviter cet effet indésirable
les NVPO ne semblent pas être un argument majeur motivant le retrait du N2O,
Diffusion au sein des cavités closes
N2O hautement diffusible = coefficient de partage sang-gaz à 0,46 est un (30 > N2).
=> augmentation du volume de cavités expansibles (tube digestif, etc.) dès 30 minutes augmentation des pressions dans les cavités aériques non expansibles (sinus, oreille moyenne).
Utilisation de sondes d’intubation avec des ballonnets « hauts volumes-basse pression » et monitorage de la pression du ballonnet.
Hémodynamiques
Aucun effet Notable
Précaution envers les patients à risque de déficit en vitamine B12 comme en cobalamine ou ceux présentant un déficit en 5-méthyltétrahydrofolate (état procoagulant par l’hyperhomocystéinémie consécutive à l’inhibition de la méthionine-synthétase probable).
Hypoxémie de diffusion
À l’arrêt du N2O, le transfert très rapide vers les alvéoles modifie la pression PaO2 = hypoxémie transitoire => FiO2 = 100 %.
Circulation cérébrale
Administré à [50 % ] + FiO2 à 30 % et en normocapnie, le protoxyde d’azote induit une augmentation du débit sanguin cérébral, du métabolisme cérébral et de la pression intracrânienne.
Déconseillé chez malade à risque (compliance réduite).
Précautions d’emploi
C’est un comburant, c’est-à-dire qu’il se décompose en azote et oxygène si la température excède 450 °C.
=> l’éviter en cas de chirurgie au laser ou utilisation de bistouri électrique à proximité des voies aériennes ou de cavités dans lesquelles le protoxyde d’azote aurait diffusé
Toxicité et pollution
Toxicité neurologique
Les altérations observées sur les gaines de myéline surviennent pour des administrations d’N2O au long cours provoquant une polyneuropathie sensitivomotrice avec atteinte des cordons postérieurs et latéraux de la moelle par démyélinisation des fibres longues.
Risque accru d’atteinte neurologique démyélinisante après exposition répétée et chronique (toxicomanie) mais aussi en cas d’exposition unique au N2O chez les patients porteurs d’un déficit ou d’une carence sévère en vitamine B12.
L’existence d’un tableau neurologique compatible avec une atteinte des fibres myéliniques (troubles moteurs à type de parésies, troubles de la sensibilité, etc.) chez des sujets ayant été soumis à une administration de N2O unique prolongée ou répétée => possibilité d’une atteinte toxique potentiellement réversible et doit faire pratiquer un dosage de vitamine B12 ou d’homocystéine.
De la même façon, en préventif, il convient d’éviter l’exposition longue au protoxyde d’azote (> 6 h) chez les sujets à risque (dénutrition, néoplasie, intoxication alcoolique chronique, carence en folates ou en vitamine B12, etc.).
Toxicité hématologique
Le retentissement le plus précoce de l’altération de la méthylation de l’ADN soumis à une exposition de protoxyde d’azote a lieu au niveau de cellules à renouvellement rapide : les cellules hématopoïétiques sous la forme d’une anémie mégaloblastique identique aux déficits chroniques en vitamine B12 (après 12 heures d’anesthésie).
Éviter l’administration répéter de protoxyde d’azote à intervalles rapprochés (intervalle inférieur à 1 semaine) qui ne permettraient pas à la moelle de se régénérer.
Infertilité et tératogenèse
les effets foetotoxiques du N2O restent plutôt théoriques et nécessitent des investigations complémentaires difficiles à réaliser en l’absence de groupe contrôle aisé à constituer.
Les seuls effets décrits dans une étude analysant des grossesses depuis leur deuxième trimestre sont une association significative de l’usage du N2O à des naissances plus précoces et une tendance à de plus petits poids de naissance.
Contre-indications
Le N2O est contre-indiqué pour les interventions suivantes
- chirurgie des voies aériennes au laser ou au bistouri électrique (le N2O est un comburant) ;
- neurochirurgie en position assise (emboles gazeux) ;
- chirurgie de l'oreille moyenne;
- transplantation hépatique et chirurgie cardiaque avec CEC du fait des emboles gazeux;
- interventions avec administration de nitroprussiate de soude (la cobalamine inactive l'ion cyanure) ;
- interventions dépassant 24 heures;
- interventions itératives, répétées à des intervalles inférieurs à une semaine.
L'usage du N2O n'est pas recommandé chez les patients suivants :
- patients avec compliance intracrânienne diminuée;
- patients admis pour traumatisme du thorax et à risque de pneumothorax ;
- patients avec une insuffisance ventriculaire gauche, par contre, une insuffisance coronarienne n'est pas une contre-indication;
- patients avec des antécédents de maladie de l'oreille moyenne (perforation du tympan), ou dont un sinus ne communique plus avec les voies aériennes ;
- patients avec des antécédents de nausées et vomissements postopératoires sévères;
- patients âgés, avec un abdomen distendu et une occlusion devant subir une intervention prolongée;
- patients déficitaires en vitamine B12 ou avec un syndrome neuro-anémique lié à ce déficit;
- patients en état de défaillance multiviscérale, avec une infection sévère, devant subir une reprise chirurgicale pour déhiscence de suture
introduction
Le protoxyde d’azote est un agent volatil utilisé dans le domaine médical depuis plus de 150 ans. Ses propriétés pharmacologiques en font toute la particularité puisqu’il présente à la fois des propriétés analgésiques, de type non morphinique passant par une action supraspinale, des propriétés euphorisantes lui valant la dénomination de « gaz hilarant » et des propriétés anxiolytiques, voire anesthésiques faibles, le faisant largement proposer comme agent anesthésique volatil adjuvant.
Cet agent ancien possède néanmoins un certain nombre de contre-indications à son emploi, parmi lesquelles se trouvent les patients présentant des déficits connus ou probables en vitamine B12, ou en folates, et les épanchements aériques de cavités non extensibles. Enfin, un certain nombre d’effets indésirables, tels les nausées et vomissements postopératoires, les effets neurotoxiques, etc., sont rapportés justifiant finalement son emploi raisonné et probablement restreint.
Propriétés pharmacologiques
Pharmacodynamie – pharmacocinétique
La cinétique du N2O détermine trois de ses caractéristiques majeures :
- la vitesse d'induction, c'est-à-dire la possibilité d'induire l'anesthésie au masque ;
- sa diffusion dans les cavités closes ;
- la vitesse du réveil, c'est-à-dire la possibilité de l'utiliser chez le patient ambulatoire
Absorption se fait très rapidement par voie pulmonaire (gaz inhalé).
La concentration alvéolaire du N2O approche la concentration inhalée en quelques minutes car grande diffusibilité et faible solubilité.
La distribution se fait ensuite uniquement sous forme dissoute dans le sang (absence de combinaison sur l’hémoglobine) vers les tissus richement vascularisés, surtout cerveau.
Pas de métabolisme, élimination pulmonaire.
Gaz incolore, inodore, avec discrète saveur sucrée et qui est dépresseur du système nerveux central avec un effet dose-dépendant.
Effet anesthésique à CAM =104 % .
Ne peut être utilisé sans oxygène pour une AG.
Le faible coefficient de solubilité dans l’eau ou l’huile explique un début d’action et une élimination rapides à l’arrêt de toute administration.
Effet deuxième gaz.
Si association avec d’autres agents volatils (halogénés notamment) Il s’agit des modifications de composition d’un mélange gazeux au sein de l’alvéole pulmonaire.
Ainsi, le protoxyde d’azote diffuse plus vite de l’alvéole au compartiment sanguin lorsqu’il est ajouté secondairement à un mélange de gaz contenant un agent halogéné.
La concentration de cet halogéné est alors augmenté, ce qui permettrait d’accélérer la vitesse d’induction.
Ceci est vrai même à bas débit de gaz frais.
À l’inverse, à l’arrêt de l’administration de protoxyde d’azote, les concentrations alvéolaires s’élèvent rapidement par une diffusion rapide du sang vers l’alvéole et peuvent conduire à une hypoxémie en cas d’hypoventilation d’adjonction alvéolaire et/ou en l’absence d’oxygène au mélange de gaz inspiré.
Ce phénomène d’hypoxémie de diffusion est à l’origine d’une morbidité anesthésique non négligeable par le passé mais encore rencontrée de nos jours.
Propriétés anesthésiques
Faible pouvoir anesthésique => adjuvant des anesthésiques, (inhalé +++).
Épargne ≈ 30 % les halogénés
Épargne ≈ 25 % propofol
=> économie de 20 % du coût pharmacologique de l’anesthésie.
Trois cibles du protoxyde d’azote ont été récemment suggérées.
- Facilitation de la neurotransmission GABAergique inhibitrice par une action directe du protoxyde d’azote sur la sous-unité alpha des récepteurs aux benzodiazépines (canal ionique à 5 sous-unités ligand-dépendant) .
- Hyperpolarisation du neurone par de la conductance potassique après activation des K+
- Action sur les récepteur NMDA (inhibition par le N2O) = inhibition des courants transmembranaires.
Trois cibles du protoxyde d’azote ont été récemment suggérées.

Propriétés analgésiques
Effet analgésique est dose-dépendant et apparaît à partir d’une concentration inspirée de 10 %.
Au-delà de 40 %, l’action hypnotique du gaz prédomine
L’équivalence analgésique [N2O] à 20% = 15 mg morphine en S/C.
Tolérance rapide aux effets analgésiques :
- Effet maximal après 20-30 mn
- Disparait après 150 minutes d’exposition.
Ces phénomènes analgésiques sont liés à une action spinale et/ou supraspinale avec intervention probable des voies opioïdes (réversibilité de l’analgésie après administration de naloxone)

Effets secondaires indésirables
Nausées - Vomissements postopératoires
l’augmentation de l’incidence des NVPO (chirurgie gynécologique +++) ,
Relation entre l’augmentation des pressions dans l’oreille moyenne et l’incidence des NVPO.
Traitement préventif visant à limiter les NVPO pourrait éviter cet effet indésirable
les NVPO ne semblent pas être un argument majeur motivant le retrait du N2O,
Diffusion au sein des cavités closes
N2O hautement diffusible = coefficient de partage sang-gaz à 0,46 est un (30 > N2).
=> augmentation du volume de cavités expansibles (tube digestif, etc.) dès 30 minutes augmentation des pressions dans les cavités aériques non expansibles (sinus, oreille moyenne).
Utilisation de sondes d’intubation avec des ballonnets « hauts volumes-basse pression » et monitorage de la pression du ballonnet.
Hémodynamiques
Aucun effet Notable
Précaution envers les patients à risque de déficit en vitamine B12 comme en cobalamine ou ceux présentant un déficit en 5-méthyltétrahydrofolate (état procoagulant par l’hyperhomocystéinémie consécutive à l’inhibition de la méthionine-synthétase probable).
Hypoxémie de diffusion
À l’arrêt du N2O, le transfert très rapide vers les alvéoles modifie la pression PaO2 = hypoxémie transitoire => FiO2 = 100 %.
Circulation cérébrale
Administré à [50 % ] + FiO2 à 30 % et en normocapnie, le protoxyde d’azote induit une augmentation du débit sanguin cérébral, du métabolisme cérébral et de la pression intracrânienne.
Déconseillé chez malade à risque (compliance réduite).
Précautions d’emploi
C’est un comburant, c’est-à-dire qu’il se décompose en azote et oxygène si la température excède 450 °C.
=> l’éviter en cas de chirurgie au laser ou utilisation de bistouri électrique à proximité des voies aériennes ou de cavités dans lesquelles le protoxyde d’azote aurait diffusé
Toxicité et pollution
Toxicité neurologique
Les altérations observées sur les gaines de myéline surviennent pour des administrations d’N2O au long cours provoquant une polyneuropathie sensitivomotrice avec atteinte des cordons postérieurs et latéraux de la moelle par démyélinisation des fibres longues.
Risque accru d’atteinte neurologique démyélinisante après exposition répétée et chronique (toxicomanie) mais aussi en cas d’exposition unique au N2O chez les patients porteurs d’un déficit ou d’une carence sévère en vitamine B12.
L’existence d’un tableau neurologique compatible avec une atteinte des fibres myéliniques (troubles moteurs à type de parésies, troubles de la sensibilité, etc.) chez des sujets ayant été soumis à une administration de N2O unique prolongée ou répétée => possibilité d’une atteinte toxique potentiellement réversible et doit faire pratiquer un dosage de vitamine B12 ou d’homocystéine.
De la même façon, en préventif, il convient d’éviter l’exposition longue au protoxyde d’azote (> 6 h) chez les sujets à risque (dénutrition, néoplasie, intoxication alcoolique chronique, carence en folates ou en vitamine B12, etc.).
Toxicité hématologique
Le retentissement le plus précoce de l’altération de la méthylation de l’ADN soumis à une exposition de protoxyde d’azote a lieu au niveau de cellules à renouvellement rapide : les cellules hématopoïétiques sous la forme d’une anémie mégaloblastique identique aux déficits chroniques en vitamine B12 (après 12 heures d’anesthésie).
Éviter l’administration répéter de protoxyde d’azote à intervalles rapprochés (intervalle inférieur à 1 semaine) qui ne permettraient pas à la moelle de se régénérer.
Infertilité et tératogenèse
les effets foetotoxiques du N2O restent plutôt théoriques et nécessitent des investigations complémentaires difficiles à réaliser en l’absence de groupe contrôle aisé à constituer.
Les seuls effets décrits dans une étude analysant des grossesses depuis leur deuxième trimestre sont une association significative de l’usage du N2O à des naissances plus précoces et une tendance à de plus petits poids de naissance.
Contre-indications
Le N2O est contre-indiqué pour les interventions suivantes
- chirurgie des voies aériennes au laser ou au bistouri électrique (le N2O est un comburant) ;
- neurochirurgie en position assise (emboles gazeux) ;
- chirurgie de l'oreille moyenne;
- transplantation hépatique et chirurgie cardiaque avec CEC du fait des emboles gazeux;
- interventions avec administration de nitroprussiate de soude (la cobalamine inactive l'ion cyanure) ;
- interventions dépassant 24 heures;
- interventions itératives, répétées à des intervalles inférieurs à une semaine.
L'usage du N2O n'est pas recommandé chez les patients suivants :
- patients avec compliance intracrânienne diminuée;
- patients admis pour traumatisme du thorax et à risque de pneumothorax ;
- patients avec une insuffisance ventriculaire gauche, par contre, une insuffisance coronarienne n'est pas une contre-indication;
- patients avec des antécédents de maladie de l'oreille moyenne (perforation du tympan), ou dont un sinus ne communique plus avec les voies aériennes ;
- patients avec des antécédents de nausées et vomissements postopératoires sévères;
- patients âgés, avec un abdomen distendu et une occlusion devant subir une intervention prolongée;
- patients déficitaires en vitamine B12 ou avec un syndrome neuro-anémique lié à ce déficit;
- patients en état de défaillance multiviscérale, avec une infection sévère, devant subir une reprise chirurgicale pour déhiscence de suture