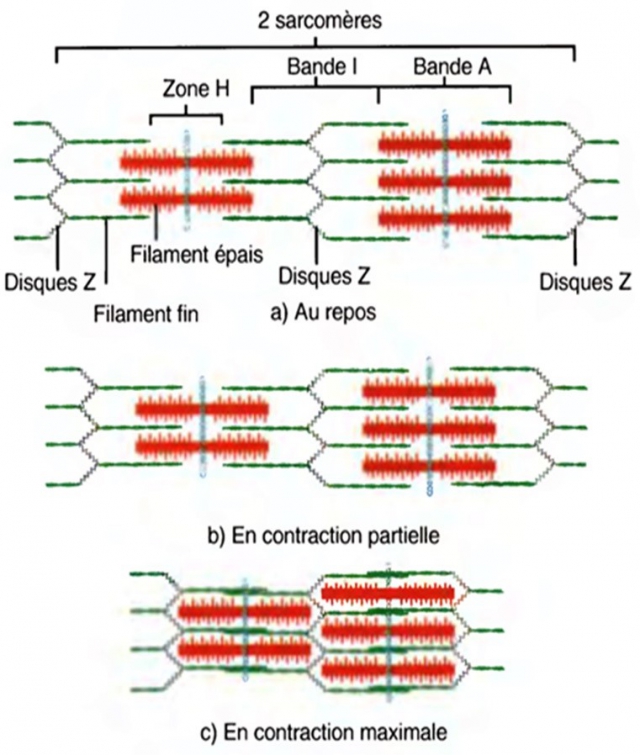
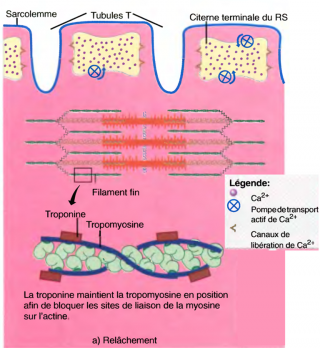
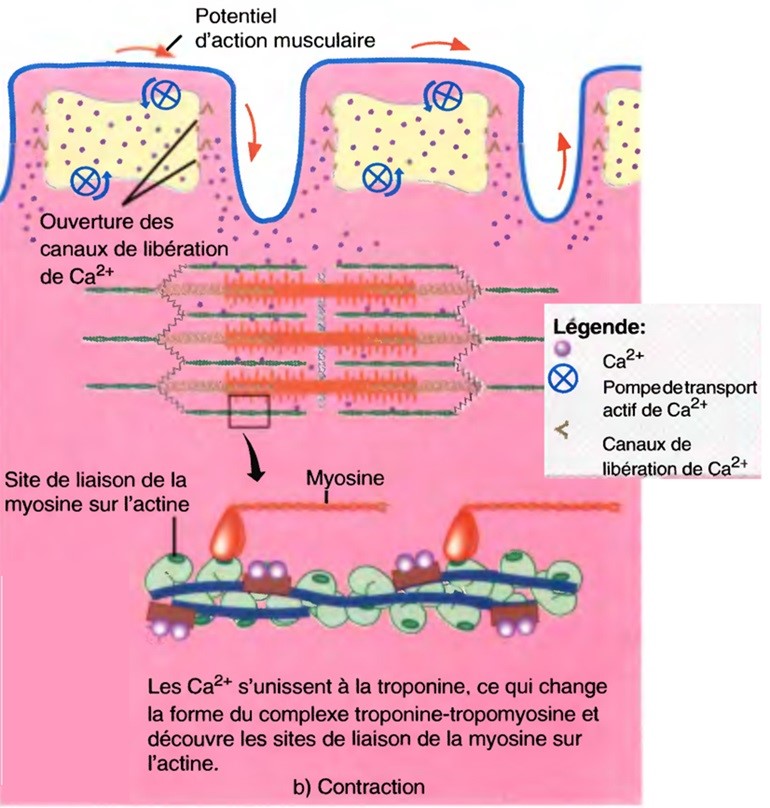
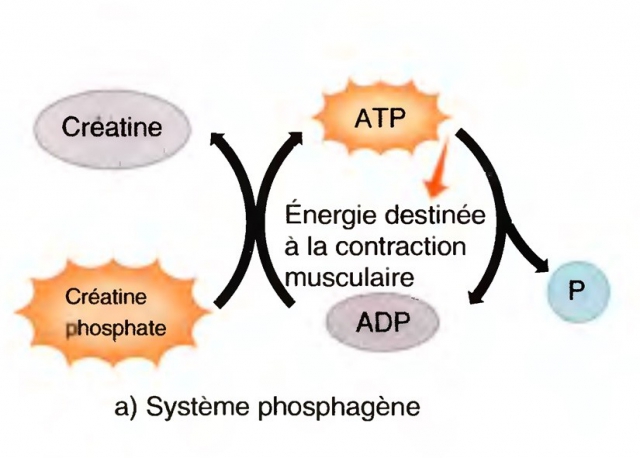
Introduction
Principales affections musculaires
Aujourd’hui plusieurs dizaines de maladies musculaires ont été identifiées sur des bases cliniques, histopathologiques, et la définition moléculaire de nombre d’entre elles est acquise.
|
caractérisées par une altération primaire des fibres entraînant disparition progressive de celles ci
|
|
2.myopathies congénitales
|
caractérisées par une perturbation du développement de la fibre musculaire, habituellement associée à des altérations de la structure interne des fibres
|
|
3.myopathies métaboliques
|
correspondant à un dysfonctionnement de la voie de dégradation des sucres (glycogénoses), du métabolisme des graisses (lipidoses), de la chaîne respiratoire mitochondriale (myopathies mitochondriales)
|
|
4.affections musculaires dues à une anomalie de l’excitabilité membranaire
|
(syndromes myotoniques, paralysies périodiques)
|
|
5.affections musculaires acquises, d’origine inflammatoire, toxique, iatrogène ou endocrinienne
|
|
|
6.syndromes myasthéniques
|
secondaires à une perturbation de la transmission neuromusculaire
|
|
affections d’origine génétique
|
Démarche diagnostic
Quand penser à une affection musculaire ?
On évoque d’emblée une maladie musculaire devant:
- une myolyse aigüe (tableau brutal de nécrose musculaire avec forte élévation des CPK et myoglobinurie),
- un déficit moteur progressif,
- prédominant aux racines,
- s’accompagnant d’une modification du volume musculaire (amyotrophie, parfois hypertrophie)
- et souvent d’une élévation des CPK.
Mais y penser dans d’autres circonstances :
- hypotonie néonatale,
- ophtalmoplégie chronique qui peut se limiter à un ptosis sans diplopie,
- contractures musculaires,
- intolérance à l’effort évocatrice de myopathie métabolique lorsque se conjuguent simultanément lors de l’exercice un enraidissement douloureux des muscles (± crampes),
- une perte en puissance (fatigabilité)
- et un essoufflement.
Réunir les éléments cliniques et paracliniques pour parvenir au diagnostic étiologique
a. Diagnostic des principales affections musculaires
i. Affections musculaires à début néonatal
- expression clinique
- démarche diagnostique
- antécédents familiaux, biopsie musculaire, EMG, cardiomyopathie, contexte métabolique (acidose lactique, acidurie organique), enquête génétique : expansion de triplets CTG, délétion gène SMN, autres
- principales entités
ii. Déficit musculaire proximal lentement progressif, héréditaire
- diagnostic
- transmission, répartition du déficit, myotonie, distribution des rétractions, cardiopathie, biopsie : formule dystrophique, anomalies de la dystrophine, des sarcoglycanes, étude génétique
- principales entités
- autosomique dominante
- récessive liée à l’X (garçon atteint, mère transmettrice)
- autosomique récessive
iii. Déficit musculaire distal lentement progressif, héréditaire
- myopathies distales : récessives, précoces : Miyoshi (dystrophique), Nonaka (vacuoles) ; dominantes, tardives : Welander (Suède), Markesberry et Griggs, Finlandaise
iv. Déficit musculaire acquis, rapidement évolutif
- diagnostic
- contexte inflammatoire, plurisystémique, toxique, iatrogène, endocrinien, biopsie
- principales entités
v. Syndromes myotoniques
- diagnostic
- myotonie, paramyotonie, transmission, déficit distal ou proximal, atteinte plurisystèmique, étude de l’ADN, biopsie
- principales entités
- maladie de Steinert (voir supra) , étiologie la plus fréquente ; expansion CTG
- PROMM : myopathie proximale avec myotonie ; proche du Steinert, mais déficit proximal, pas d’expansion CTG
- les myotonies congénitales : début précoce, pas de déficit ni atteinte plurisystémique ; dominante = Thomsen, récessive = Becker ; mutations du gène du canal chlore
- paramyotonie de Von Eulenburg : aggravation de la myotonie à la répétition du mouvement et au froid, transmission dominante, mutations du gène du canal sodium
- syndrome de Schwartz-Jampel : chondrodysplasie, dysmorphie
vi. Episodes paralytiques récidivants
- diagnostic
- kaliémie au cours de la crise, antécédents familiaux, myotonie, biopsie, étude de l’ADN
- principales entités
- héréditaires à transmission dominante
- paralysie familiale hypokaliémique ; mutations du gène du canal calcium
- paralysie familiale hyperkaliémique : myotonie, mutation gène canal sodium
- dans les 2 cas vacuoles et agrégats tubulaires
- acquises
- hypokaliémique : thyrotoxicose, diarrhée, vomissements, diurétiques, hyperaldostéronisme
- hyperkaliémie : insuffisance rénale, insuffisance surrénale
vii. Ophtalmoplégie ± troubles bulbaires ± déficit ou fatigabilité des membres
- diagnostic
- profil évolutif, notion familiale, atteinte plurisystémique, test au tensilon, bloc NM, dosage d’anticorps anti-RACh, biopsie, génétique
- principales entités
- myasthénie : poussées, Reversol +, bloc NM, présence d’anticorps anti-RACh
- myopathie mitochondriale : notion familiale, intolérance à l’effort avec myalgies, essoufflement, surdité, rétinite pigmentaire, cardiopathie, ataxie cérebelleuse, hyperlactatémie, biopsie : surcharge mitochondriale : ragged red fibers
- myopathie oculopharyngée : autosomique dominante, absence d’atteinte plurisystémique après 60 ans, biopsie : vacuoles bordées, tubulofilaments de 8.5 nm ; génétique : expansion GCG du gène de la Poly A Binding
viii. Myolyse et/ou intolérance à l’effort
- démarche diagnostique
- recherche d’épisodes de nécrose musculaire aig üe (myolyse), épreuve d’effort (production d’acide lactique), biopsie (accumulation de glycogène ou de lipides, dosages enzymatiques)
- principales entités
- glycogénoses : déficit en phosphorylase (McArdle), phosphorylase kinase, enzymes de la glycolyse, myolyse, intolérance à l’effort bref, absence d’élévation des lactates à l’effort, surcharge en glycogène à la biopsie
- déficit en carnitine palmityl transférase : myolyse après jeûne et/ou effort prolongé biopsie normale ou surcharge discrète en lipides, activité enzymatique diminuée (lymphocytes et muscle)
- myopathies mitochondriales : pas de myolyse, hyperlactacidémie, atteinte plurisystémique, biopsie : ragged red fibers
- autres déficits enzymatiques : myoadénylate déaminase, bétaoxydation, inconnus
- diagnostic differentiel
|
Myopathies iatrogènes
|
|
myopathie focale
|
effet direct de l’aiguille, effet dû au produit injecté : opiacés, chlorpromazine
|
|
myopathie aigüe ou subaigüe, douloureuse et déficitaire
|
hypocholéstérolémiants, acide epsilon caproïque, émétine, vincristine, zidovudine (azt), cimétidine, lithium, danazol, certains cytotoxiques, produits donnant une hypokaliémie : diurétiques, laxatifs, amphotéricine B, réglisse
|
|
myolyse aigüe
|
lithium, barbituriques, benzodiazépine, antihistaminiques, neuroleptiques, paracetamol, oxyprenolol, phenformine, glutethimide (contexte favorisant : coma, crises comitiales), hypokaliémiants (voir supra), etc
|
|
myopathie subaigüe ou chronique avec déficit indolore
|
corticoïdes, chloroquine, colchicine, maléate de perhexilline
|
|
syndromes myasthéniques
|
antibiotiques : aminoglycosides, polymyxine, tétracyclines
anésthésiques : curare, suxamethonium
bétabloquants, chlorpromazine, phenytoïne, trimethadione, procaïnamide, colchicine, D pénicillamine
|
|
myotonie
|
diazocholesterol, acide epsilon caproïque, chloroquine
bétabloquants, suxaméthonium : aggravation d’une myotonie préexistante (Steinert)
|
|
hyperthermie maligne
|
produits en cause : suxamethonium, halotane
effet préventif et thérapeutique du Dantrolène
contexte : affection musculaire primitive, autosomique dominante, myopathie congénitale à central core, myotonie congénitale, Duchenne/Becker
|
|
myopathies inflammatoires
|
pénicillamine, cimetidine
réaction du greffon contre l’hôte : polymyosite
tryptophane : fasciite
|
-
b. L’interrogatoire
- Nature des symptômes.
- Profil chronologique : âge de début (période néonatale jusqu’à l’âge adulte), rapidité d’évolution de la symptomatologie..
- Transmission familiale : on recherche, en dressant l’arbre généalogique, non seulement des cas identiques, mais également des formes beaucoup plus discrètes et on ne doit pas négliger d’autres pathologies qui pourraient avoir un rapport avec une affection musculaire (par exemple une cardiomyopathie).
- Recherche d’un contexte iatrogène ou toxique
c. L’examen clinique
- L’examen clinique doit être simple, permettant de répondre à des questions précises :
- Existe-t-il un déficit moteur et quelles en sont les caractéristiques ?
- Existe-t-il une ophtalmoplégie extrinsèque qui peut se limiter à un ptosis ?
- Existe-t-il d’autres signes que l’atteinte musculaire ?
d. Les examens complémentaires
- Le dosage des CPK sériques
- L’électromyogramme
- L’imagerie musculaire
- L’épreuve d’effort
- La biopsie musculaire
- La caractérisation de l’anomalie génique pour les affections musculaires génétiques.
Une stratégie diagnostique sera élaborée en combinant les différentes informations recueillies
- affections musculaires à début néonatal
- déficit musculaire lentement évolutif, héréditaire
- rétractions musculo-tendineuses, affectant les coudes + cardiopathie (troubles du rythme et/ou de la conduction cardiaque), héréditaire
- déficit musculaire acquis, rapidement évolutif
- syndromes myotoniques
- épisodes paralytiques récidivants
- affections se manifestant par une ophtalmoplégie +- des troubles bulbaires +- un déficit et/ou une fatigabilté des membres
- myolyse et/ ou intolérance à l’effort
- contexte iatrogène
- élévation isolée de CPK.
Description des principales affections musculaires
1. Affections musculaires à début néonatal
Clinque: dominée par l’hypotonie, biopsie musculaire est l’examen fondamental qui permet d’établir le diagnostic et souvent de classer précisément la myopathie
Certaines myopathies congénitales, (myopathie myotubulaire entraînant un décès dans les premières semaines de vie. )
Dans d’autres cas (myopathie à central core) l’affection est bénigne, non évolutive, => diagnostic n’est parfois posé qu’à l’âge adulte.
2. Affections musculaires se manifestant par un déficit musculaire lentement évolutif, héréditaire
a. Affections transmises selon un mode dominant
i. La myopathie facio-scapulo-humérale
ii. La dystrophie myotonique (maladie de Steinert)
b. Affections de transmission récessive liée à l’X (mère transmettrice, asymptômatique, garçons atteints)
i. La maladie de Duchenne
ii. La myopathie de Becker
c. Dystrophies musculaires autosomiques récessives
i. Sarcoglycanopathies
iii. Dysferlinopathies
d. Dystrophies hétérogènes sur le plan génétique
i. La dystrophies d’Emery-Dreifuss
ii. Myopathies distales
Affections musculaires acquises, évolutives
a. Les myopathies inflammatoires
Forment un groupe hétérogène d’affections musculaires acquises, appartenant à la famille des collagénoses, induisant une faiblesse musculaire et comportant des anomalies histologiques du tissu musculaire dominées par la présence d’infiltrats inflammatoires.
Schématiquement 3 entités sont reconnues :
i. polymyosite (PM),
ii. dermatomyosite (DM),
iii. myosite à inclusion (IBM)
Tableau clinique
Examens complémentaires
- L’élévation de la VS et des CK est inconstante, retrouvée respectivement dans environ 50 et 80 % des cas.
- L’EMG : est myogène avec en outre une activité de fibrillation traduisant la nécrose
- L’IRM musculaire permet de mettre en évidence une inflammation.
- Dosage des anticorps plus spécifiques de myopathie inflammatoire
Traitement
- Les PM/DM sont des affections graves dont la mortalité spontanée s’élève à 70 %.
- La corticothérapie constitue le traitement de première intention
- Alternatives thérapeutiques: immunosuppresseurs
b. Les myopathies endocriniennes
L’atteinte du tissu musculaire squelettique fait partie de la plupart des syndromes endocriniens
i. Myopathies hyperthyroïdiennes
Clinique: La faiblesse musculaire proximale, fatigabilité musculaire et générale, parfois atrophie mais, pas de douleurs.
Les créatine-kinases sériques sont normales.
Corticothérapie à forte dose est indiquée.
ii.Hypothyroïdie
Clinique: se manifeste par une faiblesse musculaire, des crampes, un enraidissement musculaire douloureux.
Diagnostic confirmé par la mise en évidence d’un taux abaissé d’hormones thyroïdiennes
Corrigée par le traitement substitutif.
iii. Myopathies secondaires à une anomalie du métabolisme calcique et la vitamine D
Hyperparathyroïdie: est soit primaire, consécutive à un adénome parathyroïdien, soit secondaire à une insuffisance rénale
Ostéomalacie: due soit à une carence d’apport en vitamine D ou anomalie de son métabolisme, signes osseux (douleurs, déformations et fractures, déminéralisation osseuse), les anomalies du bilan phosphocalcique, le traitement par vitamine D corrige l’atteinte musculaire
iv. Myopathie au cours des hypercorticismes
L’atteinte musculaire est pratiquement constante dans le syndrome de Cushing.
v. Affections musculaires et pathologie hypophysaire.
- Acromégalie
- L’insuffisance hypophysaire
- Diabète
vi. Les complications neuromusculaires du diabète: sont d’origine neuropathique :
polyneuropathie symétrique distale, mononévrite, plexopathie lombosacrée.
c. Les myopathies toxiques et iatrogènes: Voir tableau ci dessous
|
absolues
|
Curarisants
Aminosides, colimycine, polymyxine, cyclines injectables
Quinines, quinidine, procaïnamide
Béta-bloquants (même en collyre)
Diphenyl-hydantoïne, trimethadione
Dantrolène
D-penicillamine
|
|
relatives
|
Benzodiazépine
Neuroleptiques
Carbamazépine
Lithium
|
|
cas particuliers
|
•l’allopurinol potentialise l’effet de l’azathioprine : il faut réduire la dose des 2/3
•l’injection d’iode pour examen radiologique de contraste peut induire une décompensation aigüe ; elle est déconseillée en cas de poussée
•vaccinations : retentissement sur la myasthénie mal documenté. La vaccination contre la poliomyélite, le tétanos et la grippe n’entraînent pas d’aggravation lorsque la myasthénie est bien contrôlée. Les vaccins vivants (par exemple polio buccal) sont formellement contre-indiqués chez les patients sous corticoïdes ou immunosuppresseurs
•l’interféron alpha peut aggraver voire induire une myasthénie
•l’utilisation de patch de nicotine pour le sevrage de l’intoxication tabagique peut aggraver la myasthénie
•pour les curarisants, l’usage de molécules non dépolarisantes de dégradation rapide, comme l’atracurium, est possible
|
Affections musculaires induisant des épisodes paralytiques récidivants
La survenue d’épisodes déficitaires, récidivants, durant quelques heures à quelques jours, débutant souvent dans l’enfance oriente vers une paralysie périodique dyskaliémique.
Selon que la kaliémie est basse ou élevée, on distinguera les paralysies hypokaliémiques dont les formes héréditaires correspondent à une mutation du canal calcium musculaire et les formes hyperkalémiques, secondaires à une mutation du canal sodium membranaire.
Affections musculaires se manifestant par une ophtalmoplégie ± troubles bulbaires ± déficit et / ou fatigabilité des membres
a. La myasthénie
Dysfonctionnement de la transmission neuromusculaire qui se traduit cliniquement par une faiblesse musculaire accentuée par l’effort.
Physiopathologie:
Due à la réduction du nombre de récepteurs de l’acétylcholine situés sur le versant musculaire de la synapse neuromusculaire, sous l’action d’anticorps pathogènes.
Clinique :
Touche surtout les sujets de moins de 40 ans, (60 à 70 % femmes).
Se caractérise par une faiblesse musculaire très dépendante de l’effort qui l’aggrave voire la provoque lorsqu’il est prolongé ou répété
Les premières manifestations sont purement oculaires avec chute de paupière (ptosis) et vision dédoublée (diplopie) mais après un an d’évolution, chez 85 à 90 % des patients, la myasthénie est généralisée
Sévérité de la maladie très variable
L’atteinte des muscles respiratoires et les troubles sévères de déglutition caractérisent les formes graves (20 à 30 % des patients) qui doivent être prises en charge en réanimation (pose d’une sonde gastrique, ventilation assistée).
Traitement:
- Eviter les curares
- Les anticholinestérasiques seront toujours utilisés, permettant d’améliorer transitoirement la performance musculaire (Mestinon® et la Mytélase ®)
- La thymectomie en cas de thymome
- La corticothérapie et les immunosuppresseurs sont indiqués dans les formes sévères de myasthénie
- Dans les poussées sévères, les plasmaphérèses et les perfusions d’Immunoglobulines G permettent une amélioration rapide sur quelques jours
- La réanimation est impérative dans les formes sévères permettant d’assurer la ventilation. C’est avant tout grâce à elle que la mortalité a chuté depuis 30 ans.
b. Une myopathie oculaire est évoquée lorsque l’ophtalmoplégie a une évolution chronique, lentement progressive
Deux types de myopathie
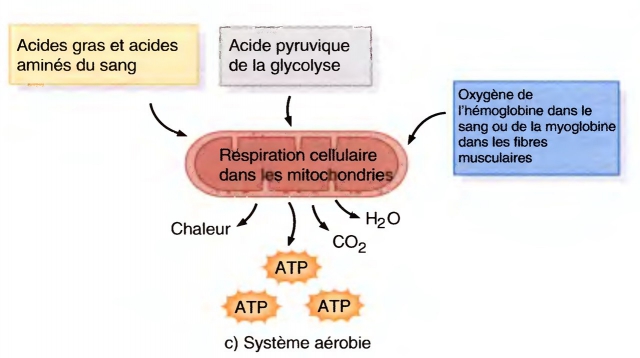
- Les myopathies mitochondriales qui se voient à tout âge, s’accompagnent souvent d’une intolérance à l’effort et d’une atteinte plurisystémique (surdité, rétinite pigmentaire, atteinte du système nerveux central, neuropathie périphérique, cardiomyopathie)
- La myopathie oculopharyngée est plus rare, débutant tardivement après 40 ans et de transmission autosomique dominante.
Myopathies à l’origine d’une intolérance à l’effort ± myolyse
En cas de myolyse responsable d’une élévation transitoire et massive des enzymes musculaires avec myoglobinurie, le diagnostic de myopathie métabolique est aisé.
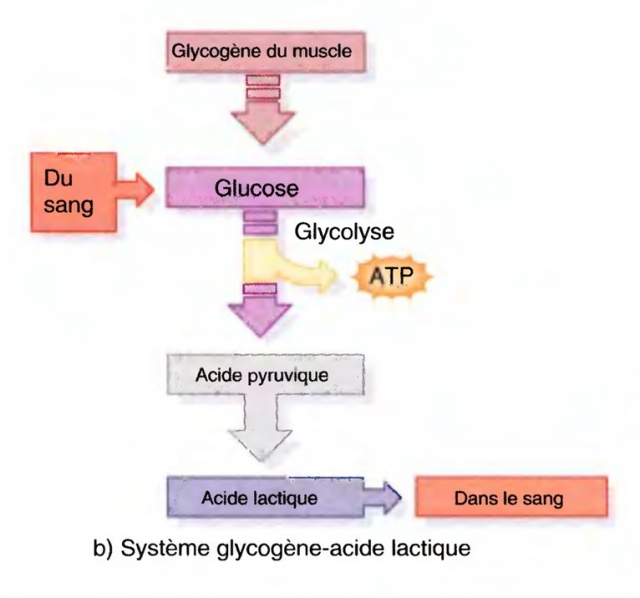
L’anomalie porte soit sur la voie de dégradation des sucres (glycogénose dont le type le plus fréquent est la maladie de McArdle), soit sur la carnitine palmityl transférase (CPT).
Lorsqu’il existe une intolérance vraie à l’effort associant lors de l’exercice, courbatures, fatigabilité musculaire et essoufflement, l’hypothèse métabolique est encore très vraisemblable.
Outre les causes vues plus haut, la possibilité d’une myopathie mitochondriale est à envisager.
Myopathies iatrogènes et toxiques
De nombreux agents thérapeutiques ont un effet pathogène sur le muscle dont l’expression est variée. La responsabilité de l’agent pathogène sera confirmée par la correction des troubles à l’arrêt de celui-ci.
L’alcool est responsable de complications musculaires aigües (myolyse), chroniques (déficit pelvi-fémoral amyotrophiant plutôt d’origine neurogène), et d’une cardiomyopathie.
L’Hyperthermie maligne (HM) se caractérise par la survenue d’une myolyse très sévère avec hyperthermie déclenchée par certains agents anesthésiques : l’Halotane et la succinylcholine.
Traitement et prise en charge (Cf au chapitre 4.13.5).
Elévation isolée des CPK
En l’absence de toute symptomatologie musculaire, une élévation des CPK pose un problème diagnostic difficile.
Si elle persiste après une période de repos, on recherchera une étiologie :
- hypothyroïdie,
- statut porteur d’une dystrophie (en particulier dystrophinopathie),
- prise médicamenteuse toxique pour le muscle , susceptibilité à l’hyperthermie maligne (HM°).
Une élévation modérée des CPK, non pathologique, est retrouvée chez les sujets de race noire.
 Merci cela m'a beaucoup aidé
Merci cela m'a beaucoup aidé Merci cela m'a aidé
Merci cela m'a aidé