- Accueil
- Modules 1ére année
- 3. TECHNIQUES D'ANESTHÉSIES (Vh : 90 h, Coef : 3)
- Circuits d'anesthésie
Circuits d'anesthésie
Manuel pratique d’anesthésie 3e édition.2015.T. Langenberger, E. Albrecht
Les appareils d'anesthésie présentent tous les mêmes fonctions de base :
- administration de gaz médicaux (débit de gaz frais [DGF]) sur un mode manuel ou automatique (ventilateur), après réduction des pressions d'arrivée (3,7 ± 0,5 bar) provenant de l'alimentation murale ou de la bouteille à la pression de travail (1 bar) ;
- mélange des gaz avec des agents anesthésiques volatils (halogénés) au moyen de vaporisateurs ou injecteurs ;
- monitorage des paramètres de l'appareil et du patient.
Caractéristiques des différents circuits
- De nombreux systèmes ont vu le jour depuis les prémices de l'anesthésiepar inhalation jusqu'à nos jours, où l'informatisation et la technique dominent. On distingue :
- les circuits ouverts (open drop anesthesia), sans réinhalation ;
- les circuits semi-ouverts (circuits de Mapleson), avec réinhalation partielle et sans absorbeur de CO2 : le DGF est supérieur à la ventilation minute du patient ;
- les circuits circulaires, avec réinhalation subtotale et absorbeur de CO2 :
- le DGF est inférieur à la ventilation minute du patient, mais supérieur au volume des gaz absorbés.
Open drop anesthesia
- Cette technique d'anesthésie historique consiste à appliquer sur le visagedu patient un masque g rillagé (masque de Schimmelbusch) contenant une gaze imbibée d'anesthésique volatil, par exemple l'éther.
- L'air inspiré traversant la bande de gaze vaporise l'agent anesthésique et amène de grandes concentrations d'anesthésique volatil au patient.
- Les inconvénients sont nombreux :
- absence de contrôle de la concentration de l'anesthésique volatil ;
- réinhalation de CO2 ;
- dilution de l'O2 par les volatils (risque de mélange hypoxique) ;
- pollution de l'environnement de travail ;
- impossibilité de contrôler la ventilation.
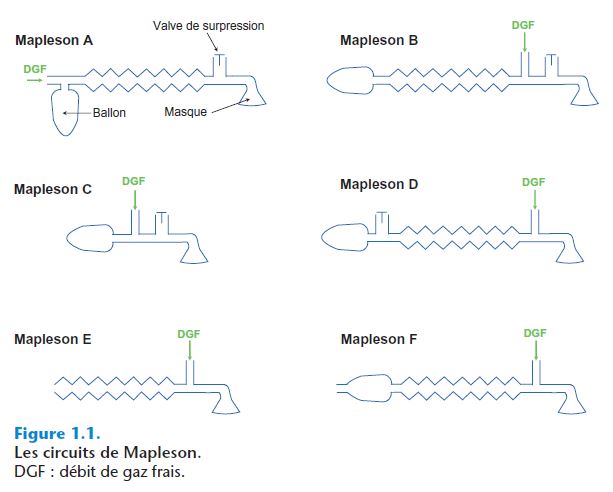
Les circuits de Mapleson
- En 1893, à la recherche d'amélioration des systèmes existants, Ayre invente la pièce en T pour la ventilation spontanée chez les enfants. Mapleson y ajoute une valve et un ballon en 1954 (figure 1.1).
- Tous les circuits qui dérivent de ce système comprennent :
- un tuyau réservoir : ce tuyau, d'un diamètre standard de 20 mm, conditionne le volume du système et sa compliance ; pour pouvoir diminuer les besoins en DGF, il faut que le volume du tuyau soit équivalent au volume courant du patient ; la différence entre le volume administré à chaque pression sur le ballon de ventilation et le volume reçu par le patient est d'autant plus grande que la compliance du tuyau augmente ;
- une valve de surpression : cette valve permet d'éviter des lésions secondaires à une élévation de pression (par exemple barotraumatisme) ;
- une arrivée de DGF : le DGF chasse l'air expiré chargé de CO2 à travers la valve de surpression avant chaque mouvement inspiratoire, puis remplit l'espace disponible par un mélange de gaz frais. Si le volume du système est plus grand ou égal au volume courant, la prochaine inspiration ne contiendra que du gaz frais, à condition que le DGF soit important ; sinon, il y aura une réinhalation ;
- un ballon de ventilation.
- Le circuit de Mapleson présente les avantages :
- d'être économique, simple, léger et solide ;
- d'être facile à entretenir, à laver et à stériliser ;
- de ne pas nécessiter de valve unidirectionnelle de flux ;
- de présenter des résistances faibles.
- Ses inconvénients sont :
- la nécessité d'utiliser des DGF importants pour empêcher la réinhalation du CO2 expiré en raison de l'absence de valve unidirectionnelle et d'absorbeur de CO2 ;
- la pollution importante de l'environnement ;
- la perte de chaleur et d'humidité ;
- une valve proche du patient dans les systèmes A, B, C, potentiellement inaccessible ;
- une évacuation des gaz complexe avec les systèmes E et F.
Mapleson A
Le circuit de Mapleson A est aussi appelé circuit de Magill.
- Ce système est le plus efficace des circuits de Mapleson pour la ventilation spontanée ; en effet, le DGF peut être égal à la ventilation minute car l'expiration du gaz alvéolaire se fait directement par la valve, qui se trouve à proximité du patient. Le système se remplit ensuite de gaz frais avant l'inspiration suivante.
- En ventilation contrôlée, le DGF doit être supérieur à la ventilation minute d'un facteur 2 à 3 :
- la ventilation contrôlée nécessite des pressions positives et impose unefermeture partiell e de la valve. Ainsi, le volume courant expiré par le patient ne peut pas s'échapper et remplit le système. Le gaz expiré doit être chassé par le DGF qui doit être égal à 2–3 fois la ventilation minute. Une partie de ce gaz s'échappe aussi par la valve de surpression durant l'insufflation.
- Le circuit de Lack est un circuit de Mapleson A modifié, dans lequel le DGF arrive à l'extérieur du tube coaxial, soit autour du gaz expiré.
- Ce circuit est utilisable chez les enfants de plus de 25 kg.
Mapleson B et C
Ces circuits ne sont plus utilisés.
Mapleson D
- Le circuit de Mapleson D est le plus efficace en ventilation contrôlée, car le DGF force le gaz alvéolaire à s'échapper par la valve, donc à s'éloigner du patient.
- Le circuit de Bain est un circuit de Mapleson D modifié dont le DGF est administré par un tuyau situé à l'intérieur du tube coaxial, donc entouré par le gaz expiré ; c'est le système inverse au circuit de Lack. L'avantage du circuit de Bain est de pouvoir conserver la chaleur et l'humidité par un système d'échange à contre-courant. Le gaz inspiré est réchauffé par la chaleur du gaz expiré. De plus, les gaz expirés peuvent être éliminés en évitant une pollution de la salle d'opération.
Mapleson E
- Le circuit de Mapleson E correspond au tube en T d'Ayre.
- Il est surtout utilisé en pédiatrie, car c'est le circuit qui offre le moins de résistance et le moins d'espace mort.
- Chez l'adulte, il faut utiliser un DGF élevé.
Mapleson F
- Ce circuit n'a pas été décrit par Mapleson ; il s'agit d'une modification du tube en T d'Ayre par Jackson-Rees.
- Ce système est souvent utilisé en pédiatrie, car il permet de manipuler d'une seule main le ballon de ventilation et la valve de surpression.
Remarque
- Pour les circuits de Mapleson B, C, D, E, F, il faut que le DGF soit égal à 2–3 fois la ventilation minute pour éviter la réinhalation, que ce soit en ventilation spontanée ou contrôlée. Ces différents systèmes ne sont pratiquement plus utilisés en clinique dans les pays occidentaux, hormis le circuit de Mapleson F utilisé dans certaines situations en pédiatrie.
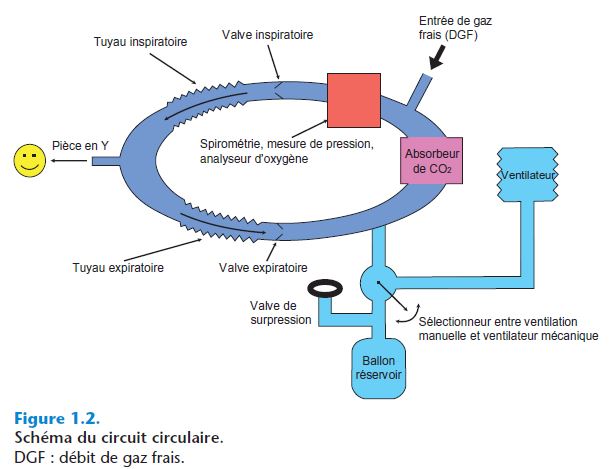
Circuit circulaire avec réinhalation
- Dans un circuit de type circulaire (circle system), les gaz circulent dans les tuyaux de manière unidirectionnelle grâce à des valves ; les branches inspiratoire et expiratoire sont donc distinctes, sauf au niveau de la pièce en Y, proche du patient (figure 1.2).
- Ce circuit contient les éléments initiaux du circuit de Mapleson (tuyau réservoir, valve de surpression, DGF, ballon de ventilation), auxquels ont été ajoutés un absorbeur de CO2 et des valves unidirectionnelles, inspiratoire et expiratoire.
- Le circuit est dit à « réinhalation », car le gaz vecteur fait plusieurs cycles appareil–patient ; cela impose une absorption du CO2 et un remplacement de l'O2 et des gaz anesthésiques consommés.
- L'espace mort est limité à la pièce en Y, qui est le compartiment distal proche du patient. Entre les valves inspiratoire et expiratoire, les tuyaux peuvent être très longs sans que cela n'augmente l'espace mort, contrairement aux circuits de Mapleson.
- L'absorbeur et les valves augmentent les résistances du système, raison pour laquelle certains anesthésistes ne l'utilisent pas en pédiatrie et préfèrent utiliser un Mapleson E.
- Ce circuit permet de travailler avec des DGF bas, soit entre 0,5–2 l/min.
- Les avantages sont :
- une diminution de la pollution en salle d'opération ;
- une conservation de la chaleur et de l'humidité ;
- une économie de gaz (oxygène, protoxyde d'azote) et d'anesthésiques halogénés.
- Ses inconvénients sont :
- d'être lourd et encombrant ;
- d'être complexe ;
- de présenter des risques importants de déconnexion et de fuites, ainsi que des dysfonctionnements ;
- d'augmenter les résistances.
Valve de PEP (pression expiratoire positive)
- La valve de PEP peut faire partie du système circulaire, mais elle est le plus souvent intégrée à l'appareil d'anesthésie lui-même.
- Sa fonction est de maintenir une pression supra-atmosphérique dans les voies aériennes en fin d'expiration pour permettre notamment une augmentation de la capacité résiduelle fonctionnelle (CRF) par recrutement des alvéoles partiellement fermées ; cela permet une diminution de la formation d'atélectasies.
- Par ailleurs, la PEP évite les forces de cisaillement provoquées par l'ouverture et la fermeture itératives des alvéoles dans le cycle respiratoire ; ces effets contribuent à améliorer les inégalités du rapport ventilation/perfusion et la compliance pulmonaire.
- La PEP permet une optimisation globale de l'oxygénation. Sa valeur peut être fixe ou variable : au début de l'intervention, l'anesthésiste choisit habituellement une PEP de 5 mmHg, considérée comme physiologique, mais il peut être amené à l'augmenter graduellement pour améliorer l'oxygénation.
Anesthésie à bas débit
- L'anesthésie à bas débit est née d'impératifs économiques et écologiques. Le débit de l'O2 et des halogénés est fortement réduit. Un autre avantage est le maintien de l'humidité et de la chaleur des gaz expirés et inspirés.
- Le cas extrême d'une anesthésie à bas débit consiste à utiliser un circuit fermé où le DGF est égal à la consommation du patient en O2, en N2O et en agent halogéné. Ainsi, tous les gaz sont réinhalés, sauf le CO2 qui est absorbé. Les avantages d'un tel circuit sont l'absence de pollution, la conservation de la chaleur et de l'humidité ainsi que la possibilité de détecter rapidement des fuites ou des changements métaboliques.
- Un régime à bas débit provoque une élévation proportionnelle du temps d'équilibration des concentrations en gaz inhalés et alvéolaires. Ainsi, l'induction, les adaptations peropératoires et le réveil sont ralentis. En revanche, si le débit est augmenté brusquement, les concentrations se modifient rapidement. Il faut donc élever ce débit chaque fois que l'on désire adapter rapidement la profondeur de l'anesthésie.
- Le bas débit associé à l'administration de protoxyde d'azote ne doit pas être utilisé pendant l'induction ou le réveil en raison du risque de dilution des gaz provenant de l'appareil par ceux du patient (mélange hypoxique, induction insuffisante si le protoxyde est dilué).
- Lors de la phase de préoxygénation, il est également important de maintenir un débit suffisant pour assurer une dénitrogénation de la CRF du patient ainsi que du circuit circulaire. Cette dénitrogénation initiale devrait être répétée au cours de l'anesthésie pour éviter l'accumulation d'azote dans le circuit.
- Le bas débit peut entraîner une accumulation de composés toxiques dans le mélange inspiré. Ces composés sont essentiellement des métabolites provenant des anesthésiques volatils.
Absorbeurs de CO2
- La réinhalation des gaz expirés nécessite l'élimination du CO2 par le biais d'absorbeurs de CO2. Ces derniers deviennent inutiles lorsque le DGF est supérieur à 5 l/min ; les autres gaz peuvent tous être réinhalés pour autant que la fraction consommée par le patient soit compensée.
- L'absorbeur le plus utilisé est la chaux sodée, contenue dans un bac composé d'une ou de deux chambres.
- L'absorption de CO2 dépend de plusieurs facteurs, qui sont :
- le type d'absorbeur : absorbeur à chaux sodée ou à chaux barytée ;
- la formation de canaux préférentiels : si des cheminées se forment, le CO2 sera absorbé préférentiellement le long de ces conduits et l'absorbeur sera rapidement saturé. Cela peut rester invisible si le conduit ainsi formé se trouve à distance des parois du bac ;
- la taille des granules : plus la taille des granules est petite, plus la surface d'échange augmente. En revanche, si cette taille est trop petite, les résistances sont augmentées. La taille optimale semble se situer autour de 2,5 mm ;
- le nombre de chambres dans le bac : dans le cas de deux chambres, le mélange de gaz traverse les chambres en série, la deuxième chambre permettant une absorption supplémentaire lorsque la première chambre est saturée ;
- la taille du bac : plus le bac est volumineux, plus le débit de gaz peut être lent, ce qui permet une meilleure absorption et diminue le risque de circulation de poussière ;
- le taux d'humidité : une quantité trop importante d'eau diminue la surface d'absorption disponible, alors qu'une quantité trop faible d'eau retarde la formation d'acide carbonique.
- Les absorbeurs contiennent également un colorant sensible au pH qui permet d'en reconnaître facilement le taux de saturation. Le bac doit être changé lorsque 50 à 70 % de la chaux est colorée. Les colorants utilisés sont le violet d'éthyle, qui passe du blanc au violet, ou le mimosa Z, qui passe du rose au blanc, lorsque les capacités d'absorption sont épuisées.
- La chaux est irritante pour la peau, les yeux et les voies aériennes et doit être manipulée avec précaution pour éviter la formation de poussière ; la fabrication de cartouches à usage unique limite les contacts.
- L'absorbeur peut absorber puis libérer les halogénés. Il peut donc être responsable d'inductions tardives ou de réveils prolongés. Ces effets augmentent lorsque la substance est sèche.
- Lorsque le DGF est connecté avant le bac à chaux sodée, il dessèche la chaux et produit du CO. Ce phénomène survient surtout avec la chaux barytée, ce qui a conduit à son retrait en Europe, puis aux États-Unis.
- Le trichloréthylène est incompatible avec la chaux sodée en raison de la production de phosgène, un toxique pulmonaire et cérébral.
- Le fonctionnement inadéquat de l'absorbeur de CO2 se manifestera entre autres par une élévation de la FICO2, qui doit normalement être proche de zéro.
Chaux sodée
- La chaux sodée est l'absorbeur le plus répandu et contient :
- de l'hydroxyde de sodium (4 %) : NaOH ;
- de l'hydroxyde de potassium (1 %) : KOH ;
- de l'hydroxyde de calcium (80 %) : Ca (OH)2 ;
- de l'eau de Kieselguhr (14–19 %) ;
- de la silice (0,4 %) ;
- un colorant indicateur.
- Les poussières des granules sont irritantes pour les muqueuses. La silice permet de durcir la substance et d'éviter une migration des poussières vers les voies aériennes supérieures.
- 100 g de chaux sodée peuvent absorber 18–23 l de CO2 dans un bac à deux chambres et 10–15 l dans un bac à une chambre.
- L'élimination du CO2 produit de l'eau, de la chaleur et du carbonate de calcium, selon la réaction suivante :
|
CO2+H2O→ H2CO3 Na2CO3+Ca(OH)2→ CaCO3+2NaOH (réaction lente) |
- Une partie des inconvénients provient de la réaction des anesthésiques halogénés avec l'hydroxyde de potassium ; celui-ci a été supprimé dans certaines chaux sodées (par exemple chaux de la marque Intersurgical®).
Chaux barytée
- La chaux barytée a été utilisée principalement aux États-Unis jusqu'en 2005 (actuellement arrêt de commercialisation) ; elle contient de :
- l'hydroxyde de baryum (20 %) : Ba (OH)2 ;
- l'hydroxyde de calcium (80 %) : Ca (OH)2.
- L'adjonction de silice n'est pas nécessaire, car les granules sont suffisamment durs pour ne pas produire de poussière. Il n'y a pas d'eau, car la réaction elle-même produit suffisamment d'eau.
- 100 g peuvent absorber 9–18 l de CO2 dans un bac à une chambre, un peu plus dans un bac à deux chambres.
Appareil d'anesthésie
Introduction
L'appareil d'anesthésie se compose d'un système de transport des gaz, comprenant quatre parties distinctes, et d'un système de monitorage permettant de mesurer différents paramètres, dont ceux du système de ventilation.
- Les parties qui constituent le système de transport des gaz sont :
- un système d'alimentation des gaz, allant de l'alimentation murale ou de la bouteille à haute pression jusqu'à la sortie des gaz frais (DGF) à basse pression. Ce système permet l'administration d'un mélange de gaz et d'agent anesthésique au patient ;
- un système de contrôle de la ventilation ou d'assistance à la ventilation (ventilateur) ;
- un système d'absorption du CO2 (absorbeur de CO2) ;
- un système d'évacuation des gaz.
Système d'alimentation des gaz
- L'appareil d'anesthésie peut fonctionner à partir de plusieurs sources de gaz à des pressions différentes. Différents régulateurs assurent une réduction progressive de la pression. On distingue plusieurs étages :
- étage à « haute pression » : cet étage, en amont de l'appareil d'anesthésie, va des sources de gaz principales jusqu'aux détendeurs placés sur le réseau à l'entrée du bloc opératoire ; les pressions sont entre 7 et 9 bars ;
- étage à « pression intermédiaire » : cet étage se situe entre les détendeurs et les débimètres. La pression de l'oxygène y est légèrement supérieure à celle de l'air, qui est elle-même légèrement supérieure à celle du N2O ; les pressions sont de 3,7 ± 0,5 bars environ. Les salles d'opération sont équipées d'alarmes visuelles et sonores qui indiquent une chute de la pression d'alimentation en oxygène ; l'O2 rapide fait partie de cet étage. La valve de débit rapide (by-pass) d'O2 court-circuite les systèmes de détendeurs situés en aval, les débitmètres et les vaporisateurs ;
- étage à « basse pression » : cet étage va des débimètres à la sortie du mélange de gaz frais ; les pressions y sont de 1 bar.
Rotamètres
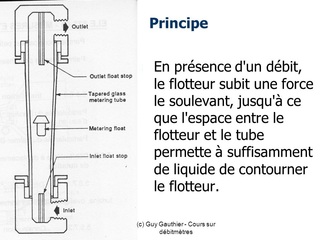
- Les rotamètres, ou débitmètres, ou tubes de Thorpe, mesurent le débit de gaz qui les traversent.
- Ils se composent d'un flotteur ou bobine, situé à l'intérieur d'un tube vertical dont les parois s'élargissent de bas en haut à la manière d'un cône très allongé.
- Les flotteurs ont des formes très variables, allant de la sphère à la toupie. Certains comportent des rainures qui permettent au flotteur de tourner sur lui-même. La lecture se fait de manière générale au niveau du diamètre le plus large, soit au centre de la sphère ou au sommet du flotteur.
Principe de fonctionnement
- Le gaz circule dans le rotamètre entre le tube et le flotteur. Celui-ci s'élève d'autant plus que le débit est élevé, puisque l'espace disponible augmente le long du tube (orifice variable).
- Le flotteur s'immobilise lorsqu'il atteint un équilibre entre son poids et ladifférence de pression qui existe entre le haut et le bas du flotteur
- Le débit de gaz dépend :
- du poids du flotteur ;
- de la taille de l'orifice ;
- des propriétés physiques du gaz.
- De ces trois éléments, seules les propriétés physiques du gaz sont variables. Tout changement de densité et de viscosité, dépendant de la pression et de la température, modifie la précision des rotamètres. Ces derniers sont donc calibrés pour une température de 20 °C, une pression atmosphérique de 760 mmHg, et un gaz donné.
- Par ailleurs, la qualité du flux est importante :
- dans un tube long et étroit avec un débit faible, le flux est plutôt laminaire et dépend de la viscosité (loi de Hagen-Poiseuille) ;
- dans un tube court et large avec un débit élevé, le flux sera turbulent et la densité sera prépondérante.
- En altitude, l'air étant moins dense, le débit sera plus important autour de la bobine pour une valeur affichée ; le rotamètre sous-estimera le DGF. Dans une chambre hyperbare, le gaz est plus dense et le débitmètre délivre moins de gaz que ce qu'il indique ; ainsi, le rotamètre surestime le DGF. Ces notions sont valables lorsque le flux est turbulent. Lorsque le flux est
- laminaire (débit faible, tube étroit), il est proportionnel à la viscosité du gaz et non à sa densité. L'altitude et la chambre hyperbare ne modifieront donc pas la lecture du débitmètre.
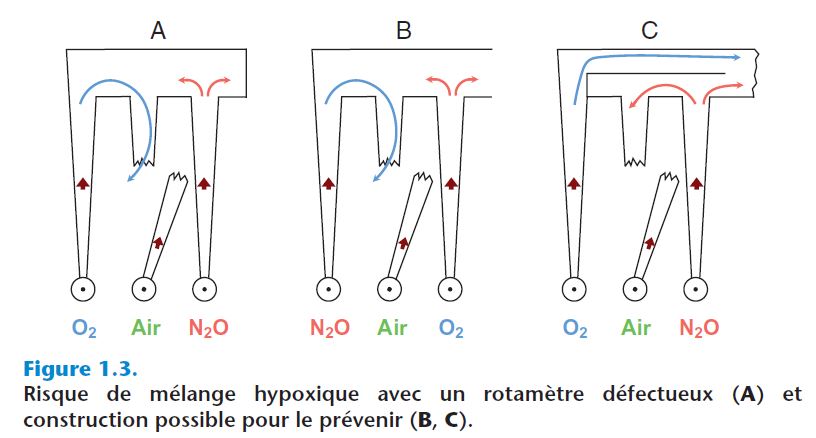
- Dans l'appareil d'anesthésie, les rotamètres sont disposés côte à côte, montés en série ou le plus souvent en parallèle (rampe), le tube collecteur du mélange gazeux étant situé sur la partie supérieure de la rampe (figure 1.3). L'ordre de placement des tubes a une grande importance dans la mesure où une fuite sur l'un des tubes pourrait provoquer un mélange hypoxique. En effet, si le tube d'O2 est placé en amont d'une fuite sur un autre tube, l'O2 peut être amené à fuir également. La position la plus sûre consiste à placer le débitmètre d'O2 en dernière position sur la rampe des rotamètres.
Limitations
- Les rotamètres sont des appareils simples, mais fragiles et sensibles. Leur principe de fonctionnement les rend imprécis en présence :
- de poussière ;
- d'humidité ;
- d'électricité statique ;
- de champ magnétique ;
- de perte de verticalité ;
- de choc mécanique.
- Un rotamètre défectueux présente un danger parce qu'il affiche des valeurs erronées. Le risque d'administration d'un mélange hypoxique doit être limité au maximum.
- Les appareils modernes sont souvent équipés de débitmètres électroniques, fondés sur le principe de Faraday : lorsqu'un conducteur se déplace perpendiculairement à un champ magnétique, il induit une tension électrique proportionnelle à sa vitesse de translation. Le tube de mesure se compose de deux électrodes placées perpendiculairement à deux bobines qui créent le champ magnétique.
Prévention de l'administration d'un mélange hypoxique
- Différents systèmes limitent le risque d'administration de mélange hypoxique : certains appareils délivrent une quantité minimale d'O2, d'autres associent les concentrations ou les pressions minimales à des alarmes (mécaniques ou électroniques) :
- débit minimal d'O2 : en l'absence d'un débit d'air, un flux minimal d'O2 est administré ;
- concentration minimale en O2 : les débitmètres sont reliés entre eux soit pneumatiquement, soit mécaniquement de manière à empêcher que la proportion d'O2 dans le mélange ne soit inférieure aux valeurs seuils établies par le constructeur (par exemple : 25 %) ;
- alarme de concentration : en fonction des pressions dans les différents conduits de gaz, des alarmes mécaniques (sifflet) ou électroniques se déclenchent lorsqu'un déséquilibre existe dans le mélange pouvant produire un composé hypoxique.
Ventilateur
- Le ventilateur est un des composants de l'appareil d'anesthésie ; il permet d'administrer au patient de manière automatique un mélange de gaz vecteur et d'agent anesthésique, et de contrôler la ventilation.
- Tous les ventilateurs modernes génèrent une pression positive dans les VAS.
- Au cours d'un cycle respiratoire, le ventilateur génère un flux et maintient une pression constante ou un débit constant dans les VAS, indépendamment de la mécanique pulmonaire.
- Les avantages sont une économie en ressources humaines et l'augmentation de la fiabilité, notamment dans la répétitivité des cycles par rapport à des cycles manuels.
- Le ventilateur est composé des éléments suivants :
- un moteur ;
- une alimentation en gaz ;
- un système de commandes ;
- un soufflet, ou son équivalent (pompe pour le ventilateur Zeus) ;
- des valves directionnelles des flux et de sécurité.
Moteur et alimentation en gaz
- Le ventilateur est alimenté par de l'O2 ou de l'air séparé en deux circuits :
- un circuit patient pour le fonctionnement du circuit anesthésique ;
- un circuit moteur pour le fonctionnement pneumatique du ventilateur.
- Les ventilateurs électriques requièrent également un gaz moteur :
- l'oxygène est le gaz moteur ; la quantité d'O2 utilisée par le ventilateur est au moins égale à la ventilation minute du patient ;
- certains ventilateurs utilisent un système à injection d'air de Venturi, cequi augmente le débit de gaz moteur et diminue la consommation d'O2.
Soufflet
- Le soufflet est une sorte de ballon plissé en accordéon, fixé au ventilateur.
- La plupart des ventilateurs comportent un soufflet isolé dans une chambre (bag in a bottle).
- Les gaz prennent des circuits séparés : le gaz moteur dans la chambre du soufflet, le gaz de ventilation dans le soufflet connecté au circuit de ventilation du patient.
- Le soufflet est rempli au début du cycle inspiratoire ; la pression du gaz moteur dans la chambre, à l'extérieur du soufflet, provoque sa compression. Le mélange de gaz est poussé vers le patient. Après le cycle inspiratoire,le gaz expiré par le patient ainsi que l'entrée de gaz frais réalimentent le soufflet qui reprend son volume initial. L'excès de gaz est éliminé par la valve d'échappement du circuit. Le retour à la position de fin d'expiration marque le début d'un nouveau cycle.
- Pour certains ventilateurs, le piston du soufflet est actionné par de l'énergie électrique (Dräger Cato et Zeus).
- Les soufflets peuvent être ascendants ou descendants (terme défini par rapport à l'exsufflation). Le soufflet ascendant permet une détection plus rapide des fuites. En effet, un soufflet descendant peut descendre par gravité, mimant faussement un remplissage normal. La plupart des appareils actuels sont équipés d'un soufflet ascendant. Par ailleurs, le monitorage systématique des débits et des pressions facilite la détection rapide des fuites.
Valve de surpression
- Le ventilateur comprend un système de sécurité permettant d'éviter des surpressions dans le circuit de ventilation à l'origine de barotraumatismes ; le seuil de surpression peut être réglé à l'aide d'une valve d'échappement (valve APL [adjustable pressure limiting]).
- La valve de surpression est généralement placée entre l'absorbeur de CO2 et la valve expiratoire, proche du ballon de ventilation.
- Les surpressions peuvent résulter :
- d'erreurs de réglages ;
- de l'activation de la valve d'O2 rapide, surtout pendant la phase inspiratoire où la valve d'échappement est fermée ;
- d'un oubli de la valve en position fermée à la fin d'une phase de ventilation manuelle.
- Lorsque le seuil de détection est atteint, une alarme sonore est activée en même temps que la valve bloque automatiquement, de manière mécanique ou électronique, l'élévation de pression : le cycle s'achève à pression réduite, ou est simplement stoppé.
Remarques
- Même avec des appareils fiables, les pannes sont toujours possibles, parfois de manière insidieuse ou intermittente, ce qui les rend d'autant plus difficiles à détecter. La surveillance clinique et le monitorage permettent le plus souvent de prendre conscience du défaut de fonctionnement à temps.
- Les fuites de gaz sont toujours possibles et d'autant plus difficiles à détecter que les systèmes sont fermés :
- dans le ventilateur, les fuites les plus fréquentes sont secondaires à un manque d'étanchéité de la chambre du soufflet ou se situent au niveau du soufflet lui-même ;
- dans le circuit, les fuites apparaissent le plus souvent au niveau des connexions et des joints, ainsi qu'au niveau du bac de chaux sodée. Les éléments en plastique peuvent également se fissurer, notamment à l'occasion de stérilisations répétées ou sous l'action détergente de désinfection de surface ou de médicament (isoflurane). Les capteurs de spirométrie et d'analyse des gaz constituent aussi des sources de fuite.
- Le réglage des alarmes fait partie intégrante de la préparation d'un appareil d'anesthésie comme d'un ventilateur. Les alarmes d'alimentation en gaz et de pression du système sont le plus souvent des alarmes pneumatiques, ce qui signifie qu'elles fonctionnent même après un arrêt de l'alimentation électrique.
- La gestion del'appareil est le plus souvent faite par des composants informatiques ou électroniques qui améliorent la sécurité, mais dont la défaillance est aussi possible. Au moindre doute quant à une défaillance de l'appareil d'anesthésie, il faut reprendre la ventilation manuelle avec un insufflateur manuel.
Humidificateur
- Chez un sujet normal, les voies aériennes supérieures permettent de réchauffer l'air inhalé à la température corporelle et de le saturer en eau.
- Un patient qui a une sonde d’intubation trachéale ne bénéficie donc pas de ce processus ; ses voies aériennes inférieures sont alors exposées à un air sec à température ambiante.
- Le réchauffement et l'humidification de cet air par les voies aériennes inférieures conduisent à une perte de chaleur, à une déshydratation des muqueuses, à une altération de la fonction mucociliaire, voire à des atélectasies et à des troubles de la ventilation/perfusion, particulièrement chez des patients avec des pathologies pulmonaires sous-jacentes.
- Le réchauffement et l'humidification des gaz inspirés sont particulièrement importants chez les enfants, les patients âgés et ceux qui souffrent d'une atteinte pulmonaire telle que la mucoviscidose.
- Il existe deux types d'humidificateurs : les humidificateurs passifs, appelés aussi échangeurs de chaleur et d'humidité ou encore filtres, et les humidificateurs actifs.
- Les humidificateurs passifs sont des dispositifs qui se placent sur la pièce en Y. Ils fonctionnent comme des échangeurs thermiques et d'humidité grâce à un matériel hygroscopique qui piège la chaleur et la vapeur d'eau de chaque exsufflation, qui seront ensuite transférées au DGF lors de l'insufflation suivante ; ils sont aussi des filtres d'agents infectieux. Les inconvénients sont une augmentation de l'espace mort, des résistances respiratoires, du travail respiratoire en ventilation spontanée et une obstruction du filtre par des sécrétions. Certains de ces dispositifs contiennent également un filtre antimicrobien.
- Les humidificateurs actifs sont plus efficaces que les précédents. L'air inhalé est saturé d'eau grâce à différents systèmes comme le passage de l'air dans une chambre à eau ou le mélange de l'air avec de la vapeur. Les inconvénients sont des lésions thermiques pulmonaires, des infections nosocomiales, et une augmentation du risque de déconnexion du système respiratoire. Ces dispositifs ne contiennent pas de filtre antimicrobien. Ils sont utilisés en milieu de réanimation.
Vaporisateurs
- À température ambiante et à pression atmosphérique (Patm), la plupart des anesthésiques volatils sont en phase liquide. Les vaporisateurs convertissent les anesthésiques par inhalation de l'état liquide en vapeur.
- Le vaporisateur est un récipient contenant un agent anesthésique en phase liquide, à travers lequel un flux de gaz vecteur capte une quantité choisie de l'agent pour l'amener aux voies aériennes du patient. Le gaz est entraîné par la différence de pression entre l'extérieur et une chambre interne de vaporisation, appelée plenum (plenum vaporizer). C'est le système le plus répandu. Sur certains appareils modernes (Zeus), un système injecte des bolus de liquide directement dans le circuit.
- Les différents types de vaporisateur sont :
- le vaporisateur à léchage (flow-over) : le gaz vecteur est amené à la surface de l'agent anesthésique et se charge en vapeur ;
- le vaporisateur à bullage : le gaz vecteur traverse l'agent anesthésique liquide par barbotage et se charge ainsi en vapeur ;
- le vaporisateur à injection : l'injection directe d'une certaine quantité de liquide anesthésique dans le circuit permet d'obtenir une concentration précise ; le problème de la température est ainsi contourné ; cette technique qui caractérise certains vaporisateurs modernes permet d'injecter des bolus d'agent inhalé et de modifier plus rapidement la concentration-cible que par augmentation du DGF. Par ailleurs, la consommationd'halogéné est réduite.
- La saturation complète d'une partie du gaz vecteur est assurée, par exemple, par la pose de mèches, qui augmentent la surface de contact, sur lesquelles l'halogéné monte par capillarité en raison des forces de tension superficielle.
- Le vaporisateur se place juste après les débitmètres et juste avant la valve d'O2 rapide. Cela explique que l'utilisation de l'O2 rapide allège la profondeur de l'anesthésie.
- Les vaporisateurs sont calibrés pour :
- une température donnée ;
- une Patm donnée ;
- un halogéné donné : en raison des différences physicochimiques des agents anesthésiques, les vaporisateurs sont spécifiques à l'agent concerné et une erreur de remplissage peut provoquer des erreurs de dosage importantes ; ce problème est actuellement théorique puisque les évaporateurs sont munis de détrompeurs ;un gaz transporteur : c'est généralement de l'O2 à 100 %. L'utilisation du N2O à 100 % diminue de 10 % la concentration d'halogéné en raison de la différence de viscosité entre les deux gaz, qui modifie le flux dans le vaporisateur.
- La pression de vapeur saturante est la pression exercée par la vapeur d'une substance en équilibre avec la forme liquide de cette substance dans un récipient fermé. Elle caractérise la facilité de vaporisation. La pression de vapeur saturante est proportionnelle à la température et n'est pas modifiée par la pression atmosphérique.
- La pression de vapeur saturante des halogénés est largement supérieure à la pression requise pour une anesthésie. Il faut donc diluer l'halogéné. Ainsi, seule une partie du gaz vecteur est dirigée vers la chambre de vaporisation en fonction de la concentration désirée. Il ressort de cette chambre complètement saturé en halogéné, puis il rejoint le DGF dans lequel il est dilué. Ce sont les vaporisateurs à bypass variable :
- exemple : la pression de vapeur saturante de l'halothane à 20 °C est de 243 mmHg. À cette même température et à une Patm de 760 mmHg, sa concentration est de 32 % (243/760). Si 100 ml de mélange de gaz entrent dans le vaporisateur, 150 ml vont en sortir (100 ml d'O2 et 50 ml [32 % × 150 ml] d'halothane). Or, moins de 1 % soit 7 mmHg d'halothane suffisent pour obtenir un effet anesthésique à la Patm. Il faut donc diluer les 50 ml d'halothane dans 5 000 ml de gaz frais.
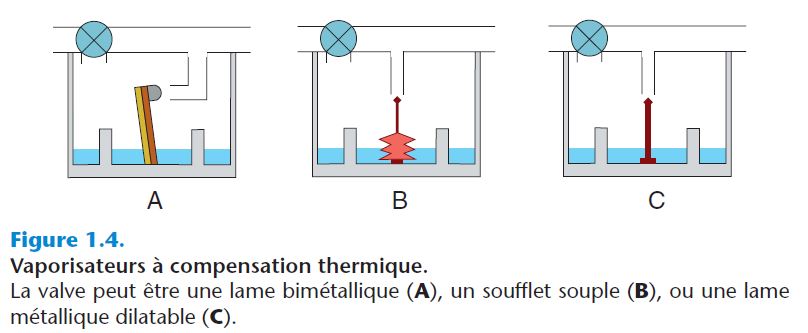
- La chaleur de vaporisation est l'énergie nécessaire pour vaporiser un liquide. Lors de ce processus, la température du liquide diminue et sa pression de vapeur saturante également. Ce problème est résolu par la fabrication de vaporisateurs en métaux divers (par exemple le cuivre) dont la chaleur spécifique(soit la quantité de chaleur nécessaire pour élever 1 g de leur substancede 1 °C) et la conductance thermique sont élevées, ce qui permet de maintenir une température constante sans chauffage du système. D'autres vaporisateurs, à compensation thermique, sont munis d'une valve qui obstrue de manière plus ou moins importante l'orifice de sortie du gaz vecteur, selon la température du liquide. Ces valves ont des formes variables : lame bimétallique, soufflet souple ou lame métallique dilatable (figure 1.4).
Cas particulier : le desflurane
- Le desflurane présente la caractéristique unique d'une pression de vapeur particulièrement élevée : 681 mmHg à 20 °C et 731 mmHg à 22 °C avec un point d'ébullition à 22,8 °C, tout en étant peu puissant (CAM 6,0 vol %).
- Il est donc impossible de prédire la quantité de desflurane délivrée avec les vaporisateurs conventionnels.
- En raison du risque d'ébullition spontanée, des vaporisateurs ont été développés spécifiquement pour le desflurane (Tec 6) : l'halogéné est chauffé électriquement à 39 °C et pressurisé à 2 ATA (atmosphère technique absolue ; 2 ATA = 1500 mmHg).
- Le Tec 6 comporte deux circuits de gaz indépendants : un circuit pour le DGF et un circuit pour les vapeurs de desflurane, alimenté par la cuve chauffée à 39 °C. Le bouton de contrôle manuel de la concentration de desflurane (en vol %) régule l'apport de vapeur au débit de gaz qui quitte le vaporisateur, ce qui permet de délivrer la concentration désirée.
Date de dernière mise à jour : 05/03/2020
Commentaires
-

1 Mahboub Le 25/09/2023
Merci pour vos efforts pour rapprocher les cours d'anesthésie et de réanimation
Svp j'ai pas trouver le cour d'anesthesie reanimation en neurochirurgie
Ajouter un commentaire