- Accueil
- Modules 1ére année
- 2. PHARMACOLOGIE (Vh : 100 h , Coef : 3)
- 7) Les Antalgiques
7) Les Antalgiques
Marcel Chauvin : Professeur des Universités, praticien hospitalier .Service d'anesthésie-réanimation chirurgicale, hôpital Ambroise-Paré, 9, avenue Charles-de-Gaulle, 92100 Boulogne Billancourt cede
HISTOIRE DES OPIOÏDES
- Environ 5000 ans avant J.-C. les Sumériens cultivaient le pavot pour en extraire l’opium à des fins religieuses et médicinales
- En 1817, Sertürnerextrait le principe actif de l’opium qu’il nomme morphine, de Morphée, dieu du sommeil
- Codéine isolée de l’opium quelques années après
- Vers 1850 morphine utilisée durant guerre de la France et la Prusse et aussi pendant la guerre civile américaine
- En 1901, Katawatainjecte de la morphine en intrathécal
- Dérivés synthétiques produits
- Récepteurs morphiniques découverts dans les années 70
- Ligands endogènes
- Clonage des récepteurs morphiniques
DÉFINITIONS
- OPIUM: extrait de la plante (pavot) Papaver somniferum
- OPIACÉS: terme plus ancien,s’applique aux substances morphiniques synthétiques qui ont une structure non peptidique
- OPIOÏDES:toute substance, endogène ou synthétique, qui produit des effets similaires à la morphine et qui sont bloqués par un antagoniste (naloxone)
Classification des opioïdes
- Naturels
- morphine
- codéine
- thébaïne
- papavérine
- Semi-synthétiques
- héroïne
- buprénorphine
- Synthétiques
- fentanyl
- méthadone
RÉCEPTEURS OPIOÏDES
4 types de récepteurs opioïdes :
- mu :μ
- Delta : δ
- Kappa : κ
- ORL1
Peptides endogènes : β-endorphines, endomorphines, enképhalines, dynorphineset nociceptinethadone
|
Interactions des opioïdes endogènes avec leurs récepteurs |
μ | δ | κ | ORL1 |
| β-endorphines | +++ | +++ | +++ | - |
| Leu-enképhaline | + | +++ | - | - |
| Met-enképhaline | ++ | +++ | - | - |
| Dynorphine | ++ | + | +++ | - |
| OrphanineFQ / nociceptine | - | - | - | +++ |
PEPTIDES OPIOÏDES ENDOGÈNES
|
Interaction des opioïdes avec les récepteurs |
μ | δ | κ |
|
Morphine, codéine, oxymorphone, dextropropoxyphène |
+++ | + | + |
| Méthadone | +++ | - | - |
| Mépéridine | ++ | + | + |
| Fentanyl, sufentanil | +++ | + | - |
| Buprénorphine | (+++) | - | ++ |
| Pentazocine | + | + | ++ |
| Nalbuphine | + | + | (++) |
| Nalorphine | ++ | - | (++) |
| Naloxone | +++ | + | ++ |
+agoniste; +antagoniste; ( ) agoniste partiel
AGONISTES ET ANTAGONISTES OPIOÏDES
- Agonistes purs
- morphine, fentanyl, mépéridine
- agonistes faibles = codéine, méthadone, dextropropoxyphène
- Agonistes partiels et agoniste-antagonistes mixtes
- nalorphine, pentazocine, buprénorphine, nalbuphine
- Antagonistes
- naloxone, naltrexone
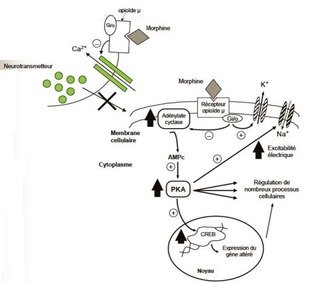
MÉCANISMES D’ACTION CELLULAIRES DES OPIOÏDES
- Récepteurs appartiennent à la famille des protéines G(Gi/o)
- inhibent l’adénylate cyclase et donc le contenu intracellulaire en AMPc
- permettent l’ouverture de canaux potassiques
- inhibent l’ouverture de canaux calciques
- Réduction de l’excitabilité neuronale et de la libération de neurotransmetteurs
- Effets inhibiteurs au niveau cellulaire
- Les morphiniques exercent leur action en se fixant de façon réversible sur des récepteurs spécifiques, saturables: μ mu, ∆ delta, kappa, σ sigma
- L’effet pharmacologique obtenu dépend en partie du type de récepteur occupé.
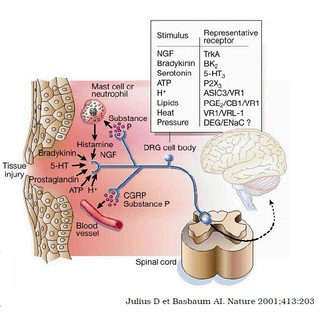
- Ces récepteurs sont localisés principalement dans le système nerveux central, en particulier au niveau de la corne dorsale de la moelle.
Morphiniques agonistes
- Les morphiniques agonistes ont les mêmes propriétés pharmacologiques dépendantes de la dose et concernent notamment :
- l'analgésie,
- la dépression respiratoire
- et les effets digestifs.
- Ils diffèrent entre eux principalement par :
- la puissance d'action
- et les durées et délais d'action.
- Ces derniers éléments sont déterminés par :
- les propriétés au niveau des récepteurs morphiniques
- et la diffusion tissulaire.
Relation propriétés physicochimiques et diffusion dans le système nerveux central
- Les chronologies d'action des morphiniques dépendent de leurs diffusions respectives dans le système nerveux central (SNC).
- La fraction diffusible est la fraction libre (non fixée aux protéines plasmatiques) et non ionisée.
- Elle dépend du degré de fixation aux protéines plasmatiques et du pKa .
- Les morphiniques sont tous des bases faibles.
Exemple:
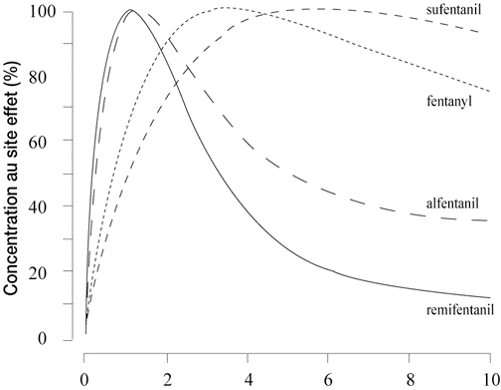
- Le pKa de l'alfentanil étant le plus bas, sa fraction diffusible est importante malgré une fixation protéique élevée.
- Le pKa du sufentanil est légèrement inférieur à celui du fentanyl, mais étant donné que sa fixation protéique est plus forte, sa fraction diffusible est égale à celle du fentanyl.
- Les fractions diffusibles du fentanyl et du sufentanil varient significativement avec le pH plasmatique, compte tenu de leurs valeurs de pKa.
La diffusion de la base non liée aux protéines (fraction diffusible) dépend de deux facteurs :
- la liposolubilité
- le volume du compartiment central.
- La diffusion des morphiniques de part et d'autre de la barrière hémato encéphalique est passive, elle répond au gradient de concentration transmembranaire et s'effectue d'autant plus rapidement que la molécule est plus liposoluble.
- Ainsi, quand l'agent est très liposoluble, la diffusion transmembranaire est importante et l'équilibre de concentration est rapidement atteint entre le plasma et le SNC.
- En revanche, quand le morphinique est peu liposoluble, l'équilibre ne peut pas être atteint.
Les morphiniques diffèrent par leur liposolubilité.
La morphine est la moins liposoluble, les autres morphiniques sont beaucoup plus liposolubles.
Exemple:
- Le fentanyl et le sufentanil sont les plus liposolubles. La base est légèrement plus liposoluble pour le fentanyl que pour le sufentanil.
Le volume du compartiment central (V1) est également déterminant de la quantité de molécules diffusant dans le SNC puisque cette diffusion est dépendante de la concentration.
Plus V1 est réduit et plus la concentration initiale du médicament dans ce compartiment est élevée.
Exemple:
- L'alfentanil a un V1 particulièrement petit, comparé au fentanyl et au sufentanil, si bien que les concentrations initiales équivalentes à une même dose injectée sont 7 fois plus importantes pour l'alfentanil que pour le fentanyl et le sufentanil
- Demi-vie d'élimination, volume de distribution et clairance plasmatique
Comme pour tous les médicaments, la demi-vie d'élimination est proportionnelle au volume de distribution (Vd) et inversement proportionnelle à la clairance totale (Cl).
Le volume de distribution des morphiniques est principalement constitué par le territoire musculaire du fait de sa vascularisation .
Ces distributions et redistributions du morphinique dans les muscles dépendent également de leur liposolubilité (plus le morphinique est liposoluble et plus grand est le Vd).
Exemple:
- Le (Vdss) de l'alfentanil est 6 fois plus faible que celui du fentanyl et du sufentanil.
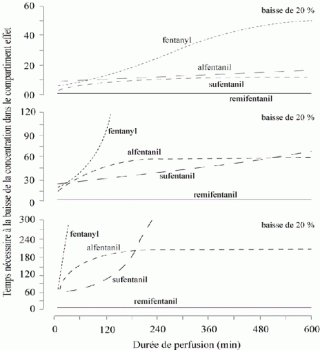
- Le grand volume de distribution du fentanyl est responsable de sa longue demi-vie d'élimination bien que sa clairance plasmatique soit élevée.
- En effet le facteur limitant de l'élimination du fentanyl de l'organisme n'est pas le métabolisme hépatique, mais le volume de distribution, les constantes de transfert depuis les territoires V2 et V3 étant inférieures à la constante d'élimination.
- Ainsi, la première conséquence du grand volume de distribution du fentanyl est l'accumulation dans l'organisme, elle s'observe en cas de doses fortes, uniques ou cumulées à la suite de réadministration ou de perfusion continue, si bien qu'à dose faible, le fentanyl a une courte durée d'action mais à dose forte, il devient un morphinique de très longue durée d'action.
- La deuxième conséquence du grand Vdss est la recirculation du fentanyl depuis le territoire musculaire à l'occasion du réchauffement de la phase de réveil par la réversibilité de la vasoconstriction peropératoire de ce territoire.
- Ces recirculations créent des pics secondaires le long de la phase d'élimination et peuvent ainsi participer aux dépressions respiratoires secondaires rapportées avec le fentanyl au cours de la période de réveil.
Par opposition, l'alfentanil a un volume de distribution beaucoup plus petit. Les conséquences sont les suivantes :
- demi-vie d'élimination courte bien que la clairance soit plus faible que celle du fentanyl ;
- absence de recirculation ;
- accumulation dans les muscles beaucoup plus faible que le fentanyl ;
par contre, la distribution de l'alfentanil est rapidement terminée et la pharmacocinétique de ce type de médicament est beaucoup plus susceptible d'être modifiée par des retards d'élimination hépatique que le fentanyl.
| Analgésie | μ | δ | κ |
| supraspinale | +++ | - | - |
| spinale | ++ | ++ | + |
| périphérique | ++ | - | ++ |
| Dépression respiratoire | +++ | ++ | - |
| Constriction pupillaire | ++ | - | + |
| Motilité GI réduite | ++ | ++ | + |
| Euphorie | +++ | - | - |
| Dysphorie | - | - | +++ |
| Sédation | ++ | - | ++ |
| Dépendance physique | +++ | - | + |
EFFETS DES OPIOÏDES
Propriétés pharmacodynamiques
Actions sur le système nerveux central
- Les morphiniques peuvent soit inhiber, soit stimuler le SNC.
- La dépression du SNC :
- l'analgésie,
- la dépression respiratoire,
- la somnolence
- certaines modifications électroencéphalographiques.
- Les actions excitatrices :
- myosis,
- les nausées et vomissements
- possibilité d'activation du système limbique (amygdale et hippocampe)
Analgésie
L'analgésie est
- intense,
- constante,
- dépendante de la dose
- se manifeste à l'égard de tous les types de douleurs.
L'action antinociceptive se caractérise expérimentalement par une augmentation des seuils nociceptifs quel que soit le test utilisé :
- thermique,
- chimique,
- électrique,
- à la pression.
Ce qui différencie principalement les analgésiques de cette même classe est la puissance d'action ou autrement dit la dose équiactive.
Les délais d'apparition et les durées de l'analgésie diffèrent également avec le morphinique
Actions psychomotrices
- Les morphiniques peuvent être à l'origine de deux comportements opposés :
- soit un état de sédation, fréquent quand le morphinique est administré chez les patients douloureux ;
- soit un état d'agitation psychomotrice plus particulier à certains terrains : vieillards, enfants jeunes, sujets cachectiques
Actions psychoaffectives
Les réactions psychoaffectives peuvent être également de deux natures différentes :
- le plus souvent, (les sujets algiques++):
- euphorie,
- impression de bien-être associées à une dépression de l'émotivité et de l'agressivité ;
- plus rarement,
- dysphorie
- impression générale de malaise,
- angoisse
- hallucinations
Actions hypnotiques
Les morphiniques altèrent le niveau de vigilance par une dépression sélective du SNC, exercée probablement sur le système limbique
Actions respiratoires
Dépression respiratoire
- Les morphinomimétiques provoquent une réduction dose-dépendante de la réponse des centres respiratoires bulbaires aux stimuli hypoxémiques et hypercapniques.
- La perte de sensibilité de ces centres au CO2 apparaît dès les plus faibles doses analgésiques .
- Les morphiniques dépriment aussi les centres bulbaires impliqués dans la régulation de la fréquence respiratoire, qui se traduit par :
- une bradypnée,
- une prolongation de l'expiration
- et une respiration périodique de type Cheynes-Stokes.
- Au-delà d'une certaine dose une apnée apparaît.
- A la bradypnée s'associe une augmentation compensatrice du volume courant, insuffisante pour éviter une hypercapnie.
- Après administration rachidienne chute du volume courant à la suite d'une probable dépression spécifique des neurones de la motricité intercostale .
- La traduction clinique de la détresse respiratoire est, dans ces cas, une polypnée superficielle.
- Cette action dépressive respiratoire évolue parallèlement à l'analgésie morphinique et elle est indissociable d'elle.
- Elle est constamment associée à une baisse importante du degré de vigilance.
- Certains facteurs peuvent influencer l'intensité et la durée de la dépression respiratoire des morphinomimétiques :
- l'âge : les personnes âgées sont plus sensibles aux effets dépressifs respiratoires et sédatifs que les sujets plus jeunes ;
- la douleur : la douleur antagonise la dépression respiratoire des morphiniques
Rigidité thoracique
À quel moment?
- précède quelquefois la perte de conscience .
- durant la phase de réveil .
Conséquences?
- diminution importante de la compliance thoracique rendant impossible l'insufflation pulmonaire.
Incidences?
- fonction de la rapidité et de la puissance d'action du morphinique,
- et pour un même morphinique avec la dose et la vitesse d'injection.
Prévention OU antagonistaion?
- injection d'un curare qui doit toujours être inclus dans le protocole anesthésique des doses fortes de morphiniques.
Bronchoconstriction
- Elle est en rapport avec:
- une action directe exercée sur le muscle lisse bronchique,
- associée pour certains morphiniques à l'histaminolibération.
- Ainsi, la morphine et la péthidine créent plus souvent des épisodes de dyspnée asthmatiforme que le fentanyl.
- En fait, ce qui est habituellement attribué à un bronchospasme sous fentanyl n'est autre qu'une rigidité thoracique.
Dépression de la toux
- les morphiniques dépriment également les centres de la toux.
- Cette action apparaît dès les plus faibles doses.
- Pas de relation entre la dépression de la respiration et la diminution de la toux .
- Elle permet la bonne tolérance des sondes trachéales mais expose, chez les patients en ventilation spontanée, aux risques d'encombrement bronchique
Actions cardiovasculaires
- Les morphiniques, par comparaison avec les anesthésiques généraux, ont peu d'actions cardiovasculaires
Actions sur la fréquence cardiaque
- Les morphiniques créent habituellement une bradycardie sinusale dont le mécanisme est une stimulation du noyau du X au niveau du plancher du 4e ventricule.
- L'atropine supprime la bradycardie des morphiniques
Actions sur les vaisseaux
- Les morphiniques histaminolibérateurs créent une vasodilatation artériolaire et veineuse, dépendante de la dose.
- Dans ce cas, le blocage des récepteurs H1 et des récepteurs H2 antagonise cet effet hypotenseur.
- Les autres morphiniques ne modifient ni la précharge, ni la postcharge quand le système sympathique n'est pas hyperstimulé.
- En revanche dans le cas inverse, comme au cours d'une hypovolémie, la dose la plus faible d'un morphinique majore l'hypotension artérielle par diminution centrale de cette hyperéactivité sympathique.
Actions sur la contractilité myocardique
- A l'exception de la péthidine, les morphinomimétiques ne sont pas responsables en clinique d'une dépression de la contraction myocardique même après de fortes doses
Actions sur le tube digestif
- Les nausées et les vomissements sont des effets indésirables fréquemment observés au cours d'un traitement morphinique puisqu'ils surviennent avec une fréquence de 20 à 60 %, aussi bien durant la période postopératoire qu'à l'initiation d'un traitement pour douleur chronique.
- Cette incidence est identique avec toutes les voies d'administration.
- Néanmoins, les morphiniques varient dans leur capacité à produire des nausées et des vomissements chez un individu donné.
- Ainsi, il est logique de changer de morphinique à dose équianalgésique quand un patient développe des nausées/vomissements.
- Les mécanismes des nausées et des vomissements produits par les morphiniques sont centraux et périphériques.
- L'action centrale principale est la stimulation de la zone chémoréceptrice au niveau de l'area postrema.
- Toute stimulation supplémentaire de cette zone, - telles les afférences vestibulaires mises en jeu au cours de la déambulation -, majore l'incidence des vomissements des morphiniques ce qui explique que les nausées et vomissements soient très marqués durant la période postopératoire d'anesthésie ambulatoire.
- Mécanisme demeure encore inconnu.
- Atonie des fibres longitudinales gastriques et l'hypertonie du pylore → retard à la vidange gastrique par :
- Présence d'un grand nombre de récepteurs morphiniques au niveau gastro-intestinal (l'antre gastrique+++)
- Production de 5-hydroxytryptamine dans le tissu gastro-intestinal par la morphine sont en faveur d'un mécanisme périphérique.
- TRT: Les neuroleptiques, à doses faibles, (l'halopéridol et le dropéridol)
- Le métoclopramide est + ou - actif .
- L'action d'atonie des fibres longitudinales et d'hypertonie des fibres circulaires et des sphincters sur le reste du tube digestif explique la constipation, et l'hyperpression dans les voies biliaires.
Actions sur l'appareil urinaire
- Augmente le tonus des fibres circulaires du sphincter vésical.
- Baisse la tonicité et l'activité des fibres longitudinales.
- Ces actions s'observent le plus fréquemment par voie médullaire , et sont à l'origine de la rétention d'urines.
- L'incidence est de 10 à 20 % pour une dose de 4 mg de morphine par voie péridurale.
- Prévention: α2 adrénergiques et α1 antagonistes
Actions sur l'oeil
- Effet myotique par stimulation centrale du noyau parasympathique d'Edinger-Westphal du nerf moteur oculaire commun (III).
- A doses fortes, les pupilles deviennent punctiformes.
- Le myosis des morphiniques est inhibé par:
- l'atropine,
- les ganglioplégiques
- la naloxone.
Tolérance, dépendance physique et assuétude
- Ces différentes manifestations sont le fait de prises répétées de morphiniques et apparaissent à la suite
- d'un arrêt brutal de l'administration de morphiniques
- ou de la prescription d'un antimorphinique,
- tout facteur pouvant faire apparaître un syndrome de sevrage.
- Ces trois termes correspondent à des phénomènes distincts qui peuvent ne pas être associés.
- La tolérance, ou accoutumance : nécessité d'augmenter les doses pour obtenir les mêmes effets.
- L'ensemble des actions des morphiniques, y compris la dépression respiratoire, tend à s'atténuer pour une dose donnée.
- En fait, il est souvent difficile en cas de douleurs chroniques de distinguer l'accoutumance véritable du renforcement du processus douloureux.
- Néanmoins, dans les modèles expérimentaux , il a été montré que la tolérance peut apparaître rapidement, en quelques jours.
- La même constatation a été notée chez les malades de réanimation.
- Cette tolérance peut apparaître seule, sans dépendance physique et sans assuétude.
- La dépendance physique : état physiologique caractérisé par un syndrome de sevrage à l'arrêt brutal de l'administration de morphiniques.
- Les premières manifestations comprennent
- larmoiement, rhinorrhée, sueurs, tachycardie.
- Puis se développent progressivement en 12 à 72 heures les éléments suivants :
- crampes abdominales, tremblements, nausées, vomissements, diarrhée, déshydratation et tendance à l'acidose métabolique, mydriase, torpeurs entrecoupées de phases brutales d'agitation, agressivité, instabilité excessive, hypotension artérielle.
- L'assuétude ou " addiction " : dépendance psychique éprouvée comme un état de besoin ou de compulsion qui presse le sujet à répéter indéfiniment l'administration du produit afin d'en percevoir les effets psychiques et quelquefois afin d'éviter l'inconfort du sevrage.
- La tolérance peut être présente ou absente.
- phénomène distinct de la tolérance et de la dépendance physique.
- L'assuétude est l'une des craintes classiquement développée par certains médecins, pour ne pas prescrire un traitement antalgique morphinique.
- En fait, quand le morphinique est prescrit de manière appropriée, l'assuétude d'origine iatrogène est exceptionnelle (dans une étude 4 cas pour 12 000 patients ).
a) Les antalgiques mineurs (Palier I)
i) Paracétamol (PERFALGAN®)
Introduction
Le para -acétyl-amino-phénol ou PARACÉTAMOL
En 1888, (Bayer): le paranitrophénol, un déchet de l’industrie des colorants est similaire à l’acétanilide. Oscar Hinsberg le transforme en acétophénitidine et montre ses effets antipyrétiques. C’était la phénacétine …
En 1889 On trouve de l’acétaminophène dans les urines de patients traités par phénacétine; Karl Morner montre que l’acétaminophène, est efficace contre la douleur et la fièvre.
En 1893, Joseph von Mering, compare le paracétamol et la phénacétine et affirme que le paracétamol est plus néphrotoxique que la phénacétine
Présentation
Un flacon de 100 ml contient 1000 mg de paracétamol.
Propirétés pharmacodynamiques
Le mécanisme précis des propriétés antalgiques et antipyrétiques du paracétamol reste à établir pouvant impliquer des actions centrales et périphériques.
 Effet antalgique
Effet antalgique
- Début de soulagement de la douleur dans les 5 à 10 minutes suivant le début de l'administration.
- Le pic de l'effet antalgique est obtenu en 1 heure et la durée de cet effet est habituellement de 4 à 6 heures.
Effet antipyrétique
- Réduit la fièvre dans les 30 minutes suivant le début de l'administration et la durée d'effet antipyrétique est d'au moins 6 heures.
Propirétés pharmacocinétiques
Absorption :
Pharmacocinétique linéaire jusqu'à 2 g en dose unique et après administration répétée sur 24 h.
Biodisponibilité après perfusion de 500 mg et 1 g est similaire à celle observée après perfusion de 1 g et 2 g de propacétamol (contenant 500 mg et 1 g de paracétamol respectivement).
La concentration plasmatique maximale (Cmax) observée à la fin des 15 minutes de perfusion intraveineuse de 500 mg et 1 g est de l'ordre de 15 µg/ml et 30 µg/ml respectivement.
Distribution :
- Le volume de distribution (Vd) est approximativement de 1 L/kg.
- La liaison aux protéines plasmatiques est faible.
- Après perfusion de 1 g , des concentrations significatives (de l'ordre de 1,5 µg/ml) ont été retrouvées dans le liquide céphalorachidien dès la 20ème minute après la perfusion.
Métabolisme
- Essentiellement au niveau du foie selon 2 voies hépatiques majeures : la glycuroconjugaison et la sulfoconjugaison.
- Cette dernière voie est rapidement saturable aux posologies supérieures aux doses thérapeutiques.
- Une faible proportion (moins de 4%) est transformée par le cytochrome P450 en un intermédiaire réactif (le N-acétyl benzoquinone imine) qui, dans les conditions normales d'utilisation, est rapidement détoxifié par le glutathion réduit et éliminé dans les urines après conjugaison à la cystéine et à l'acide mercaptopurique.
- En revanche, lors d'intoxications massives, la quantité de ce métabolite toxique est augmentée.
Elimination
- L'élimination des métabolites est essentiellement urinaire.
- 90% de la dose administrée est excrétée dans les urines en 24 heures, principalement sous forme glycuroconjuguée (60 à 80%) et sulfoconjuguée (20 à 30%).
- Moins de 5% est éliminé sous forme inchangée.
- La demi-vie plasmatique(t1/2) est de 2,7 heures et la clairance corporelle totale est d'environ 18 L/h.
Indications
- Taitement de courte durée des douleurs d'intensité modérée, (postopératoire+++)
- Traitement de courte durée de la fièvre
Contre-indications
- Hypersensibilité au parcétamol
- Insuffisance hépatocellulaire sévère.
Précautions d'emploi
- Réservé à l'adulte et à l'enfant de plus de 33 kg
- Insuffisance hépatocellulaire
- Insuffisance rénale sévère (Clcr < = 30 ml/mn)
- Alcoolisme chronique
- Malnutrition chronique
- Déshydratation
- Grossesse
- Déficit en G6PD
Posologie
Adultes et adolescents pesant plus de 50 kg : . 1 g de paracétamol (100 ml) en 15 mn, jusqu'à 4 fois par jour. avec un intervalle d'au moins 4 h entre deux administrations. . La dose maximale journalière ne doit pas excéder 4 g.
Enfants de plus de 33 kg (environ 11 ans), adolescents et adultes de moins de 50 kg : . 15 mg/kg de paracétamol par administration, soit 1,5 ml de solution par kg en 15 mn, jusqu'à 4 fois par jour. avec un intervalle d'au moins 4 h entre deux administrations. . La dose maximale journalière ne doit pas excéder 60 mg/kg (sans dépasser 3 g).
Insuffisance rénale sévère : Il est recommandé d'augmenter l'intervalle entre 2 administrations à 6 heures au moins lors de l'administration du paracétamol chez l'insuffisant rénal sévère (clairance de la créatinine < = 30 ml/min)
Surdosage
- Avant de commencer le traitement, faire le dosage plasmatique du paracétamol.
- L'administration de l'antidote N-acétylcystéine (NAC) par voie intraveineuse ou voie orale, si possible avant la dixième heure. La NAC peut cependant apporter une certaine protection même après 10 heures, mais dans ce cas un traitement prolongé est donné.
- Traitement symptomatique.
----------------------------------------------------------------------------------------------------------------------------------------------
ii)Néfopam (Acupan®)
FORMES et PRÉSENTATIONS
Solution injectable : Ampoules de 2 ml, boîte de 5
2 ml = 20 mg de néfopam
INDICATIONS
Traitement symptomatique des affections douloureuses aiguës, notamment des douleurs postopératoires.
POSOLOGIE ET MODE D'ADMINISTRATION
Voie IM : 20 mg par injection. Si nécessaire, peut être répétée toutes les 6 heures sans dépasser une dose totale de 120 mg/24 heures.
Voie IV :
- en IV lente sur plus de 15 minutes, le patient étant en décubitus, afin d'éviter la survenue d'effets indésirables (nausées, vertiges, sueurs).
- La dose unique : 20 mg par injection, répétée toutes les 4 heures, si nécessaire, sans dépasser une dose totale de 120 mg/24 heures.
CONTRE-INDICATIONS
- Hypersensibilité au néfopam ou à l'un des constituants d'Acupan.
- Enfant de moins de 15 ans, en l'absence d'étude clinique.
- Convulsions ou antécédents de troubles convulsifs.
- Risques de rétention urinaire liés à des troubles urétroprostatiques.
- Risque de glaucome par fermeture de l'angle.
PHARMACODYNAMIE
Acupan a montré un effet sur le frisson postopératoire au cours d'études cliniques.
Acupan n'a aucune action anti-inflammatoire ou antipyrétique. Il n'entraîne pas de dépression respiratoire et ne ralentit pas le transit intestinal.
Acupan possède une activité anticholinergique.
Sur le plan hémodynamique, il a été observé une augmentation modérée et transitoire de la fréquence cardiaque et de la pression artérielle.
Activité antihyperalgésique par un mécanisme qui n'est pas complètement élucidé.
PHARMACOCINÉTIQUE
Après 20 mg par voie IM, le pic plasmatique (Tmax) est situé entre 0,5 et 1 heure et les concentrations maximales (Cmax) sont en moyenne de 25 ng/ml.
La demi-vie plasmatique moyenne est de 5 heures.
Lors d'une administration par voie IV d'une même dose, la demi-vie plasmatique moyenne est de 4 heures.
La liaison aux protéines plasmatiques est de 71-76 %.
La biotransformation est importante et 3 métabolites majeurs ont été identifiés : le déméthyl-néfopam, le N-oxyde-néfopam et le N-glucuronide-néfopam. Les deux premiers métabolites, non conjugués, n'ont pas montré d'activité analgésique chez l'animal.
L'élimination est essentiellement urinaire : 87 % de la dose administrée sont retrouvés dans les urines. Moins de 5 % de la dose sont excrétés sous forme inchangée ; les métabolites identifiés dans les urines représentent respectivement 6 %, 3 % et 36 % de la dose administrée par voie IV.
----------------------------------------------------------------------------------------------------------------------------------------------
iii)Anti-inflammatoires non stéroïdiens (AINS).
RAPPEL PHYSIOPATHOLOGIQUE
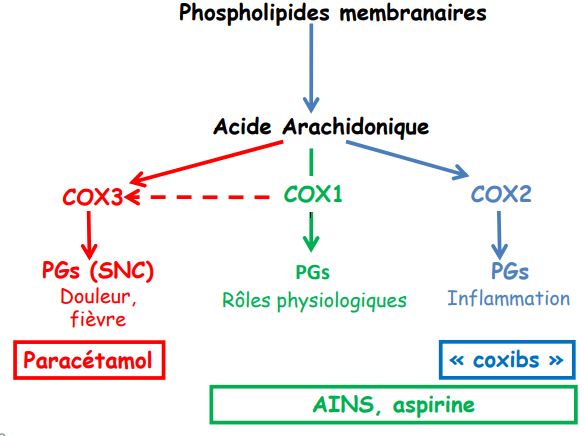
Les AINS sont tous des inibiteurs de la cyclo-oxygénase (COX).
Il existe plusieurs isoformes de la COX :
- La COX1 constitutive (reins, estomac, vaisseaux, etc.) a un rôle physiologique. Elle permet la synthèse des prostaglandines (PG) intervenant dans l’estomac (cytoprotection), les reins (maintien du flux sanguin rénal) et la synthèse du thromboxane A2 plaquettaire (vasoconstriction et agrégation plaquettaire). Son inhibition est donc responsable des effets indésirables des AINS (toxicité gastrique, diminution du flux sanguin rénal et effet anti-agrégant plaquettaire).
- La COX2 inductible par des autacoïdes (IL1, TNFα) en cas d’inflammation permet la synthèse des PG intervenant dans ces réactions. Son inhibition est responsable des effets pharmacodynamiques des AINS (effet anti-inflammatoire ainsi que les effets analgésiques et antipyrétiques).
MÉDICAMENTS EXISTANTS
|
Dénomination Commune Internationale |
Famille chimique |
|---|---|
|
Phénylbutazone |
Pyrazolés |
|
Indométacine Sulindac |
Indoliques |
|
Acéclofénac Acide tiaprofénique Alminophène Diclofénac Etodolac Fénoprofène Flurbiprofène Ibuprofène Kétoprofène Kétorolac Nabumétone Naproxène sodique |
Arylcarboxyliques |
|
Acide niflumique Acide méfénamique |
Fénamates |
|
Piroxicam Meloxicam Ténoxicam |
Oxicams |
| Nimésulide | Sulfonalidine |
|
Célécoxib Parécoxib |
Inhibiteurs sélectifs de la Cox-2 ou Coxibs |
MÉCANISMES D’ACTION DES DIFFÉRENTES MOLÉCULES
Par leur action inhibitrice de la COX, tous les AINS inhibent la transformation de l’acide arachidonique en prostaglandines ou thromboxanes.
Les Coxibs sont des inhibiteurs dits "sélectifs" de la COX2 aux doses usuelles. Ils ont été présentés comme une nouvelle classe d’AINS agissant préférentiellement sur la synthèse des prostaglandines lors des phénomènes inflammatoires, et donc sans effet indésirable gastrique. Or, ils n’ont pas montré d'avantages sur ce plan par rapport aux autres AINS et leur efficacité n’est pas supérieure à celle des AINS classiques. En revanche, ils exposent à des effets indésirables cardiovasculaires pouvant être graves (risque d’infarctus du myocarde). L’augmentation de la fréquence d’infarctus du myocarde et d’AVC a d’ailleurs conduit au retrait mondial en 2004 du rofécoxib.
Enfin, en inhibant préférentiellement la COX2, les Coxibs ne diminuent pas la production de thromboxane. Ils n’ont donc pas d’effet anti-agrégant plaquettaire.
EFFETS UTILES EN CLINIQUE
Certains AINS sont commercialisés à faibles doses pour leur effet antalgique et antipyrétique, leur effet anti-inflammatoire n’apparaissant qu’à des doses plus élevées.
| Molécules | Indications |
| Ibuprofène, kétoprofène, diclofénac, naproxène, acide méfénamique | Traitement symptomatique des affections douloureuses et/ou fébriles |
| Classe des oxicams (piroxicam, meloxicam, ténoxicam) | Douleurs post-opératoires, crises de coliques néphrétiques, traumatologie, traitement adjuvant des manifestations inflammatoires en stomatologie ou chirurgie dentaire ou ORL. |
| Parécoxib | Traitement à court terme des douleurs post-opératoires. |
PHARMACODYNAMIE DES EFFETS UTILES EN CLINIQUE
L’effet anti-inflammatoire, l’effet antalgique et l’effet antipyrétique résultent de l’inhibition de la formation des prostaglandines :
- Effet anti-inflammatoire : atténuation des phénomènes inflammatoires impliquant les prostaglandines (vasodilatation, œdème, douleur) sans effet sur les processus entraînant des lésions tissulaires chroniques.
- Effet antalgique : atténuation des douleurs d’origine périphérique.
- Effet antipyrétique : diminution de la fièvre et retour à la normale de la température corporelle par abaissement du seuil du thermostat hypothalamique.
L’importance respective de ces trois effets varie avec les produits.
L’effet anti-agrégant plaquettaire résulte de l’inhibition de la formation de thromboxane. Les Coxibs sont dénués d’effet antiplaquettaire à dose usuelle.
Date de dernière mise à jour : 21/05/2023
Ajouter un commentaire