- Accueil
- Modules 1ére année
- 4. ENSEIGNEMENTS DIRIGÉS & PRATIQUES-Techniques- (VH: 90 h, Coef: 3)
- Hypo et hyperthermie per opératoires
Hypo et hyperthermie per opératoires
Hyperthermie maligne anesthésique André LIENHART, Marie-Reine LOSSER,PH Service d'Anesthésie-Réanimation
L'hypothermie peropératoire
Généralités
Espèce humaine : homéotherme
Température centrale régulée (37 ±0,2 °C)
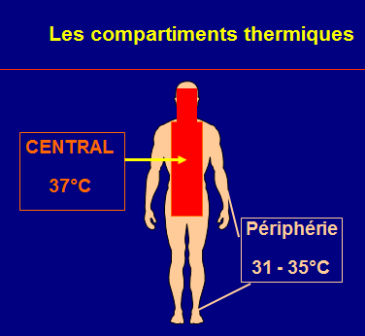
Compartiments thermiques : central et périphérique
Centre régulateur : hypothalamus
Ajustement nycthéméral pertes/production de chaleur
Physiologie
Température du noyau constante ± 0.5°C, dans air sec et immobile (N =36-37,5)
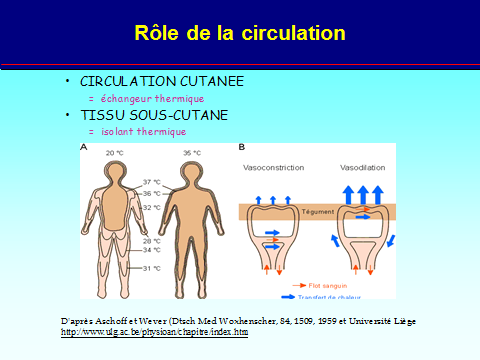
Enveloppe (peau) à température et surface variable = échangeur (avec voies aériennes) et isolant par tissu gras (conductance variable selon vasoactivité de 1 à 7)
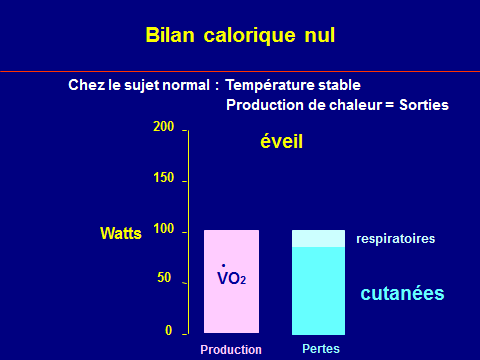
Equilibre entre production et perte = T° corporelle
Thermorégulation normale
Réponse au froid
Seuil (niveau central) :
- 80 % température centrale
- 20 % température cutanée
Réponse
- Vasoconstriction = ↓ pertes
- cantonne la production de chaleur
- Frisson = ↑ VO2
- Thermogenèse sans frisson = négligeable / adulte
Le coup de chaleur (Bouchama, NEJM 2002)
T° du noyau >40°C, peau chaude et sèche et anomalies neurologiques
- Par exposition à chaleur excessive
- Par exercice physique intense
Forme d’hyperthermie associée à SIRS (Systemic inflammatory response syndrome) avec défaillance d’organes, prédominance encéphalopathie (variabilité individuelle)
Contexte urbain, T° diurne> 35°C, et nocturne >20°C > 2-3 jours
Dilatation cutanée maximale en réponse à l’hyperthermie (jusqu’à DC 20 l/min, débit cutanée 8l/min), entraîne gain de chaleur par l’environnement
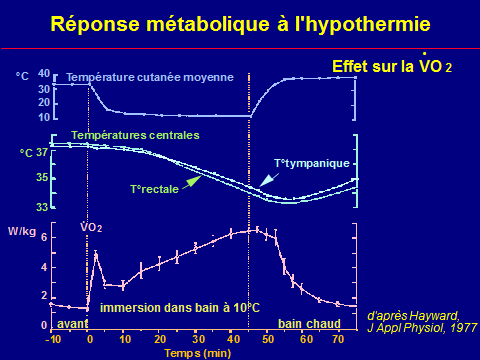
Thermogenèse
Production de chaleur
La VO2 peut s'exprimer :
(A) en ml / min (300 ml / min)
(B) en watts : (A) / 3 (100 W)
(C) en calories par jour : (B) x 20 (2 000 cal/j)
Thermolyse normale
Pertes de chaleur
Conduction*: (3 %)
Convection**: (15 %)
Radiation: (60 %)
Évaporation: (22 %)
→ Peau ~ 90 %
* La conduction thermique (ou diffusion thermique) est un mode de phénomène de transfert thermique provoqué par une différence de température entre deux régions d'un même milieu, ou entre deux milieux en contact
** Transfert de la chaleur dans un fluide par déplacement des molécules vers les zones de moindre densité
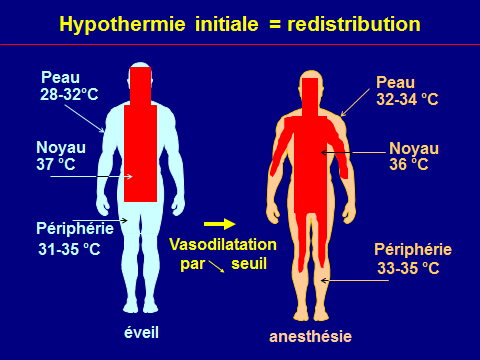
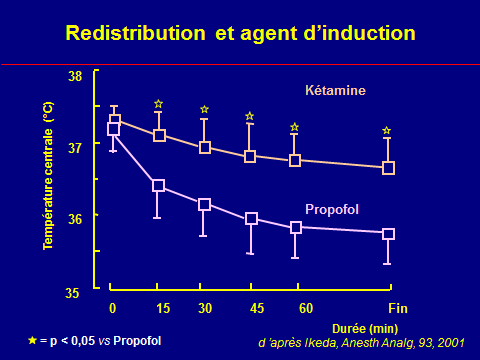
Hypothermie peropératoire : mécanismes
Thermorégulation altérée
VO2↓
Pertes accrues
Hypothermie peropératoire
Parfois souhaitée (cardio-, neuro-chirurgie)
Complications bien démontrée:
- retard de réveil surtout patient âgé, coronarien…
- Modification immunitaire → infection de cicatrice (↓x3) NEJM 1996
- Altération coagulation et fonction plaquettaire → Augmentation besoins transfusionnels Lancet 1996
Détection, réchauffement actif (perfusion, réchauffeur à air, etc) pas encore optimum, cher…
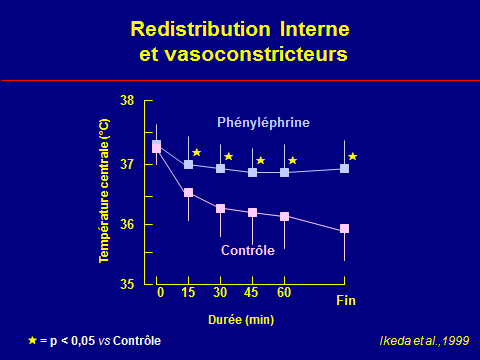
La vasoconstriction périphérique retarde le réchauffement du noyau
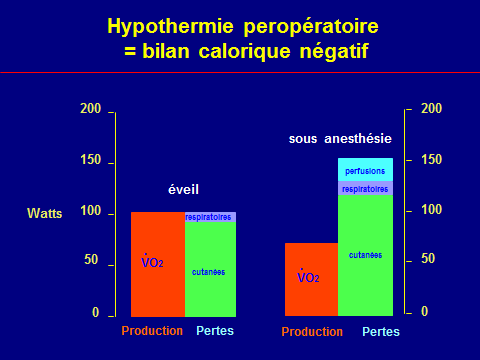
Bilan thermique peropératoire
VO2 ≈ -10 % (≈70 W)
Pertes cutanées (≈ 100 W)
Perfusions (≈ 18 W)
Humidification-réchauffement des gaz (≈ 18 W)
Plaie opératoire (≈ ?)
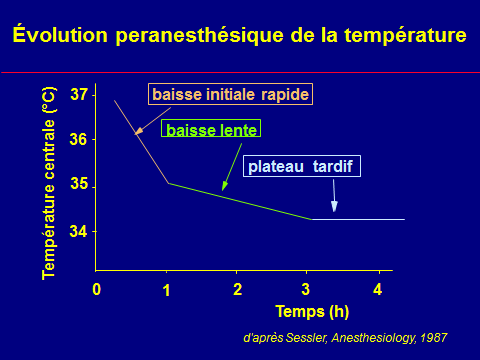
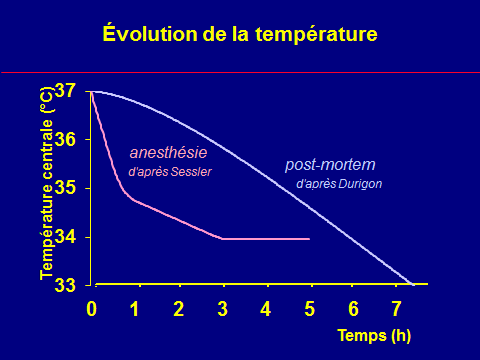
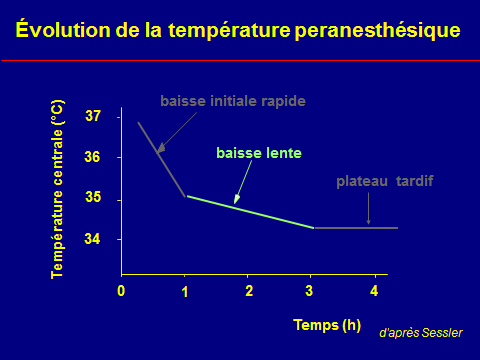
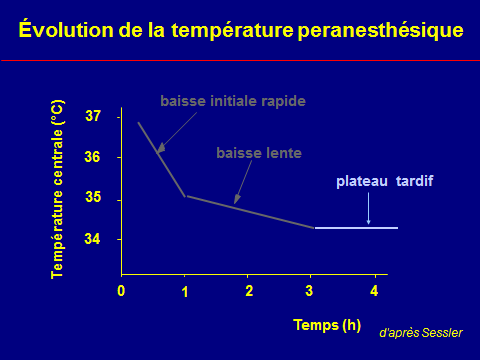
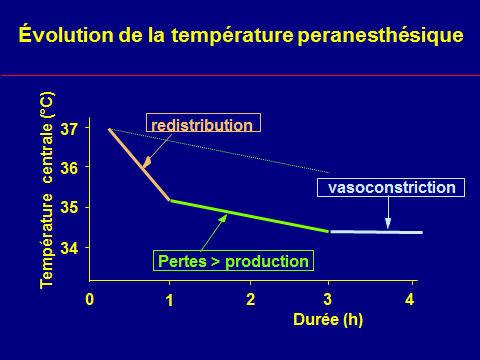
Évolution peranesthésique de la température
Le bilan thermique négatif
n'explique pas l'intensité
de l'hypothermie initial
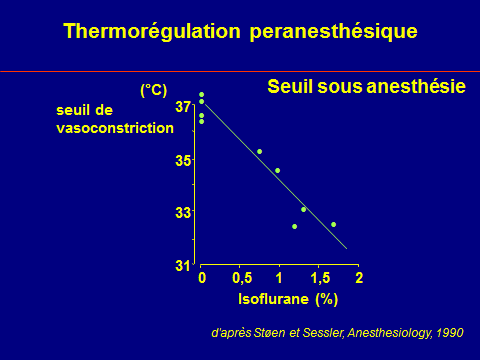
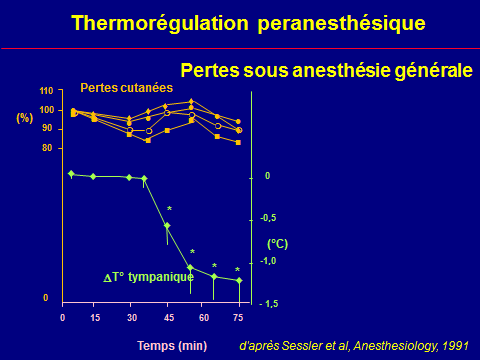
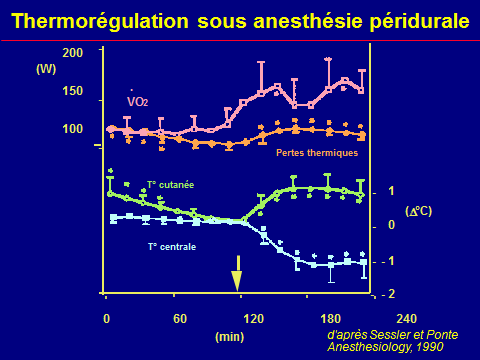
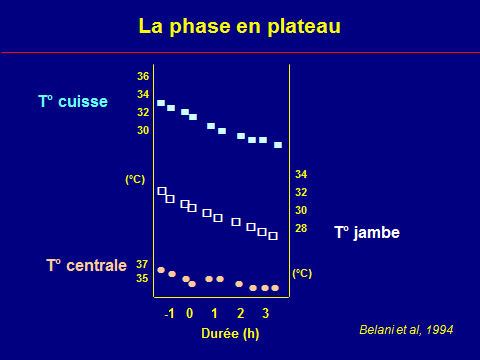
Thermorégulation peranesthésique
L'hypothermie peropératoire
Conséquences
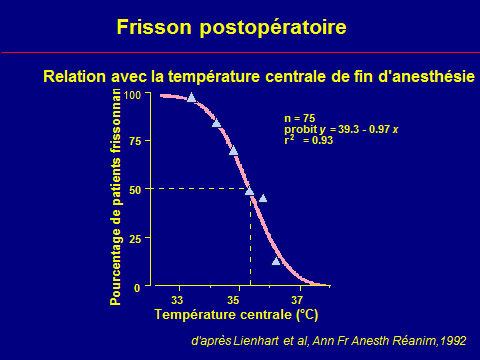
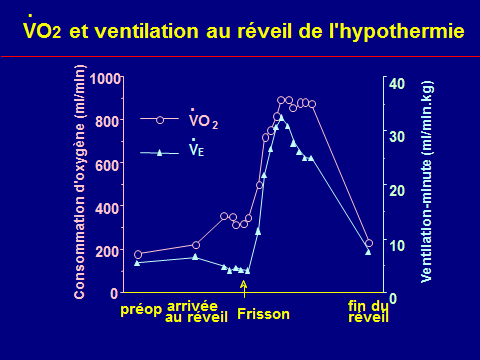
Frisson
Augmentation de VO2
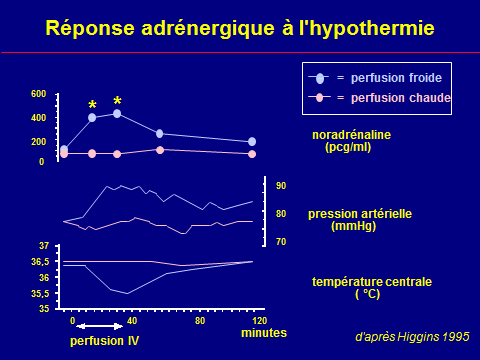
Hypercatécholaminémie
Vasoconstriction
Saignement
Taux d'infections pariétales
Morbidité cardiovasculaire et hypothermie
|
CONTRÔLE (n = 158) |
RÉCHAUFFÉ (n = 142) |
|
|
Température centrale fin d’intervention (°C) |
35,4 ± 0,1 |
36,7 ± 0,1** |
|
Anomalies ECG (ischémie, arythmies ventriculaires) |
16 % |
7%* |
|
Complications cliniques (angor instable, infarctus, arrêt cardiaque) |
6 % |
1%* |
|
Complications ECG + cliniques |
21% | 8%* |
** = p < 0,01 vs Contrôle
* = p < 0,05 vs Contrôle d’après Frank, JAMA, 1997:277
Saignement
Taux d'infections pariétales
Prévention
Comment éviter les conséquences de l'hypothermie peropératoire ?
- Continuer l'anesthésie en salle de réveil
- Donner des médicaments qui bloquent le frisson ou ses conséquences
- Utiliser d'autres moyens de prévenir la transfusion, les infections de paroi ...
La voie la plus simple et la plus logique est
la prévention de l'hypothermie
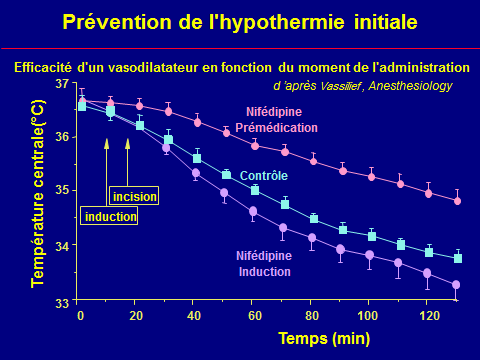
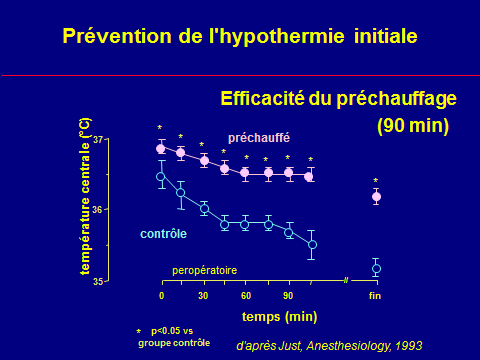
Prévention de l'hypothermie peranesthésique
Ce qui est efficace (la peau)
Ce qui l'est peu
- L'humidification-réchauffement des gaz
- Le réchauffement des perfusions
Ce qui est indispensable
- Le réchauffement des transfusions
Limites du réchauffement cutané
La température cutanée (sécurité)
La surface (effet de serre)
Le temps (redistribution)
Les autres moyens de réchauffement
Toujours associés au réchauffement cutané
Dangereux :
- le matelas chauffant
- Le bricolage
Inutiles :
- le réchauffement des gaz anesthésiques
- le réchauffement des gaz insufflés en cœliochirurgie
(humidification ?)
Partiellement utiles :
- le réchauffement des perfusions
- le réchauffement des liquides d’irrigation (prostatectomie)
- l’isolation cutanée
Obligatoire : les transfusions rapides/massives
Conclusion 2005
Physiopathologie connue
Prévention de l'hypothermie possible
Prévention de l'hypothermie souhaitable : chaque fois que l'ischémie cérébrale n'est pas crainte a priori
Conséquences
La prévention de l’hypothermie doit faire partie de la prise en charge de tout patient anesthésié et ce d’autant plus
- précocement que l’intervention est plus courte
- intensément que l’intervention est hémorragique
- impérativement que le patient est âgé ou coronarien
Seul le réchauffement cutané par couvertures chauffantes est réellement efficace
Le coût est un élément du choix du matériel utilisé
J.-F. Payen de la Garanderie; T. Depret; N. Monnier; Y. Nivoche; J. Lunardi; R. Krivosic-Horber. Encyclopédie Médico-Chir
Hyperthermie maligne anesthésique
Introduction
L’hyperthermie maligne est une complication rare de l’anesthésie, avec une incidence de 1/15 000 à 1/30 000 anesthésies.
En 1960, un tableau d’hyperthermie peropératoire commun à toute une famille fut pour la première fois rapporté dans la littérature.
Cette hyperthermie, déclenchée par l’éther et par l’halothane, fut responsable de 10 décès chez 24 membres de la famille.
Les auteurs notaient que cette affection était génétiquement transmissible.
Il faudra attendre les années 1970 pour rapporter cet état d’hyperthermie à une origine musculaire et permettre la mise en place d’un test diagnostique de référence, le test de contracture in vitro à l’halothane et à la caféine.
La crise d’hyperthermie maligne (HM) correspond à un état d’hypermétabolisme musculaire, transmissible sur un mode autosomique dominant, déclenché exclusivement par l’emploi d’agents anesthésiques volatils avec ou sans l’adjonction d’un curare dépolarisant, la succinylcholine.
En réponse à ces agents déclenchants, l’élévation progressive de la concentration intracytosolique de calcium des fibres musculaires striées est à l’origine d’une contracture musculaire.
Celle-ci entraîne un dégagement de chaleur et une destruction progressive des muscles, responsable d’une rhabdomyolyse majeure et de troubles du rythme cardiaque par hyperkaliémie.
La crise d’HM est donc l’expression clinique d’une myopathie métabolique infraclinique, caractérisée par le trait « sensibilité à l’HM » (HMS). Ce trait est révélé par une réponse positive au test de contracture in vitro et/ou par la présence d’une mutation génétique causale.
Diagnostic de la crise d’hyperthermie maligne
L’accès classique d’HM comprend un syndrome d’hypermétabolisme et un syndrome musculaire pouvant aboutir àbune défaillance multiviscérale. Outre la forme typique, il existe debnombreuses formes atypiques, qu’il faut savoir différencier d’autresbsituations non liées à l’HM.
FORME TYPIQUE
La forme typique peut être soit fulminante, se développant en quelques minutes, soit modérée, présentant tous les signes de la crise d’HM mais dont le développement est plus lent, voire ninterrompu par l’arrêt des agents halogénés.
La forme fulminante est rare (6 % des crises d’HM), mais la plupart des décès appartiennent à cette forme clinique.
Signes d’hypermétabolisme
Les signes d’hypermétabolisme sont très précoces. L’emballement métabolique cellulaire provoque une augmentation de la consommation d’oxygène et une surproduction endogène de CO2.
Les premiers signes cliniques sont donc en rapport avec cette hypercapnie aiguë :
- la fréquence cardiaque s’accélère,
- le patient devient tachypnéique ou lutte contre le ventilateur,
- les téguments sont chauds, rouges et couverts de sueurs.
- Une augmentation progressive du CO2 expiré (PetCO2) au niveau du capnographe est constante, la PetCO2 pouvant dépasser 80 mmHg ; c’est le signe le plus évocateur de la crise d’HM.
- À ce stade, la mesure des gaz du sang artériel révèle une acidose respiratoire.
- Chez un patient en ventilation mécanique, il n’y pas de baisse de la saturation artérielle en oxygène (SaO2), car les échanges gazeux ne sont pas altérés par la crise d’HM et il n’y a pas initialement de troubles de la délivrance tissulaire en oxygène.
- En revanche, l’opérateur peut signaler rapidement la présence de sang veineux cyanosé dans le champ opératoire, témoin d’un effondrement de la saturation veineuse en oxygène (SvO2).
- La température rectale s’élève peu à peu, parfois d’un degré toutes les 5 minutes dans les formes fulminantes, jusqu’à atteindre 43-44 °C.
- Mais l’hyperthermie est considérée à l’heure actuelle comme un signe tardif de la crise d’HM.
Signes musculaires
Ces signes d’hypermétabolisme s’accompagnent d’un syndrome musculaire, marqué par une rigidité musculaire et une rhabdomyolyse.
La rigidité musculaire peut être précoce, localisée aux muscles des masséters ou des membres inférieurs, ou plus tardive, généralisée, gênant la ventilation mécanique.
Le spasme des masséters correspond à une relaxation incomplète des muscles de la mâchoire après administration de succinylcholine. Initialement, une incidence de 1 % avait été rapportée aux États-Unis chez les enfants recevant halothane et succinylcholine, tous étant classés HMS selon un test non validé. Ces résultats dépassaient largement l’incidence de l’HM dans la population.
Par la suite, une définition clinique précise et l’usage du test de contracture in vitro ont permis d’estimer l’incidence du spasme des masséters à 1/100 000 chez les enfants, 50 % d’entre eux étant HMS.
De plus, il a été montré que la succinylcholine provoque de manière habituelle une augmentation du tonus des muscles de la mâchoire et une réduction de l’ouverture de bouche avant l’apparition des fasciculations musculaires.
La définition du spasme des masséters est alors devenue une contracture permanente des muscles de la mâchoire, rendant l’intubation trachéale impossible ou difficile.
Il s’agit d’un signe indicateur de crise d’HM, puisque environ 50 % des patients ayant un spasme des masséters sont HMS.
Signes biologiques
Le tableau clinique de la crise d’HM se complète d’une rhabdomyolyse dont la définition est biologique :
- élévation des CPK à plus de 100 fois leur valeur normale,
- myoglobinémie et myoglobinurie,
- hyperkaliémie,
- cytolyse hépatique.
Associés à une acidose respiratoire puis mixte, ces signes biologiques sont à l’origine de troubles du rythme cardiaque, d’une insuffisance rénale oligoanurique, de troubles de l’hémostase, et font toute la gravité de la crise d’HM.
En résumé
Signes cliniques et biologiques précoces de la crise d’hyperthermie maligne
– Spasme des masséters
– Tachycardie
– Rigidité musculaire localisée
– Acidose respiratoire (PetCO2 > 55 mmHg en ventilation mécanique)
– Hyperkaliémie
– Baisse de la SvO2
AGENTS DÉCLENCHANTS
Tous les agents halogénés sont des agents déclenchants : La vitesse d’apparition de la
crise est plus lente avec le desflurane et le sévoflurane, étant en moyenne de 35 minutes sous halothane, 140 minutes sous isoflurane et 260 minutes sous desflurane, en l’absence de succinylcholine.
La succinylcholine est un agent déclenchant de l’HM, mais, à ce jour, son rôle a toujours été décrit en association avec les agents halogénés. Aucune crise d’HM n’a été rapportée avec l’emploi isolé de succinylcholine chez un sujet ayant été classé HMS.
Traitement de la crise d’hyperthermie maligne
C’est en 1982 qu’un tournant décisif dans le pronostic des crises d’HM a été pris avec la découverte de l’efficacité surprenante du dantrolène chez l’homme. Ce composé hydantoïque était alors connu des neurologues pour traiter des phénomènes de spasticité musculaire.
Le dantrolène sodique ne garde aujourd’hui qu’une seule indication par voie intraveineuse : le traitement de la crise d’HM. Son mode d’action est directement ciblé sur la cellule musculaire, en inhibant le relargage de calcium à partir du réticulum sarcoplasmique.
Plus précisément, le dantrolène aurait au moins deux sites de liaison sur le récepteur à la ryanodine. Il est, à ce titre, myorelaxant bien que n’ayant aucune action sur la jonction neuromusculaire. Le dantrolène est métabolisé par voie hépatique, puis éliminé par voie rénale ; il possède une demi-vie d’élimination de 12 heures. Après un bolus intraveineux, des taux sanguins résiduels avec sensation de fatigue musculaire peuvent persister pendant 24 heures.
La biodisponibilité du dantrolène par voie orale est moyenne (70 %), le pic plasmatique est observé 6 heures plus tard, ce qui limite l’intérêt de cette voie d’administration. Une seule interaction est à éviter, l’association vérapamil-dantrolène, responsable de troubles du rythme ventriculaire.
Le traitement de la crise d’HM est une urgence thérapeutique. En effet, l’efficacité des trois principales mesures thérapeutiques, à savoir l’arrêt de l’administration des agents halogénés, l’hyperventilation en oxygène pur et l’administration intraveineuse de dantrolène, dépend étroitement de la rapidité de leur mise en oeuvre.
stopper immédiatement l’administration de l’agent halogéné, et envisager soit de réveiller le patient, soit de poursuivre l’intervention sous perfusion continue de propofol, morphiniques et curares non dépolarisants si nécessaire ;
– hyperventiler le patient (au moins 10 l min–1) en oxygène pur. Ilbne sert à rien de perdre du temps à changer le ventilateur ou le circuit de ventilation ;
– administrer le dantrolène (Dantriumt injectable) à la dose de 2,5 mg kg–1 en intraveineux direct, à renouveler par bolus de 1 mg kg–1 pour obtenir une régression des signes cliniques (tachycardie, hypercapnie, hyperthermie, rigidité). Une dose supérieure à 10 mg kg–1 est parfois nécessaire ;
– refroidir le patient (glace aux quatre membres), jusqu’à une température de 37 °C ;
– prélever du sang artériel pour analyse des gaz du sang, ionogramme, dosages de créatinine, lactate, myoglobine, facteurs de l’hémostase, enzymes musculaires et hépatiques ;
– effectuer un remplissage vasculaire (macromolécules) et une diurèse alcaline forcée pour maintenir une diurèse supérieure à 1 ml kg–1 h–1 (sondage urinaire, voie veineuse centrale). C’est letraitement immédiat de toute rhabdomyolyse sévère. En outre, l’hypovolémie peut être aggravée par le mannitol présent dans les flacons de dantrolène (3 g de mannitol pour 20 mg de dantrolène) ;
– corriger une hyperkaliémie menaçante par le traitement symptomatique (gluconate de calcium, bicarbonate de sodium isotonique, glucose-insuline) ;
– admettre le patient en réanimation pour une surveillance des constantes vitales, le maintien de la ventilation (effet myorelaxant du dantrolène) et la poursuite du traitement pendant 48 heures en raison de la fréquence des formes récurrentes (30 %).
Selon la symptomatologie, le dantrolène sera administré par voie IV continue (1 mg kg–1 h–1) ou discontinue (1 mg kg–1 toutes les 4 heures).
En résumé
Les quatre mesures thérapeutiques à prendre immédiatement sont :
- stopper les halogénés ;
- hyperventiler en oxygène pur ;
- injecter du dantrolène sodique (Dantriumt) : 2,5 mg kg–1 en IVD ;
- appeler à l’aide.
Administration de dantrolène sodique (Dantrium®)
Faire venir immédiatement 10 flacons de dantrolène au bloc opératoire (soit 200 mgau total).
Diluer la poudre orange de chaque flacon (20 mg) avec 60 ml d’eau distillée sans conservateur.
Injecter en intraveineux direct (IVD) 2,5 mgkg–1 de la solution de dantrolène.
Réinjecter le dantrolène par bolus de 1 mg kg–1 toutes les 10 minutes, jusqu’à régression des signes cliniques (tachycardie, hypercapnie, hyperthermie, rigidité).
Préparer d’autres flacons de dantrolène. Une dose supérieure à 10 mgkg–1 est parfois nécessaire.
Date de dernière mise à jour : 28/02/2020
Ajouter un commentaire