- Accueil
- Modules 1ére année
- 1. PHYSIOLOGIE & PATHOLOGIE (Vh : 120 h, Coef : 3)
- 1) Système nerveux
Objectifs:
L'étude de la physiologie et de la physiopathologie du système nerveux central (SNC) revêt une grande importance pour un auxiliaire médical en anesthésie réanimation (AMAR). Voici quelques objectifs clés de cette étude :
- Compréhension de base : Il est essentiel pour un AMAR de comprendre la structure et le fonctionnement normal du SNC, y compris le cerveau, la moelle épinière et les nerfs périphériques. Cela permet d'acquérir une connaissance approfondie de l'anatomie et de la physiologie du SNC, des voies de transmission des signaux nerveux, des neurotransmetteurs et de la régulation des fonctions neurologiques.
- Évaluation neurologique : La connaissance de la physiologie du SNC permet à un AMAR de réaliser une évaluation neurologique approfondie. Cela inclut l'évaluation des fonctions sensorielles, motrices, cognitives et des réflexes chez les patients. Une bonne compréhension des bases neurologiques permet de détecter rapidement les anomalies neurologiques et d'apporter une prise en charge adaptée.
- Administration des médicaments : En anesthésie réanimation, les AMAR peuvent être impliqués dans l'administration de médicaments agissant sur le SNC. Une connaissance approfondie de la physiopathologie du SNC permet de comprendre les mécanismes d'action des médicaments utilisés en anesthésie, tels que les agents sédatifs, analgésiques, hypnotiques, et d'ajuster leur administration en fonction des besoins spécifiques du patient.
- Surveillance et prévention des complications : Le suivi des patients en anesthésie réanimation nécessite une surveillance continue du SNC. Comprendre la physiopathologie du SNC permet de reconnaître et de prévenir les complications neurologiques potentielles, telles que les troubles de la conscience, les accidents vasculaires cérébraux, les convulsions, etc. L'identification précoce de ces complications est cruciale pour une intervention rapide et appropriée.
- Communication interdisciplinaire : permet à l'AMAR de communiquer efficacement avec d'autres professionnels de la santé, notamment les médecins anesthésistes-réanimateurs . Cette communication interdisciplinaire favorise une prise en charge globale et coordonnée du patient.
a) Rappel Anatomo-physiologique
Introduction
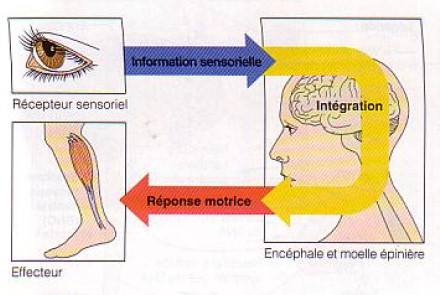
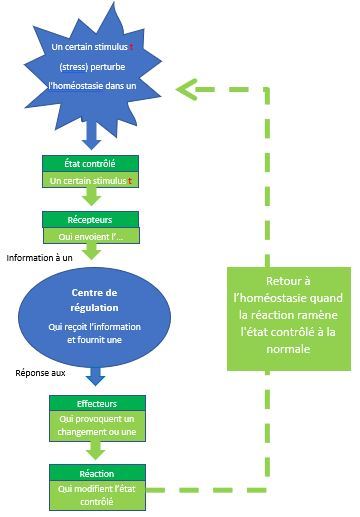
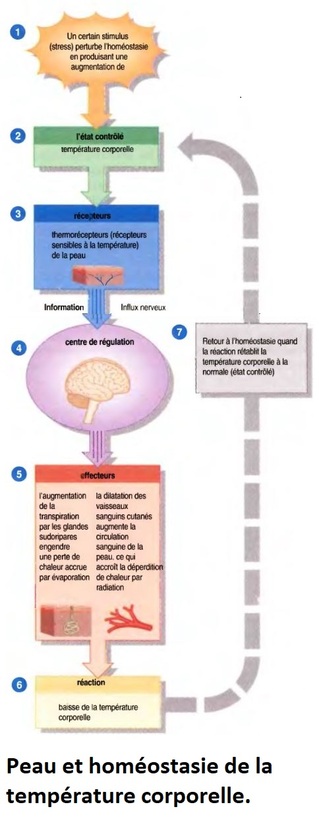
Le système nerveux est le centre de régulation et de communication de l'organisme ; nos pensées, nos actions, nos émotions attestent son activité. Il partage avec le système endocrinien la tâche de régler et de rnaintenir l'homéostasie, mais il est de loin le plus rapide et le plus complexe de ces doux systèmes.
Le système nerveux remplit trois fonctions étroitement liées.
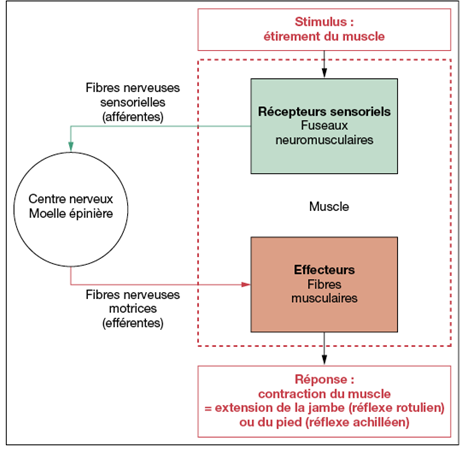
- Premièrement, par l'intermédiaire de ses millions de récepteurs sensoriels, il reçoit de l'information sur les changements qui se produisent tant à l'intérieur qu'à l'extérieur de l'organisme. Ces change ments sont appelés stimulus et l'information recueillie est appelée information sensorielle.
- Deuxièmement, il traite l'information sensorielle et détermine l'action à entreprendre à tout moment. ce qui constitue le processus de l'intégration.
- Troisièmement, il fournit une réponse motrice (commande) qui active des effecteurs, c'est-à-dire des muscles ou des glandes.
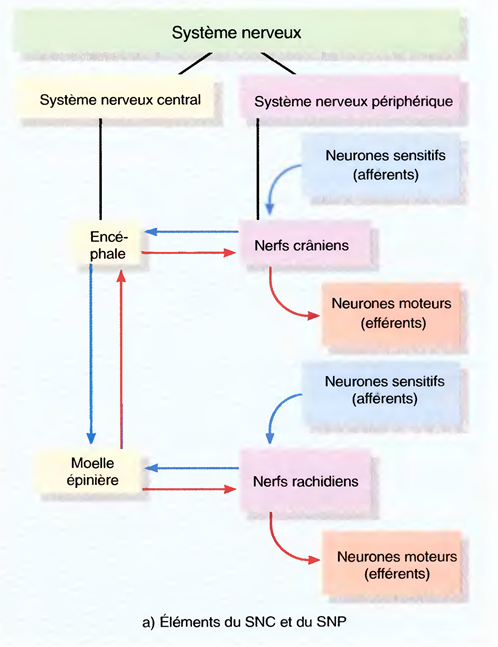
Les divisions du SNC
Le système nerveux comporte deux divisions principales,
- Le système nerveux central (SNC)
- Le système nerveux périphérique (SNP)
Dans le SNC, composé de l'encéphale et de la moelle épinière, ont lieu
- l'intégration et la corrélation de diverses sortes d'informations sensorielles entrantes,
- la génération des pensées et des émotions,
- la formation et le stockage des souvenirs.
De plus, la plupart des influx nerveux qui stimulent la contraction musculaire et la sécrétion glandulaire proviennent du SNC.
Le SNP peut être subdivisé, d'après la partie du corps qui réagit, en
- système nerveux somatique (sôma: corps) (SNS)
- et en système nerveux autonome (SNA),
Anatomie fonctionnelle du tissu nerveux
Le système nerveux, malgré sa complexité, n'est composé que de deux principales sortes de cellules :
les cellules de la névroglie et les neurones.
La névroglie
La Névroglie (glia : glu) ou cellules gliales,
Plus petites que les neurones
5 à 50 fois plus nombreuses qu'eux.
Peuvent se multiplier et se diviser.
Les types de cellules gliales
4 types de cellules gliales :
les astrocytes,
les oligodendrocytes,
les microgliocytes
les cellules épendymaires.
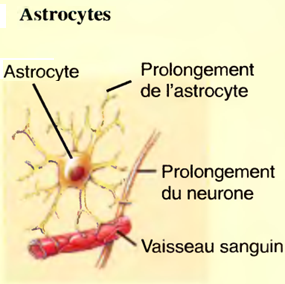
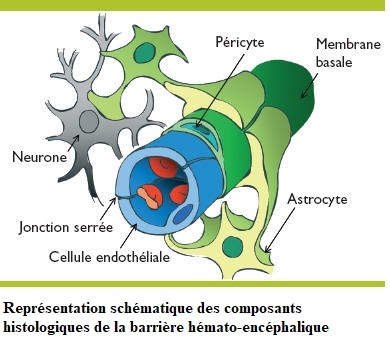
Les astrocytes (astron: astre; kutos : cellule)
Ce sont des cellules étoilées dotées de nombreux prolongements.
Les astrocytes participent au métabolisme des neurotransmetteurs,
Maintiennent l'équilibre du K+ qui assure la génération d'influx nerveux,
Contribuent au développement de l'encéphale,
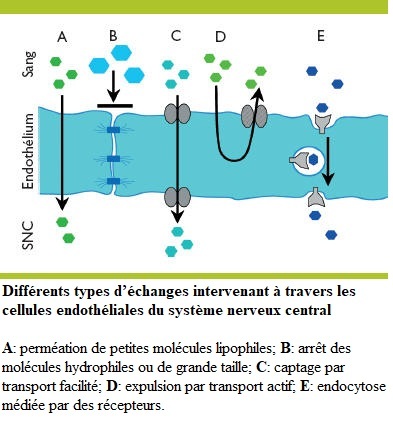
Aident à former la barrière hématoencéphalique,
Constituent un lien entre les neurones et les vaisseaux sanguins.
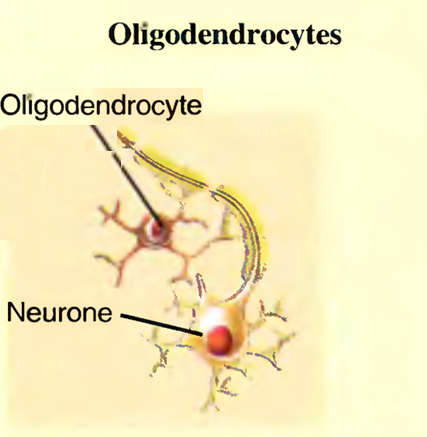
Les oligodendrocytes (oligos : peu nombreux ; dendron : arbre)
sont dotés de peu de prolongements et sont plus petits que les astrocytes.
Ils forment un réseau de soutien par enroulement autour des neurones et produisent un revêtement lipidique et protéique, la gaine de myéline.
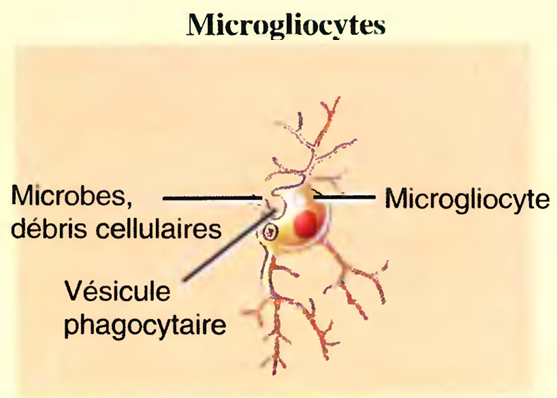
Les microgliocytes (mikros : petit ; glia : glu)
Ce sont de petites cellules phagocytaires dérivées des monocytes qui protègent le SNC contre la maladie en englobant les microbes envahisseurs et en éliminant les débris de cellules mortes.
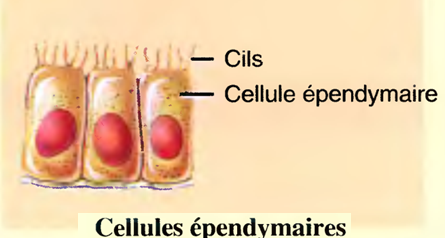
Les cellules épendymaires (epi: sur; enduma: vêtement)
Ont des formes qui varient de pavimenteuses à cylindriques, et plusieurs sont ciliées.
Elles tapissent les ventricules cérébraux (espaces qui forment et font circuler le liquide céphalo-rachidien) et le canal épendymaire.
Dans le SNP se trouvent deux types de cellules gliales ou cellules de soutien :
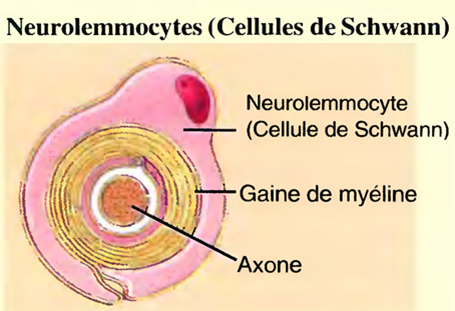
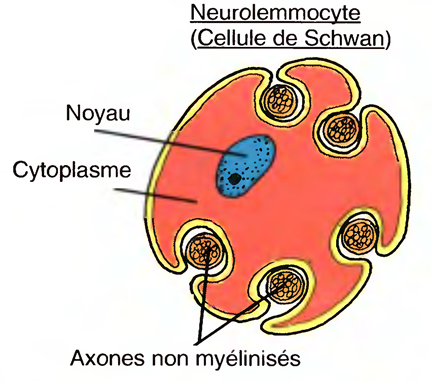
Les cellules de Schwann ou neurolemmocytes ou, qui produisent la gaine de myéline autour des neurones du SNP,
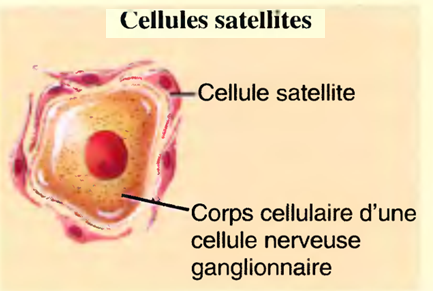
Les cellules satellites, qui soutiennent les neurones dans les ganglions (groupes de corps cellulaires de neurones) de celui-ci.
La myélinisation
La gaine de myéline, revêtement lipidique et protéique, à couches multiples, produit par la névroglie, entoure les axones de presque tous les neurones des mammifères.
Sur le plan électrique, elle isole l'axone d'un neurone et augmente la vitesse de conduction de l'influx nerveux.
Un axone doté ou dépourvu de ce revêtement est dit myélinisé ou non myélinisé.
Toutefois, des micrographies électroniques montrent qu'une fine couche de membrane plasmique névroglique entoure même cette seconde catégorie d'axone
La production de gaines de myéline provient de deux types de cellules gliales : les cellules de schwann et les oligodendrocytes.
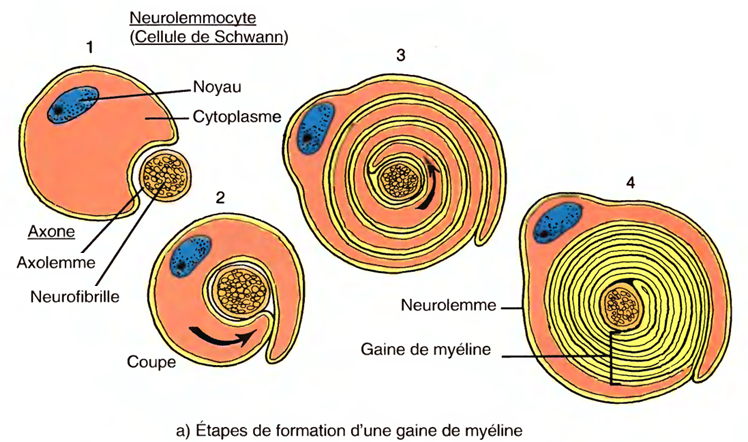
Dans le SNP, les cellules de schwann (cellules de Schwann) forment ces gaines autour des axones, pendant le développement du fœtus et la première année de vie.
Chaque cellule de schwann revêt près d'un millimètre de la longueur d'un axone en s'enroulant de nombreuses fois autour de ce dernier.
Jusqu'à 500 cellules de schwann participent à la formation d'une gaine de myéline autour des axones les plus longs du corps.
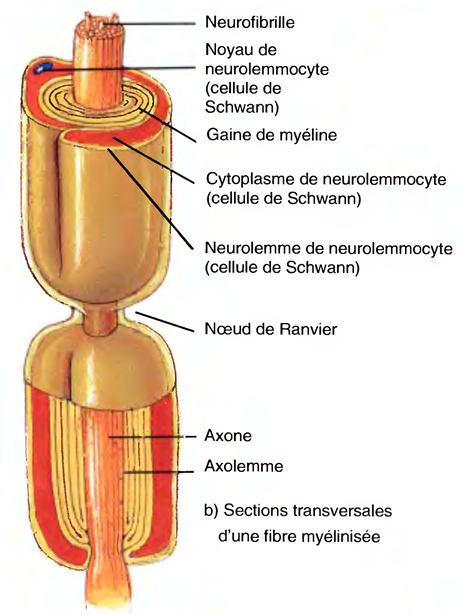
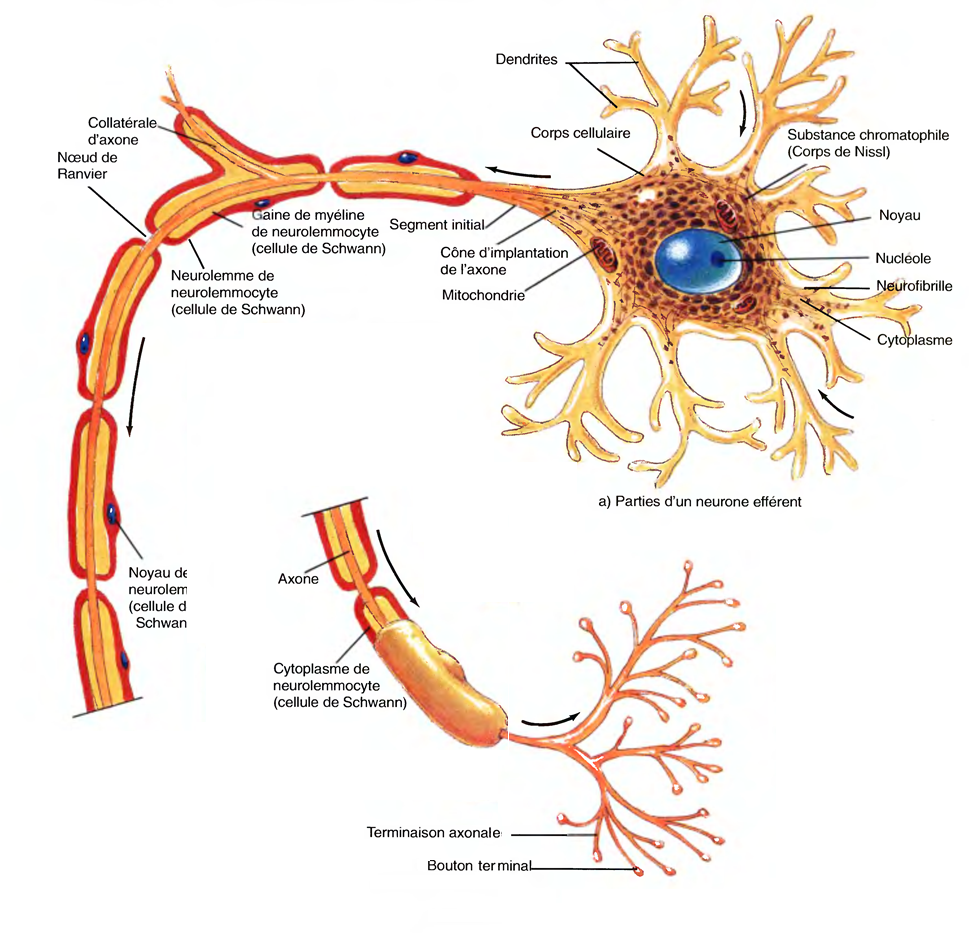
La couche cytoplasmique nucléée externe du neurolemmocyte, qui entoure la gaine de myéline, est appelée neurolemme (gaine de Schwann).
Par intervalles, le long d'un axone, la gaine de myéline présente des brèches appelées nœuds de Ranvier
Dans le SNC, les oligodendrocytes myélinisent de nombreux axones un peu comme les neurolemmocytes myélinisent les axones du SNP.
Les neurones
Certains neurones sont minuscules et transmettent des signaux sur une courte distance (moins de 1 mm) dans le SNC.
D'autres sont les cellules les plus longues du corps.
Ainsi, les neurones moteurs qui commandent à des muscles de remuer un orteil s'étendent depuis la région lombaire de la moelle épinière (juste au-dessus de la taille) jusqu'au pied.
Une synapse est le contact fonctionnel entre deux neurones ou entre un neurone et une cellule effectrice (musculaire ou glandulaire).
Elle est appelée jonction neuromusculaire, entre un neurone moteur et une fibre musculaire, et jonction neuro-glandulaire, entre un neurone et une cellule glandulaire.
Les parties d’un neurone
La plupart des neurones se composent de trois grandes parties: le corps cellulaire, les dendrites et l'axone
Le corps cellulaire (soma ou péricaryon) renferme un noyau entouré de cytoplasme qui comprend des organites types, tels que des lysosomes, des mitochondries et un appareil de Golgi.
Les neurofîbrilles, composées de filaments intermédiaires, forment le cytosquelette qui assure soutien et forme à la cellule.
Les neurones possèdent deux sortes de prolongements : les dendrites et les axones
La dendrite (dendron : arbre) est habituellement courte, effilée et bien ramifiée.
Elle présente souvent un déploiement de prolongements qui a la forme d'un arbre.
Ces derniers émergent du corps cellulaire.
En général, la dendrite est non myélinisée.
L'axone, prolongement long, fin et cylindrique qui peut être myélinisé, s'unit au corps cellulaire au niveau d'une élévation de forme conique, appelée cône d'implantation de l'axone.
La première partie de l'axone est appelée segment initial.
À l'exception des neurones sensitifs, les influx nerveux se produisent à la jonction du cône et du segment initial appelée zone gâchette, puis sont conduits le long de l'axone vers un neurone, une fibre musculaire ou une cellule glandulaire.
Son cytoplasme, l'axoplasme, est entouré d'une membrane plasmique appelée axolemme (lemma: gaine).
Sur la longueur d'un axone, des branches appelées collatérales d'axone peuvent être présentes, en général à angle droit par rapport à l'axone.
L'axone et ses collatérales se terminent en se divisant en de nombreux prolongements minces appelés terminaisons axonales.
Le transport axonal
Le corps cellulaire d'un neurone est le site de la plupart des réactions de synthèse et du recyclage des molécules usées en nouveaux composants.
Toutefois, certaines substances sont nécessaires dans l'axone ou aux terminaisons axonales.
Des systèmes de transport, de 2 sortes, déplacent des particules depuis le corps cellulaire jusqu'à ces terminaisons et vice versa.
Le transport axonal lent
Le transport axonal (flux axoplas-mique) lent, déplace les particules d'environ 1 à 5 mm par jour.
Il véhicule l'axoplasme dans une seule direction, soit depuis le corps cellulaire jusqu'aux terminaisons axonales.
Il fournit du nouvel axoplasme destiné au développement ou à la régénération des axones et renouvelle l'axoplasme dans les axones matures et en croissance.
Le transport axonal rapide déplace les particules à la vitesse approximative de 200 à 400 mm par jour.
Il utilise des «moteurs» moléculaires afin de transporter des particules dans les deux directions, soit en dehors du corps cellulaire et vers celui-ci, le long de la surface des microtubules.
Le transport axonal rapide
Il véhicule divers organites et matériaux qui forment les membranes de l'axolemme, des boutons synaptiques et des vésicules synaptiques.
Des particules qui retournent vers le corps cellulaire sont dégradées ou recyclées, alors que d'autres influent sur la croissance de ce dernier.
D'autres encore, telles que certains virus, peuvent même nuire au corps cellulaire.
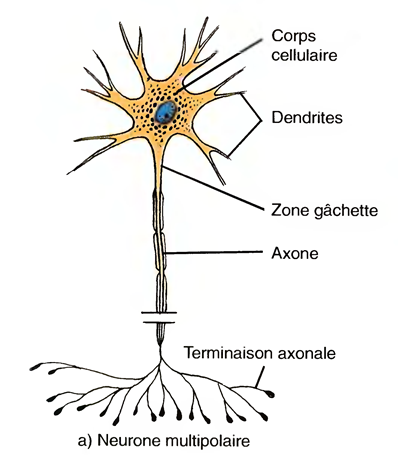
La classification des neurones
Les différents neurones du corps sont classés selon leur structure et leur fonction.
La classification structurale tient compte du nombre de prolongements partant du corps cellulaire.
Les neurones multipolaires
Possèdent généralement un certain nombre de dendrites et un axone . La plupart des neurones dans l'encéphale et dans la moelle épinière sont de ce type.
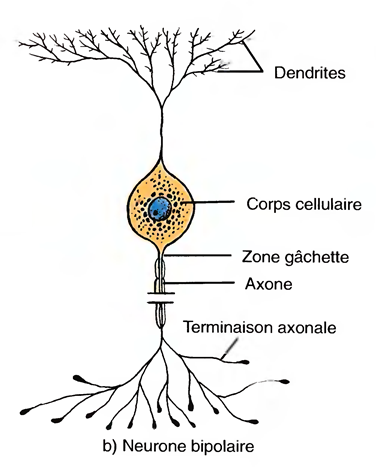
Les neurones bipolaires
Ont une dendrite et un axone.
Ils se trouvent dans la rétine, l'oreille interne et l'aire olfactive de l'encéphale.
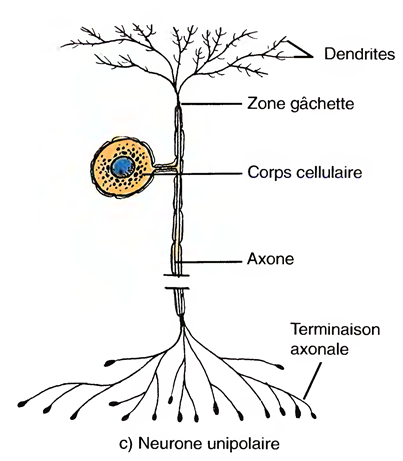
Les neurones unipolaires
(pseudo-unipolaires) sont dotés d'un seul prolongement issu du corps cellulaire.
Ce sont toujours des neurones sensitifs.
La classification fonctionnelle tient compte du sens de propagation de l'influx nerveux.
Les neurones afférents:
transmettent des influx nerveux sensoriels depuis des récepteurs situés dans la peau, les organes des sens, les muscles, les articulations et les viscères jusqu'à l'encéphale et à la moelle épinière.
Les neurones efférents:
véhiculent les influx nerveux moteurs depuis l'encéphale et la moelle épinière jusqu'aux effecteurs, soit les muscles ou les glandes.
Les neurones d'association, ou interneurones:
transmettent les influx nerveux d'un neurone à un autre.
La plupart (90 %) des neurones du corps sont des neurones d'association.
Les nerfs rachidiens et crâniens contiennent des fibres qui relèvent de sept catégories fonctionnelles, soit quatre afférentes et trois efférentes.
La neurophysiologie
La communication par neurones dépend de deux propriétés fondamentales de leur membrane plasmique.
En premier lieu, il existe une tension électrique appelée potentiel de repos membranaire à travers la membrane.
En second lieu, leur membrane plasmique contient divers canaux ioniques (pores) qui peuvent être ouverts ou fermés.
Si ces derniers sont ouverts, des ions spécifiques situés dans le liquide intracellulaire (cytosol) ou extracellulaire peuvent traverser la membrane.
Une partie de la protéine qui forme ce canal peut agir comme une barrière ou comme une porte et s'ouvrir ou se fermer sur demande.
Selon les types de canaux présents, une partie d'un neurone peut produire soit des potentiels gradués soit des potentiels d'action (influx nerveux).
le potentiel de repos membranaire
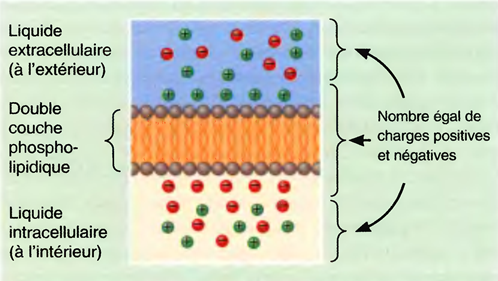
Le potentiel de repos membranaire résulte d'une faible accumulation de charges négatives sur la face interne de la membrane et d'une égale accumulation de charges positives sur la face externe .
Cette séparation de charges électriques positives et négatives constitue une forme d'énergie potentielle mesurée en volts ou en millivolts (1 mV = 1/1000 V).
Plus la différence de charge de part et d'autre de la membrane est importante, plus le potentiel de membrane (la tension) est élevé(e).
Dans les neurones, le potentiel de repos varie entre -40 et -90 mV. La valeur usuelle est de -70 mV.
Le signe moins signifie que la charge est négative à l’intérieur par rapport à l’extérieur.
Une cellule qui présente un potentiel de membrane est dite polarisée.
La plupart des cellules corporelles sont polarisées, et la tension de la membrane varie entre +5 mV et -100 mV dans divers types de cellules.
Le potentiel de repos ressemble au voltage d'une batterie.
Si l'on relie les bornes positive et négative de celle-ci avec un fil métallique, un flux d'électrons passe le long du fil.
Le flux de charge électrique est appelé le courant.
Dans une cellule vivante, les ions plutôt que les électrons transportent la majeure partie du courant.
Vu que la double couche phospholipidique de la membrane plasmique est un bon isolant, les principales voies réservées au flux de courant à travers la membrane se trouvent dans les canaux ioniques.
Donc, lorsque ces derniers s'ouvrent ou se ferment dans la membrane plasmique, un flux de courant se produit, ce qui change le potentiel de membrane.
Il existe deux facteurs principaux qui contribuent au potentiel de repos membranaire.
La répartition d'ions à travers la membrane plasmique. Les principaux anions et cations sont différents à l'extérieur et à l'intérieur de la cellule. Le liquide extracellulaire est riche en Na+ et en CL-. En revanche, dans le liquide intracellulaire, le principal cation est K+ et les deux anions dominants sont les phosphates organiques et les acides aminés dans les protéines.
La perméabilité relative de la membrane plasmique au Na+ et au K+. La perméabilité de la membrane plasmique au K+ est de 50 à 100 fois supérieure à celle du Na+ dans un neurone ou une fibre musculaire, au repos.
Les canaux ioniques
Il existe deux principaux types de canaux ioniques ;
Les canaux de fuite sont toujours ouverts,
Alors que les canaux à ouverture périodique s'ouvrent et se ferment en réaction à une certaine sorte de stimulus.
Vu que la membrane plasmique d'un neurone ou d'une fibre musculaire possède plus de canaux de fuite K+ que de canaux de fuite Na+, la perméabilité de la membrane au K+ est plus élevée.
4 catégories de stimuli font actionner les canaux ioniques à ouverture périodique :
la tension,
les produits chimiques,
la pression mécanique
et la lumière.
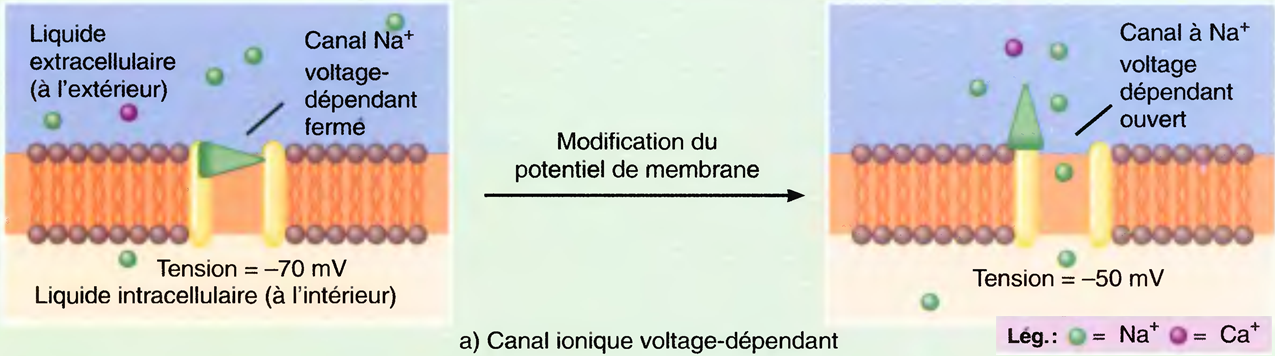
Le premier type de canal ionique à ouverture périodique, appelé canal ionique voltage-dépendant (réglé par la tension), s'ouvre en réaction à une modification directe du potentiel (de la tension) de la membrane.
La présence de ces canaux dans les membranes plasmiques des nerfs et des muscles donne à ces cellules la propriété d'excitabilité (d'irritabilité), c'est-à-dire la possibilité de réagir à certains stimuli par la production d'influx nerveux.
La zone gâchette d'un neurone donné se trouve là où, sur la membrane, les canaux voltage-dépendants sont plus abondamment groupés.
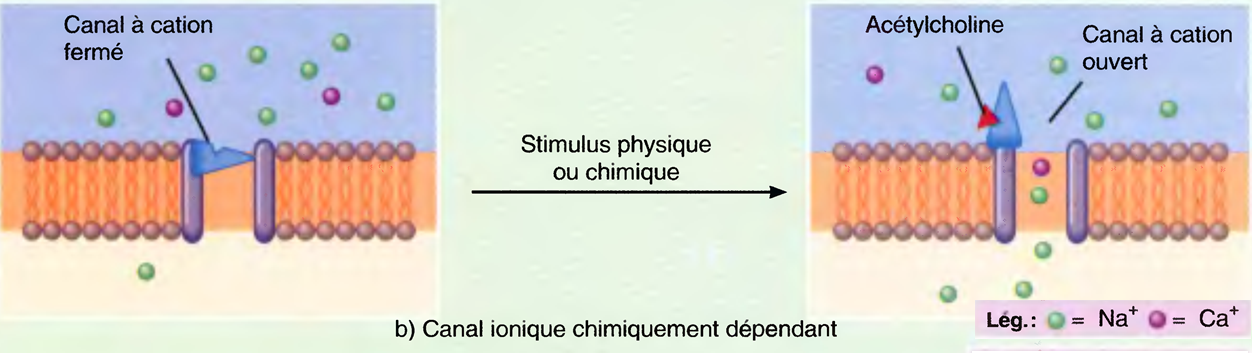
Les canaux ioniques chimiquement dépendants s'ouvrent et se ferment, en réaction à un certain stimulus chimique.
Une grande diversité de ligands chimiques, tels que les neurotransmetteurs, les hormones et les ions tels que H+ et Ca2+, règlent ces canaux.
Ainsi, le neurotransmetteur qu'est l'acétylcholine ouvre les canaux à cation qui font passer Na+, K+ et Ca+.
Les canaux ioniques chimiquement dépendants fonctionnent de deux façons principales.
Le produit chimique peut directement modifier la perméabilité de la membrane à un ou à plus d'un ion, comme dans l'exemple de l'acétylcholine.
Autrement, il peut agir indirectement par l'intermédiaire aussi bien d'un type de protéine de la membrane appelé protéine G que d'un système de second messager qui utilise des molécules contenues dans le cytosol.
Les hormones, de même que certains neurotransmetteurs, fonctionnent souvent par systèmes de seconds messagers.
Potentiel d'action (influx nerveux) dans un neurone
Les canaux ioniques mécaniquement dépendants s'ouvrent ou se ferment, en réaction à une pression ou à une vibration mécanique telle que le toucher ou des ondes sonores.
Finalement, les canaux ioniques réglés par la lumière se ferment en réaction à la lumière.
Ces deux types de canaux se trouvent dans les récepteurs sensoriels qui décèlent les distorsions mécaniques ou la lumière.
La présence de canaux ioniques réglés chimiquement, mécaniquement ou par la lumière dans une membrane permet au stimulus approprié de provoquer la formation d'un potentiel gradué.
Ces réactions électriques varient en importance.
Elles sont plus grandes ou plus petites selon aussi bien le nombre de canaux ioniques à ouverture périodique qui se sont ouverts que leur durée d'ouverture.
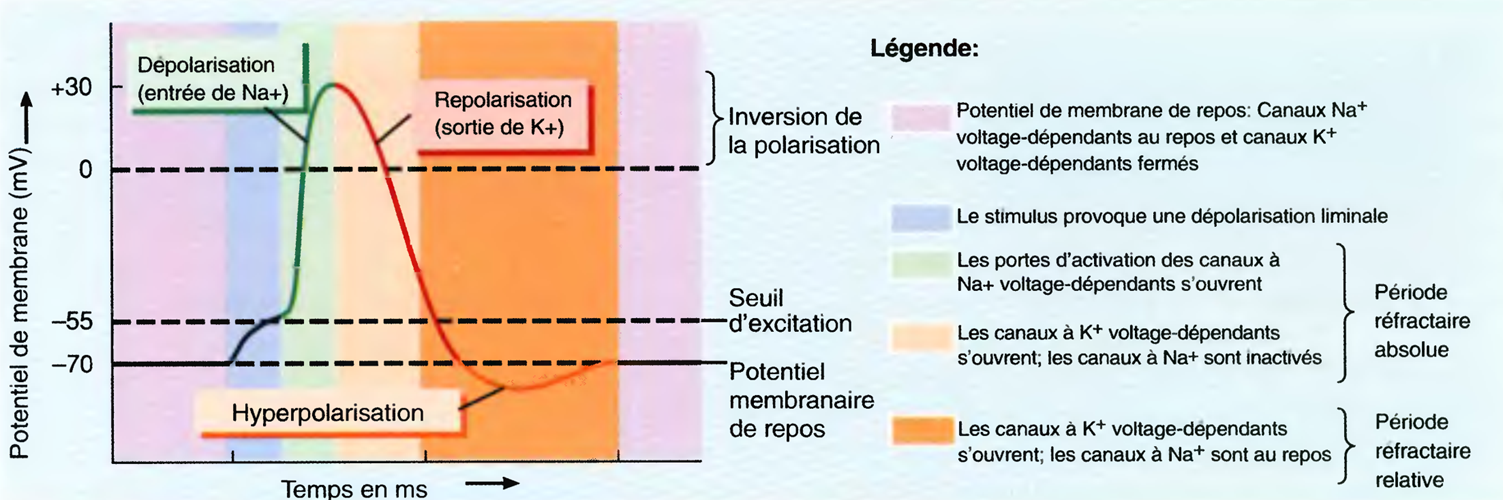
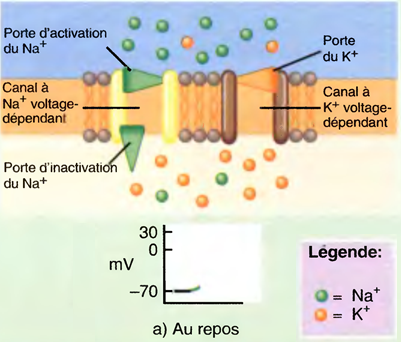
Modifications constatées dans les canaux voltage-dépendants pendant la dépolarisation et la repolarisation du potentiel d'action
a) Au repos: les canaux à Na+ voltage-dépendants et les canaux à K+ voltage-dépendants sont respectivement au repos et fermés,
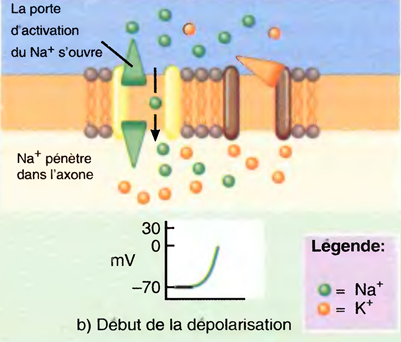
b) La dépolarisation jusqu'au seuil (près de -55mV) ouvre les portes d'activation du canal à Na+. L'entrée de Na+ dépolarise davantage la membrane jusqu'à ce que cette dernière ait sa polarité inversée (l'intérieur devient plus positif que l'extérieur),
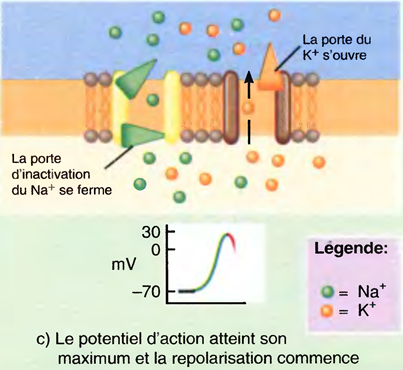
c) Plus lentement, la dépolarisation ouvre aussi les canaux à K+ voltage-dépendants, ce qui permet la sortie (l'expulsion) de K+. Au même moment, les portes d'inactivation du canal à Na+ se ferment.
La repolarisation commence.
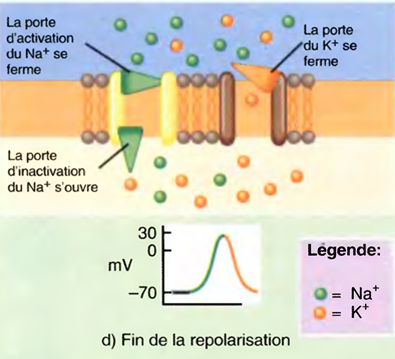
d) La sortie de K+ restaure le potentiel de repos. Les canaux de fuite et les pompes Na+/K+ qui maintiennent une faible concentration de Na+ à l'intérieur de la cellule ne sont pas indiqués dans cette figure où, en revanche, les nombres respectifs de Na+ qui entrent et de K+ qui sortent pendant un seul potentiel d'action ont été majorés
La transmission aux synapses
Les synapses permettent d'intégrer et de filtrer l'information.
Certains signaux sont transmis, alors que d'autres sont bloqués.
Certaines maladies cérébrales et de nombreuses maladies mentales découlent d'une interruption de la communication synaptique.
C'est aussi aux synapses qu'agissent de nombreux médicaments qui affectent l'encéphale.
Ces derniers comprennent les substances thérapeutiques et les drogues.
Il existe deux types de synapses:
électriques
chimiques,
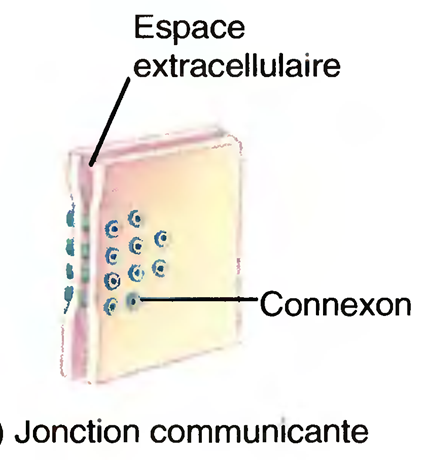
Les synapses électriques
Dans une synapse électrique, le courant ionique passe directement d'une cellule à une autre, à travers les jonctions lacunaires.
Chacune de ces dernières contient près d'une centaine de structures protéiques tubulaires appelées connexons qui forment des tunnels destinés à relier le cytosol des deux cellules ; le flux de courant ionique emprunte cette voie.
Les synapses électriques comportent deux avantages :
Elles permettent la communication plus rapidement que les synapses chimiques, vu que les influx traversent les jonctions lacunaires,
Elles peuvent synchroniser l'activité d'un groupe de neurones ou de fibres musculaires. L'utilité des potentiels d'action synchronisés dans le muscle lisse cardiaque ou viscéral est de produire la contraction coordonnée de ces fibres. Dans le SNC, le rôle des synapses électriques reste encore à découvrir.
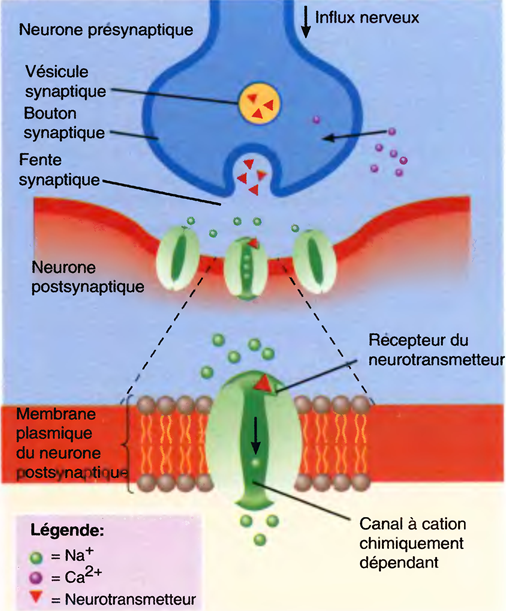
Les synapses chimiques
Même si les neurones présynaptiques et postsynaptiques d'une synapse chimique sont proches, leurs membranes ne se touchent pas.
Ces dernières sont séparées par la fente synaptique, un espace de 20- à 50-nm rempli de liquide extracellulaire.
Même si les neurones présynaptiques et postsynaptiques d'une synapse chimique sont proches, leurs membranes ne se touchent pas.
Ces dernières sont séparées par la fente synaptique, un espace de 20- à 50-nm rempli de liquide extracellulaire
Les neurotransmetteurs de l'encéphale
L'encéphale contient environ 50 substances qui sont reconnues comme neurotransmetteurs ou qui pourraient l'être.
Cette liste s'allonge chaque année, alors que de nouvelles techniques cytologiques confirment la présence d'une gamme importante de neurotransmetteurs probables.
L'acétylcholine (ACh).
Selon la nature des récepteurs postsynaptiques,
l'ACh peut avoir un effet excitateur ou inhibiteur dans l'encéphale.
Les acides aminés.
Les acides aminés glutamate et aspartate sont des neurotransmetteurs excitateurs de l'encéphale.
L'acide gamma-aminobutyrique (GABA) est le neurotransmetteur inhibiteur le plus répandu de l'encéphale.
Les aminés biogènes.
Certains acides aminés sont modifiés et décarboxylés (élimination du groupement carboxyle) afin de produire des aminés biogènes.
Parmi ceux-ci, dans l'encéphale, on trouve la noradrénaline, l'adrénaline, la dopamine, la sérotonine, et l'histamine.
Selon le type de récepteur (il en existe trois différents types ou plus pour chaque aminé), ils peuvent provoquer un effet excitateur ou inhibiteur.
Les neuropeptides.
Le groupe le plus important de neurotransmetteurs et de neuromodulateurs sont les neuropeptides.
Ces derniers sont formés d'une chaîne de 2 à 40 acides aminés et ont des effets inhibiteurs et excitateurs.
Les neuropeptides sont formés dans les corps cellulaires, emballés dans des vésicules et transportés vers les terminaisons axonales.
•Exemple: Enképhalines, Endorphines, Dynorphines, la substance P (douleur)
c) Physiologie & Physiopathologie de la douleur
I. Introduction-Définition :
La perception de la douleur émerge d’un système sensoriel chargé d’une fonction spécifique (la conservation de l’intégrité corporelle), organisé selon une architecture habituelle et opérant selon un mode commun aux systèmes sensoriels.
Les stimuli nociceptifs ont en commun de menacer l’intégrité du corps et d’activer un ensemble de récepteurs sensoriels : les nocicepteurs.
Au sein des systèmes sensoriels, on reconnaît une fonction spécifique à la nociception dans la mesure où elle peut être considérée comme un système d’alarme qui protège l’organisme : elle déclenche des réponses réflexes et comportementales dont la finalité est d’en supprimer la cause et par conséquent d’en limiter les conséquences.
La douleur est une manifestation totalement subjective, et sa définition est de ce fait difficile.
L’Association internationale pour l’étude de la douleur (IASP) a proposé en 1979 la définition suivante :
« La douleur est une expérience sensorielle et émotionnelle désagréable, associée à une lésion tissulaire réelle ou potentielle, ou décrite dans des termes impliquant une telle lésion ».
Ainsi, même si généralement la douleur est secondaire à une cause physique évidente, cette définition évite de lier étroitement la douleur à son seul stimulus nocif causal.
Elle souligne également l’intrication étroite existant entre l’organicité d’une douleur et ses conséquences émotionnelles et affectives sur les réactions individuelles de chaque patient.
La même agression, provoquant la même lésion anatomique apparente, peut entraîner des sensations et des conséquences fonctionnelles tout à fait différentes voire opposées chez deux patients distincts.
Par ailleurs, un même individu ne réagit pas toujours de manière univoque à la douleur : Son seuil de tolérance à la douleur peut varier en fonction des circonstances de sa vie. Ainsi, il peut par exemple développer une résistance exceptionnelle dans des conditions extrêmes (blessure de guerre…)
Il est actuellement parfaitement admis qu’une douleur chronique a une double dimension : sensorielle et psychologique.
La dimension sensorielle représente la composante neurologique à l’origine de la sensation douloureuse. « Le cerveau possède ainsi une fonction discriminative lui permettant de distinguer avec la plus grande précision l’intensité de la douleur, la nature de l’agression, sa durée et sa localisation. »
La dimension psychologique est quant à elle une véritable variante individuelle. Elle représente la réponse affective-émotionnelle, cognitive ou comportementale à une agression douloureuse.
II. Les voies de transmission et de perception de la douleur :
1. Au niveau du système nerveux périphérique (SNP)
1.1. Les récepteurs périphériques de la douleur ou « nocicepteurs »
Il est généralement admis qu’il n’existe pas de structure spécifique histologiquement individualisée, pour capter la douleur.
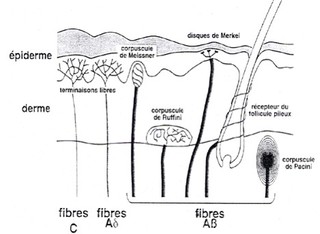
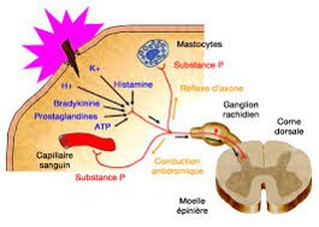
Les messages nociceptifs sont générés au niveau des terminaisons libres des fibres nerveuses, constituant des arborisations plexiformes dans les tissus cutanés, musculaires, articulaires ainsi que dans les parois des viscères (Fig 1).
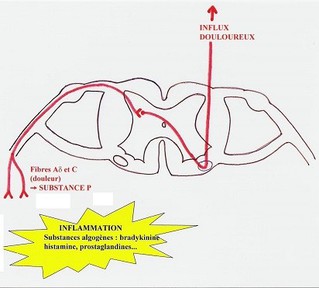
Les messages nociceptifs sont ensuite véhiculés dans les nerfs par différentes fibres, classées en fibres myélinisées et non myélinisées.
Les fibres Aδ (peu myélinisées) et C (non myélinisées), responsables des sensations thermo-algiques, sont connectées à des terminaisons libres appelées « nocicepteurs ».
Les fibres Aαβ (très myélinisées), responsables des sensations tactiles, sont connectées à des récepteurs bien différenciés sur le plan histologique (corpuscules de Meissner, de Ruffini, disques de Merkel, récepteurs du follicule pileux).*
Les nocicepteurs cutanés ont été les mieux décrits chez l’homme, on en distingue 2 types présents au niveau de la peau glabre ainsi que dans les zones poilues :
Des nocicepteurs unimodaux qui ne sont activés que par des stimulations mécaniques intenses : ce sont des mécanonocicepteurs électivement en relation avec les fibres Aδ.
Des nocicepteurs polymodaux de loin les plus nombreux qui répondent non seulement aux modalités précédentes de stimulation physique mécanique mais également à des stimulations de nature thermique ou chimique (chimiorécepteurs).
La répétition d’un stimulus provoque une sensibilisation des récepteurs entraînant un abaissement de leur seuil et une amplification de leurs réponses. Ils sont associés principalement aux fibres C.
Des travaux récents ont mis en évidence la présence de nocicepteurs polymodaux, dans la peau, les viscères et les articulations dits «silencieux», car ils ne peuvent pas être activés dans les conditions normales, mais le sont dans des conditions pathologiques, en particulier lors des processus inflammatoires chroniques.
La densité de l’innervation cutanée compte en moyenne un minimum de 6000 terminaisons libres par cm2.
Variable d’un territoire à un autre, la répartition des nocicepteurs est relativement homogène au niveau cutané, ce qui permet de localiser sans difficulté aussi bien la douleur que les autres sensations somesthésiques.
En résumé :
Les récepteurs
Des détecteurs spécifiques reliés à des fibres nerveuses, appelées « neurones primaires » ou « afférences primaires », dont le corps cellulaire se trouvent dans les ganglions rachidiensIls détectent quoi ? :
douleur (nocicepteurs), toucher (tactiles), chaud/froid (thermiques), pression, mouvement (proprioceptives)
Ils sont où ? :
peau +++, os, articulations, muscles, tendons, ...viscères
1.2. Les stimuli nociceptifs
Le système nociceptif peut-être activé par une grande variété de formes d’énergie (mécanique, thermique, chimique…) dont le caractère commun semble à priori de forte intensité, capable de provoquer une réelle lésion tissulaire.
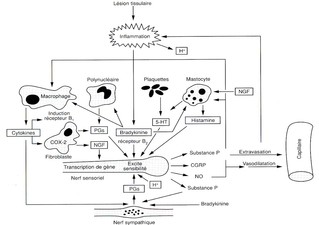
La lésion tissulaire provoquée est responsable d’une série d’évènements étroitement liés aux processus inflammatoires venant prolonger l’activation des nocicepteurs et surtout induire une sensibilisation (Fig 2).
Fig 2: intéractions entre les différentes substances libérées par les cellules immunitaires, les capillaires sanguins et les terminaisons nerveuses périphériques (sensorielles et sympathiques) lors d’une lésion tissulaire inflammatoire.
Les mécanismes de la genèse des messages nociceptifs ne sont pas élucidés entièrement. Néanmoins, il est bien établi que de nombreuses substances chimiques (bradykinine, histamine, sérotonine, prostaglandines, ions hydrogènes) sont libérés lors des lésions tissulaires par les cellules sanguines (plaquettes, polynucléaires, lymphocytes, macrophages, mastocytes)
Par ailleurs, des neuropeptides tels la substance P et le peptide lié au gène de la calcitonine (CGRP) contenus dans certaines cellules des ganglions spinaux peuvent être libérés au niveau périphérique par le classique réflexe d’axone.
Les mécanismes de la genèse des messages nociceptifs ne sont pas élucidés entièrement. Néanmoins, il est bien établi que de nombreuses substances chimiques (bradykinine, histamine, sérotonine, prostaglandines, ions hydrogènes) sont libérés lors des lésions tissulaires par les cellules sanguines (plaquettes, polynucléaires, lymphocytes, macrophages, mastocytes). Par ailleurs, des neuropeptides tels la substance P et le peptide lié au gène de la calcitonine (CGRP) contenus dans certaines cellules des ganglions spinaux peuvent être libérés au niveau périphérique par le classique réflexe d’axone.
En dehors de ces substances qui pour la plupart sont libérées assez précocement lors de l’installation d’une lésion, d’autres facteurs tels les cytokines (interleukines, interféron, facteur de nécrose tumorale (TNF), facteurs de croissance neuronale (NGF) sont libérés par les phagocytes ou les cellules du système immunitaire, surtout lorsqu’il s’agit d’un processus persistant.
Ainsi il apparaît que toute une myriade de substances chimiques très diverses dite « soupe périphérique » interagissant entre elles, puisse moduler l’activité des nocicepteurs rendant les approches pharmacologiques complexes.
1.3. Les fibres nerveuses afférentes primaires et les nerfs périphériques sensitifs
La fibre nerveuse est en fait le prolongement périphérique ou axone du premier neurone ou « protoneurone » dont le corps cellulaire est situé dans le ganglion spinal ou le ganglion trigéminal de Gasser.
Les fibres sensitives ne sont pas uniformes ; elles propagent le signal sensoriel à des vitesses de conduction différentes, proportionnelles à leur diamètre et à l’épaisseur de leur gaine de myéline (Tableau 1).
Les premières études physiologiques effectuées chez l’homme ont montré que la sensation douloureuse résultait de la mise en jeu de fibres à conduction lente : les fibres Aδ faiblement myélinisées et les fibres C, non myélinisées….. Les fibres C sont les plus nombreuses puisqu’elles constituent 60 à 90% de l’ensemble des fibres afférentes cutanées et la quasi totalité des fibres afférentes viscérales.
Types de fibres
Aβ
AδC
Diamètre (microns)
5-15 μm
1-5 μm
0.3-1.5 μm
Gaine de myéline
+++++-
Vitesse de conduction (m/s)
40-100 m/s
5-40 m/s
1-2 m/s
Récepteurs périphériques
Spécialisés, ncapsulés
Mécanonocicepteurs
Terminaisons libres
Nocicepteurs polymodaux
Terminaisons libres
Stimulus spécifique
Pression légère
Pression Forte
Pression forte
T° > 45°C
Chimique
Sensation produite
Tact, ProprioceptionDouleur RapideDouleur Lente
L’existence de ces deux groupes de fibres afférentes fines a permis de mieux comprendre le phénomène de double douleur parfois ressenti lors de l’application de stimulations cutanées brèves et intenses.
L’activation des fibres Aδ produirait une douleur rapide (300 ms après le stimulus) bien localisée et à type de piqûre déclenchant immédiatement un réflexe protecteur de retrait.
Les fibres C seraient responsables d’une douleur tardive (1 sec après le stimulus), mal localisée plus diffuse et à type de brûlure traduisant une lésion tissulaire persistante (Tableau 2).
Douleur rapide
Douleur lente
Caractéristique clinique
Vive, à type de piqûre, bien localisée, instantanée
Sourde, diffuse, à type de brulure, installation lente
Evolution
Durée brève, pas de tonalité affective
Durée prolongée, réaction affective et végétative
Fibre nerveuse
Fibres sensitives Aδ
Fibres sensitives C
D’autre part, le fait que les fibres sensitives transmettant la sensation tactile fine soient protégées par une épaisse gaine de myéline, alors que les fibres sensitives nociceptives (Aδ et C) ne le sont pas, a des conséquences pratiques largement utilisées en clinique.
Il est possible de réaliser des lésions nerveuses périphériques incomplètes et sélectives détruisant les seules fibres fines nociceptives et de ce fait, de respecter la sensibilité tactile dans le territoire nerveux considéré.
L’application principale de ce concept est représentée par la thermocoagulation (lésion thermique) du ganglion trigéminal de Gasser dans le traitement des névralgies faciales essentielles.
1.4. Un cas particulier : la douleur viscérale
La douleur viscérale diffère par beaucoup d’aspects physiologiques de la douleur cutanée.
Elle n’a pas de signification claire en terme de valeur adaptative ou protectrice comme cette dernière qui a valeur d’alerte et permet une conduite adaptée.
Dans les viscères, les nocicepteurs réagissent parfois à des situations non pathologiques comme la distension alors qu’à l’inverse des envahissements destructeurs ou des perforations d’organes creux peuvent être indolores.
L’absence ou le peu de représentation somatotopique cérébrale des viscères explique que cette douleur soit mal localisée et diffuse donnant lieu au phénomène de douleur projetée cutanée parfois très à distance, piège classique de la médecine d’urgence.
Certaines douleurs survivent à l’ablation de l’organe en cause : ce sont des douleurs « fantômes » générées au niveau du système nerveux central. Elles sont bien connues après amputation des membres, mais peuvent aussi se voir après ablation des viscères (cystectomie, mammectomie…).
Les « douleurs projetées » sont rapportées par « erreur », lors de l’analyse corticale, au métamère cutané (le plus largement représenté) alors que l’origine réelle est viscérale, articulaire ou musculaire
exemples
douleur du MSG de l’angine de poitrine
douleur testiculaire de la colique néphrétique
douleur scapulaire droite de la colique hépatique ...
2. Au niveau du système nerveux central
2.1. La jonction radiculo-médullaire
Après avoir emprunté le nerf périphérique puis pour certains un plexus, l’influx nociceptif se dirige vers le nerf spinal.
Toutes les fibres périphériques afférentes (dendrites du 1er neurone) possèdent un corps cellulaire au niveau du ganglion spinal situé sur la racine spinale dorsale.
Dans la majorité des cas, les afférences du système nerveux central gagnent la moelle spinale par les racines dorsales ou leurs équivalents au niveau des nerfs crâniens.
Il a été cependant récemment démontré chez l’homme que certaines fibres afférentes empruntent la racine ventrale qui contient classiquement les fibres efférentes motrices.
Les différents types de fibres sensitives n’ont aucune organisation particulière au sein des nerfs périphériques et des racines dorsales.
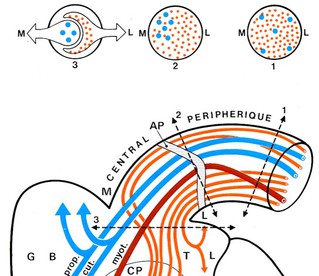
Au niveau de la jonction radiculo-médullaire zone d’entrée de la racine dorsale dans la moelle, elles s’organisent en fonction de leur type et de leur destinée médullaire (Fig 4).
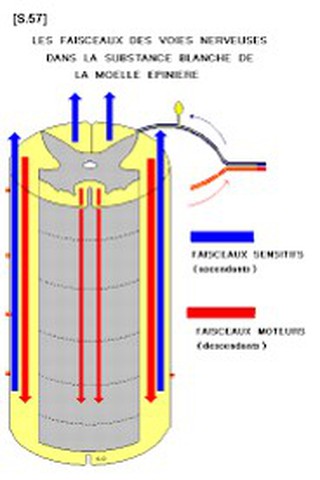
Ainsi les fibres de gros calibre myélinisées (Aβ) destinées au cordon dorsal homolatéral et transportant des informations tactiles superficielles et proprioceptives conscientes (voie lemniscale) se placent dans la partie dorso-médiane de cette région.
Les fibres fines nociceptives (Aδ et C) se placent dans la région ventro-latérale de cette zone d’entrée.
Cette dissociation anatomique des fibres est à l’origine d’une intervention neurochirurgicale d’interruption des voies de la douleur au niveau de la jonction radiculo-médullaire décrite en 1972 par le Pr Sindou, neurochirurgien Lyonnais. C’est la radicellotomie postérieure sélective ayant pour objectif de sectionner par technique microchirurgicale les petites fibres véhiculant la nociception à leur entrée dans la moele épinière.
Il est possible a ce niveau par des techniques microchirurgicales d’interrompre sélectivement les voies de la douleur en respectant les fibres de la sensibilité.
Fig : Organisation des fibres au niveau de la jonction radiculomédullaire postérieure. ….. Site de la radicellotomie postérieure sélective d’après M Sindou.
Chaque radicelle est formée d’un segment périphérique dont la glie est schwanienne (comme le nerf périphérique) et d’un segment central dont la glie est oligodendrocytaire (comme la moelle). La jonction entre les deux se fait au niveau de l’anneau pial (AP).
Au niveau du segment périphérique (1) les fibres n’ont aucune systématisation particulière en fonction de leur taille.
Au niveau de l’anneau pial les petites fibres gagnent la surface de la radicelle, un petit nombre sur son bord médian (M), la plupart sur son bord latéral (L) tandis que les grosses fibres cheminent en son centre.
Au niveau du segment central (3), les petites fibres qu’elles soient latérales ou médianes se regroupent à la partie latérale de la jonction radiculo-médullaire avant de pénétrer dans le tractus de Lissauer (TL) puis la corne postérieure dela moelle (CP).
Les fibres nociceptives ne se destinent pas à un seul étage spinal (myélomère).
En effet, chaque fibre se trifurque, donnant des branches pour le niveau correspondant à son métamère et des branches ascendantes et descendantes qui vont parcourir le tractus dorsolatéral de Lissauer.
Ceci a pour conséquence une diffusion de l’information aux étages métamériques adjacents permettant notamment l’élaboration de réflexes spinaux plurisegmentaires.
A noter qu’il existe aussi un mécanisme de diffusion de l’information périphérique, lié au phénomène de recouvrement des dermatomes (territoires cutanés dépendant d’un métamère).
Une stimulation nociceptive cutanée peut-être ainsi véhiculée par trois racines spinales jusqu’aux métamères correspondants puis également subir un phénomène de diffusion central par le tractus de Lissauer.
2.2. Les neurones spinaux
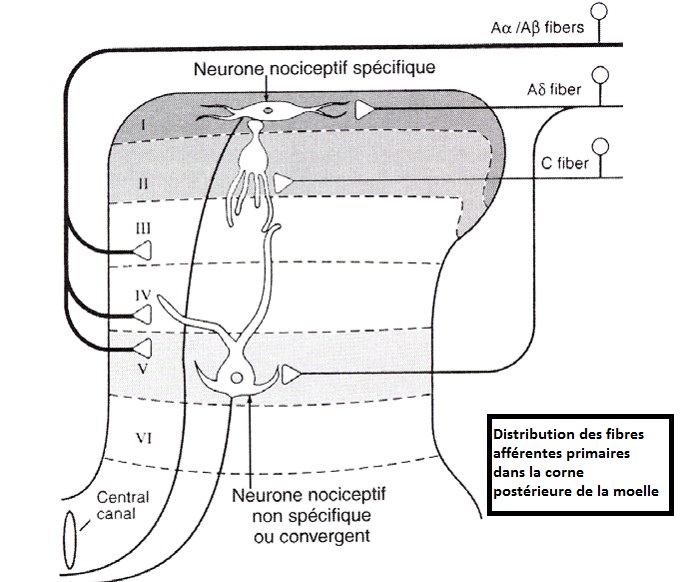
La terminaison de l’axone du protoneurone se fait au niveau de la substance grise spinale (Fig 5).
Selon la nomenclature de Rexed, la substance grise a été divisée en dix couches, les 5 premières correspondent à la corne postérieure, les couches VI et VII à la zone intermédiaire, les couches VIII et IX à la corne antérieure et la couche X à la zone périépendymaire. « La couche I est également dénommée zone marginale, la couche II substance gélatineuse. »
Les fibres myélinisées Aαβ se divisent en deux contingents :
le premier emprunte les cordons postérieurs pour atteindre les noyaux de Gracile et cunéiforme où ils activent des neurones du système lemniscal responsable des sensibilités tactiles et proprioceptives.
le second bifurque pour entrer dans la substance grise médullaire et se terminer dans les couches III, IV.
Les fibres myélinisées de petit diamètre Aδ et non myélinisées C se projettent sur les couches I et II (substance gélatineuse de Rolando) de l’apex de la corne dorsale spinale.
Ces synapses s’établissent avec deux types de deutoneurones (2ème neurone de la voie nociceptive):
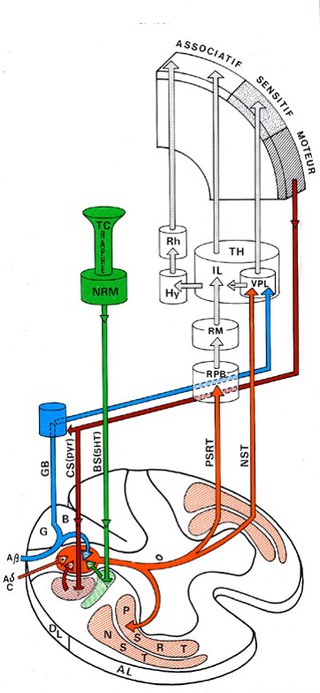
2.3. Les voies spinales ascendantes
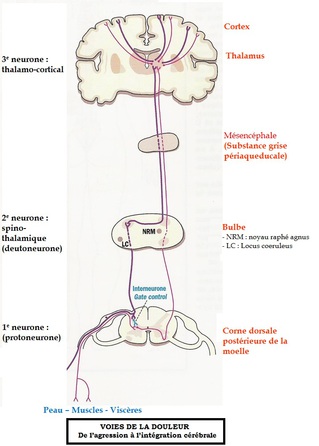
Les neurones nociceptifs médullaires spécifiques ou non spécifiques vont projeter leurs informations au neurone thalamique (3ème neurone de la voie nociceptive) par l’intermédiaire de leurs axones regroupés en faisceaux nerveux ascendants.
Après avoir croisé la ligne médiane (décussation) au niveau de la commissure grise ventrale, les axones des neurones nociceptifs de l’apex de la corne dorsale se dirigent vers le cordon ventro-latéral de l’hemi-moelle controlatérale pour former le faisceau spinothalamique (Fig 9).
La conséquence fonctionnelle de ce croisement anatomique est que le cerveau droit reçoit et perçoit les informations douloureuses provenant de l’hémicorps gauche et inversement.
Ce faisceau transmet essentiellement des influx résultant de l’activation de nocicepteurs somatiques et viscéraux, et de récepteurs au chaud et au froid.
Références
Pr : A. Guendouz (Physiologie clinique & Explorations fonctionnelles cardio-respiratoires et de l’exercice)
b) Physiologie & Phsiopathologie du sommeil
Le Sommeil Physiologique
Introduction
Définition sommeil :
Dictionnaire médical- 2009 Elsevier Masson : État physiologique actif de restauration caractérisé par la suspension, périodique et réversible de la conscience et de la vie de relation et répondant à un besoin de repos de l’organisme.
Dictionnaire Larousse: État physiologique périodique de l'organisme (notamment du système nerveux) pendant lequel la vigilance est suspendue et la réactivité aux stimulations amoindrie.
Il existe un continuum entre les différents niveaux de vigilance, oscillant grossièrement entre la veille, le sommeil à ondes lentes et le sommeil paradoxal.
À chacun de ces états de vigilance correspond un certain niveau d’activité des structures corticales, lequel peut être étudié par l’EEG.
Il est important de préciser le rôle important du thalamus dans la genèse des ondes corticales.
En effet, l’enregistrement simultané de l’activité électrique d’un noyau thalamique et de celle de l’EEG de l’aire corticale de projection de ce noyau révèle le synchronisme de ces deux activités.
Les effets des différentes structures du système nerveux central sur l’état de vigilance s’exercent donc, dans une large mesure, directement ou indirectement en modulant la rythmicité des interactions entre le thalamus et le cortex.
Globalement, le tracé EEG est d’autant plus rapide et désynchronisé que le niveau de vigilance est élevé .
À l’inverse, lors du sommeil lent, il est d’autant plus synchronisé que le sommeil est profond.
Ce synchronisme cortical est le reflet du fonctionnement du “pacemaker” thalamique qui n’apparaît que lorsque le noyau réticulaire du thalamus n’est plus soumis à l’action, directe ou indirecte par la formation réticulée, des afférences sensitives et sensorielles.
Structure du sommeil
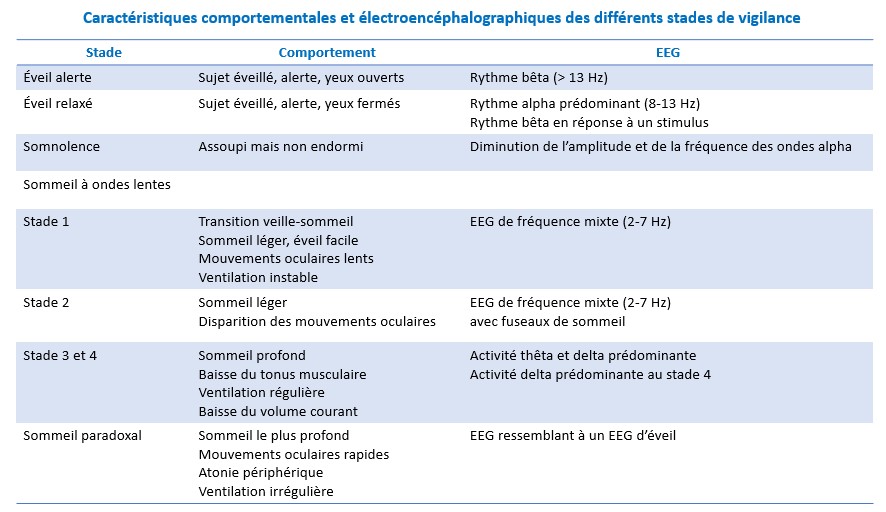
Une classification précise du sommeil en différents stades a été élaborée en 1968 par Rechtschaffen et Kales.
Elle repose à la fois sur des données EEG , EMG et EOG (électro-oculographiques) et subdivise le sommeil en
sommeil à ondes lentes (comprenant lui-même 4 stades)
et en sommeil paradoxal
NB: Important à assimiler pour bien comprendre les bases du BIS
Sommeil à ondes lentes
Stade 1
Il s’agit d’un stade de transition veille-sommeil, caractérisé par une activité EEG de fréquence mixte (de 2 à 7 Hz) et de bas voltage. D’un point de vue comportemental, il existe, lors de la transition veille-sommeil, des mouvements oculaires lents signant une perte de contrôle volontaire de ces mouvements.
Stade 2
Ce stade est caractérisé par une nouvelle diminution de la fréquence des ondes EEG, par une augmentation de leur amplitude et par l’apparition périodique de bouffées d’ondes de haute fréquence (de 12 à 14 Hz) durant de 1 à 2 secondes appelées « fuseaux de sommeil ».
Ce stade est un stade de sommeil léger.
Stade 3
Il est défini par la présence d’ondes lentes delta (≤ 2 Hz) de grande amplitude. C’est un stade de sommeil profond.
Stade 4
Il est défini par la présence d’au moins 50 % d’ondes lentes delta. C’est le stade de sommeil le plus profond.
Les stades 3 et 4 sont souvent cotés ensembles en tant que sommeil lent profond (slow wave sleep des Anglo-Saxons).
Sommeil paradoxal
Après une période de sommeil à ondes lentes, l’EEG se modifie de façon radicale pour ressembler à un EEG de veille, traduisant le passage en sommeil paradoxal (ou REM-sleep pour rapid eye movement).
Il est défini par l’apparition concomitante d’une activité EEG de bas voltage et de fréquence mixte (de 2 à 7 Hz), de bouffées de mouvements oculaires rapides et d’une atonie musculaire.
L’EEG comprend également des ondes thêta pointues (ondes en « dents de scie ») et des séquences de rythme alpha (de 8 à 12 Hz).
Répartition temporelle des différents stades de sommeil
Un cycle de sommeil correspond à la succession d’une période de sommeil lent et d’une période de sommeil paradoxal.
La durée de ce cycle est de 60 à 90 minutes et une nuit de sommeil comprend 5 ou 6 cycles successifs.
Le sujet entre d’abord dans le stade 1 du sommeil à ondes lentes pendant quelques minutes, puis lui succède le stade 2 pendant 10 à 25 minutes. Les stades 3 et 4 suivent ensuite pour une durée de 20 à 40 minutes.
Le premier épisode de sommeil paradoxal survient alors pour une courte durée (entre 4 et 8 minutes), éventuellement précédé d’un bref retour au stade 2. Un nouveau cycle de sommeil commence ensuite.
La durée des différents stades de sommeil au sein d’un cycle de sommeil se modifie au cours de la nuit.
Ainsi, le sommeil lent profond (stades 3 et 4) se situe essentiellement pendant la première partie de la nuit, tandis que les derniers cycles sont plus riches en sommeil paradoxal.
Au total, le sommeil à ondes lentes représente de 75 à 80 % de la durée du sommeil (stade 1 : 5 %, stade 2 : 50 %, stades 3 et 4 : de 15 à 20 %).
Cycle circadien veille-sommeil et horloge biologique
L’« horloge » biologique est située dans l’hypothalamus antérieur.
Elle reçoit des afférences de photorécepteurs spécifiques.
C’est en modulant la sécrétion de mélatonine par la glande pinéale, ou épiphyse, qu’elle synchroniserait le cycle veille-sommeil avec le cycle lumière-obscurité.
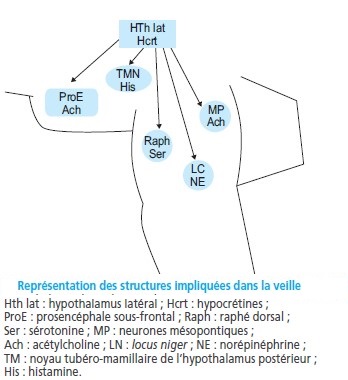
Structures anatomiques et neurotransmetteurs impliqués dans l’éveil
Plusieurs structures semblent jouer un rôle important dans la régulation veille-sommeil :
les noyaux cholinergiques du tronc cérébral et du prosencéphale sous-frontal,
les projections histaminergiques de l’hypothalamus postérieur,
les noyaux noradrénergiques (en particulier du locus coeruleus) et les projections dopaminergiques et sérotoninergiques provenant du tronc cérébral.
L’influence de ses différentes structures est médiée en grande partie, mais non exclusivement, par le thalamus qui joue donc un rôle central.
1.Neurones cholinergiques
Particulièrement actifs lors de la veille mais aussi, lors du sommeil paradoxal.
Deux systèmes (neurones) cholinergiques s’intègrent ainsi dans le système d’éveil :
celui issu du tronc cérébral et projetant vers des structures sous-corticales, notamment thalamiques,
et celui du prosencéphale sous-frontal projetant également vers le thalamus mais aussi directement vers le cortex.
2.Norépinéphrine et locus coeruleus
Des neurones synthétisant de la norépinéphrine sont présents dans le locus coeruleus du tronc cérébral.
Ces neurones sont actifs lors de l’éveil et provoquent une activation corticale.
Cependant, le système noradrénergique paraît être ni indispensable ni suffisant pour entraîner une activation corticale et semble donc agir en association avec les autres structures du système d’éveil.
3.Sérotonine et raphé dorsal
Considérée dans les années 1960 comme le neurotransmetteur du sommeil, elle a ensuite été considérée comme un neurotransmetteur de l’éveil.
Les neurones du raphé dorsal et médian du tronc cérébral sont les sources principales de la sérotonine.
Les récepteurs impliqués sont 5-HT1A et 5-HT2, lesquels pourraient avoir une action différente.
La sérotonine pourrait par exemple moduler l’activité thalamique (dans le sens de l’éveil) via les récepteurs 5-HT2 . Ces récepteurs sont également présents au niveau des cellules corticales.
Les récepteurs 5-HT1A, notamment présents au niveau des dendrites des neurones sérotoninergiques (autorécepteurs), pourraient quant à eux favoriser le sommeil en diminuant la libération de sérotonine par ces mêmes neurones.
4.Histamine et noyau tubéro-mamillaire de l’hypothalamus postérieur
L’action de l’histamine au niveau du SNC est médiée par les récepteurs postsynaptiques H1 et H2 d’une part, et par les autorécepteurs H3 contrôlant la synthèse et la libération d’histamine d’autre part.
Exclusivement produit par les neurones du noyau tubéro-mamillaire situés dans l’hypothalamus postérieur.
Projections sont extrêmement larges, notamment vers les structures jouant un rôle important dans le contrôle de l’état de vigilance comme le cortex, le thalamus, l’aire préoptique de l’hypothalamus antérieur, et les structures mono-aminergiques et cholinergiques du tronc cérébral et du prosencéphale.
Activation corticale directe ou indirecte, respectivement par les projections corticales et par le système thalamo-cortical, et activation d’autres structures d’éveil comme le système cholinergique.
5.Dopamine et éveil comportemental
Les neurones produisant de la dopamine sont abondants dans le locus niger, dans le tegmentum, dans l’hypothalamus postérieur et dans plusieurs noyaux du tronc cérébral. Ils projettent notamment vers le striatum, le cortex frontal et le thalamus.
Favorise l’éveil cortical et surtout comportemental.
Les mécanismes de modulation du cycle veille-sommeil par la dopamine sont cependant complexes et encore mal connus.
6.Hypocrétines (orexines) et activation des systèmes aminergiques de l’éveil
De découverte récente, les hypocrétines 1 et 2 (Hcrt-1 et Hcrt-2, également appelées orexines A et B) sont deux neuropeptides issus du même précurseur dont la synthèse est exclusivement assurée par des neurones de l’hypothalamus latéral et postérieur
Nombre limité à seulement quelques milliers mais très larges projections vers les différentes régions du SNC.
Rôle des neurones hypocrétinergiques et du noyau préoptique ventro-latéral dans la régulation veille-sommeil, en « orchestrant » l’activité des différents systèmes d’éveil.
D’un point de vue physiopathologique, les hypocrétines ont été impliquées dans la narcolepsie.
Les structures sous-tendant l’éveil sont centrées sur le système réticulaire activateur ascendant du tronc cérébral.
Les neurones de cette structure projettent sur l’hypothalamus postéro-latéral, le système thalamique et le prosencéphale sous-frontal.
Grâce à leurs projections, ces trois formations anatomiques peuvent entraîner une activation corticale.
Ces différentes structures de l’éveil agissent donc en association et sont largement interconnectées.
Régulation du sommeil
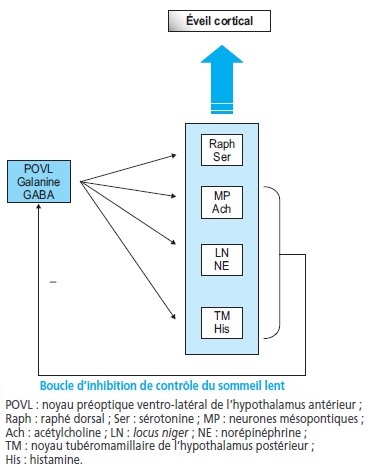
Contrôle du sommeil lent : rôle de l’hypothalamus
Des neurones du noyau préoptique ventro-latéral de l’hypothalamus antérieur particulièrement actifs pendant le sommeil lent produisent de l’acide gamma-amino-butyrique (GABA) et de la galanine, neurotransmetteurs inhibiteurs, inhibant ainsi grâce à leurs projections les différentes structures de l’éveil (noyau tubéro-mamillaire histaminergique, locus coeruleus noradrénergique, raphé dorsal sérotoninergique, noyaux cholinergiques mésopontins).
Réciproquement, ces neurones GABAergiques sont inhibés par le système d’éveil mono-aminergique (noradrénergique et sérotoninergique) et cholinergique.
Contrôle du sommeil paradoxal
Deux populations de neurones mises en jeu dans l’alternance sommeil à ondes lentes-sommeil paradoxal ont été décrites :
les neurones cholinergiques de la jonction pont-mésencéphale, appelés neurones « SP-on » car actifs lors du sommeil paradoxal,
et les neurones noradrénergiques et sérotoninergiques (« SP-off »), situés respectivement dans le locus coeruleus et dans le raphé dorsal, inactifs lors du sommeil paradoxal.
Ces deux populations de neurones s’inhiberaient mutuellement.
Neuromodulateurs favorisant le sommeil
Action de l’adénosine sur le système cholinergique et le noyau préoptique ventro-latéral de l’hypothalamus
L’adénosine est un nucléoside issu de la dégradation de l’adénosine triphosphate (ATP), principal substrat énergétique du système nerveux.
La veille, période de grande activité cellulaire cérébrale, s’accompagne donc d’une consommation importante d’ATP avec accumulation progressive d’adénosine.
Il a été dit que l’adénosine avait des propriétés « somnogènes », participant ainsi à la survenue du besoin de dormir en fin de journée.
Une des fonctions du sommeil serait alors la reconstitution du stock énergétique cérébral.
Par ailleurs, l’adénosine augmente l’excitabilité des neurones du noyau préoptique ventro-latéral de l’hypothalamus, structure qui, comme nous l’avons vu, favorise le sommeil en inhibant par ses projections les structures d’éveil.
Tout ceci permet de proposer un schéma de modulation veille-sommeil ou l’adénosine aurait un rôle important :
elle favoriserait l’induction du sommeil par inhibition du système d’éveil cholinergique d’une part,
et par désinhibition des neurones du noyau préoptique ventro-latéral de l’hypothalamus d’autre part.
Prostaglandines D2 (PGD2).
En effet, les fluctuations de ses concentrations dans le liquide céphalo-rachidien sont parallèles au cycle veille-sommeil.
L’induction du sommeil est un phénomène actif, lié à l’inhibition des systèmes cholinergiques et monoaminergiques du système d’éveil par les neurones galalinergiques et GABAergiques du noyau préoptique ventro-latéral de l’hypothalamus antérieur.
La transition sommeil à ondes lentes-sommeil paradoxal est liée à l’interaction de deux systèmes s’auto-inhibant : un système cholinergique facilitateur du sommeil paradoxal, situé à la jonction pont-mésencéphale, et un système noradrénergique et sérotoninergique inhibiteur du sommeil paradoxal.
Plusieurs neuromodulateurs favorisent par ailleurs l’induction du sommeil. L’adénosine inhibe le système cholinergique. La libération d’adénosine pourrait elle-même être favorisée par l’action de la PGD2.
Rôles du sommeil
Le sommeil indispensable à la survie et, en outre il est impliqué dans les phénomènes de mémorisation et de plasticité cérébrale.
En effet , Il est désormais admis qu’au-delà des premières années de vie, la neurogenèse se poursuit chez l’adulte au sein de zones cérébrales spécifiques, notamment au niveau de l’hippocampe, structure cérébrale pivot de la mémorisation et du repérage spatial.
Il à un impact sur le plan immunologique, endocrinien et cardiovasculaire.
La privation prolongée de sommeil chez l’homme peut entraîner la survenue d’hallucinations, de convulsions, une instabilité émotionnelle, voire l’apparition de troubles psychotiques.
Sommeil et Anesthésie Générale
Le Système Réticulaire Activateur Ascendant (SRAA), localisé dans le tronc cérébral, reçoit les informations sensorielles. Il se projette sur 3 structures (thalamus, hypothalamus et le cerveau basal antérieur) et active les structures corticales.
Il existe 3 stades de vigilance :
Veille ;
Sommeil Ondes Lentes (SOL) : son rôle « réparateur » sur la somnolence et la fatigue permet la reconstitution des réserves (↓ métabolisme) et la sécrétion d'hormones de croissance :
stade d'endormissement (5 %) : ↓ FC qui est régulière, quelques apnées, quelques mouvements oculaires, tonus musculaire (fréquence : 2–7 Hz),
stade sommeil léger (50 %) : FC régulière, quelques apnées, ↓ fréquence des ondes EEG, pas de mouvement oculaire, ↓ tonus,
stade sommeil profond et
stade plus profond (25 %) : FC et FR stables, pas de mouvement oculaire, faible tonus ;
Sommeil paradoxal (20 %) : son rôle est la réactivation des comportements innés, et l'apprentissage : stockage dans la mémoire à long terme (EEG en veille, mouvements oculaires rapides, atonie musculaire) : FC et FR irrégulières.
La mélatonine a une influence sur la qualité et la durée du sommeil et dans la régulation d'autres rythmes circadiens, ce qui peut expliquer les troubles du sommeil post-opératoires.
L'induction du sommeil (par les anesthésiques) provoque l'inhibition des systèmes d'éveil cholinergique et noradrénergique par les neurones GABAergiques de l'hypothalamus antérieur : ↓ de l'activation corticale. Tous les anesthésiques (sauf la Kétamine®) potentialisent les effets du GABA sur les récepteurs.
L'indice bispectral de l'EEG (BIS) est issu d’une analyse informatisée du signal EEG associant plusieurs fonctions. Ces mesures sont combinées par un algorithme afin :
d'optimiser la corrélation entre EEG et effets cliniques de l'anesthésie,
et de quantifier l'index BIS au moyen d’une zone de valeurs (anesthésie optimale : 40–60).
Son objectif est d'éviter le surdosage d'hypnotiques (hypoTA, apnée, coût, NVPO, durée en SSPI, surmortalité) et le sous-dosage (hyper TA, laryngospasme, mémorisation)
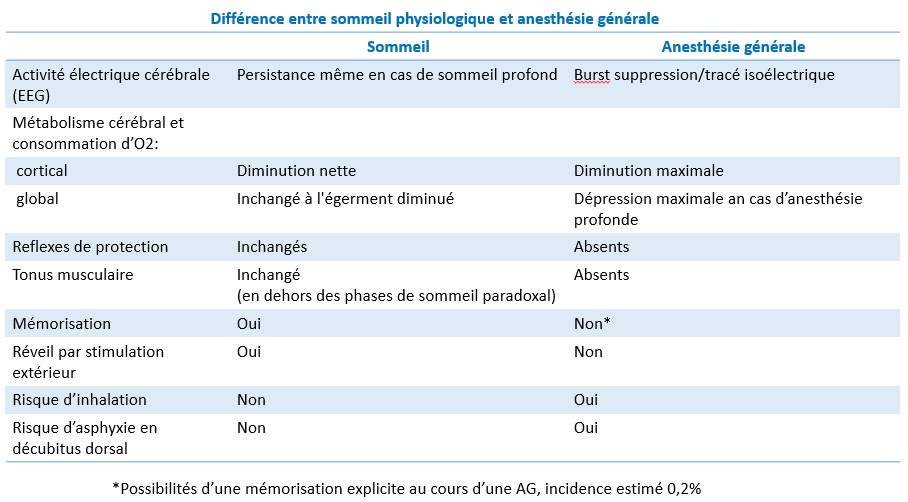
L’état du sommeil physiologique est très différent de celui d’une anesthésie générale,
La différence réside dans le fait qu’une AG déprime quasiment toute l’activité électrique du cerveau, alors que le sommeil n’affecte que les seuls composantes corticales.
Le métabolisme fonctionnel est aboli en anesthésie profonde, seul le métabolisme basal cellulaire, indispensable pour la survie persiste.
Lors de l’anesthésie comme pour les coma, aucune impression sensorielle externe n’est perçue, les stimulus d’éveil perdent leurs efficacité.
La perte de tonus des muscles du plancher buccal, provoque en décubitus dorsal, une chute de la langue en arrière avec obstructions des voies aériennes supérieurs (risque d’asphyxie).
Troubles du sommeil de l’enfant et de l’adulte
INSOMNIES ET HYPNOTIQUES
Définition
Étymologiquement, le terme « insomnie » signifie absence de sommeil. Mais il n’existe pas d’insomnie à proprement parler.
En moyenne, les « insomniaques » ont un temps total de sommeil et une stabilité de sommeil moindres que les « bons dormeurs », mais avec un très large recouvrement entre les deux groupes, de telle sorte qu’individuellement la structure du sommeil ne permet pas de différencier un « insomniaque » d’un « bon dormeur ».
La définition de l’insomnie est donc purement subjective. Il y a insomnie quand le sujet ressent son sommeil comme difficile à obtenir, insuffisant ou non récupérateur.
=> aucun examen complémentaire de confirmation diagnostique : les examens complémentaires et, notamment, les enregistrements polygraphiques au cours du sommeil n’ont d’intérêt que pour la recherche d’une étiologie particulière.
On différencie deux types d’insomnie :
les insomnies transitoires ou occasionnelles
et les insomnies chroniques qui posent des problèmes diagnostiques et thérapeutiques très différents.
Insomnie transitoire
L’insomnie transitoire fait partie de la vie normale mais parfois risque de se pérenniser ;
En rapport avec des causes occasionnelles réversibles :
une mauvaise hygiène de sommeil ;
des facteurs environnementaux : niveau sonore, climat, altitude… ;
un stress psychique : contrariété, deuil, contraintes… ;
un stress physique : contrainte liée à une affection physique, douloureuse;
un phénomène de rebond à l’arrêt d’un traitement tranquillisant ou hypnotique ;
une prise aiguë de toxiques.
Insomnie chronique
On différencie les insomnies chroniques
d’origine physique,
d’origine psychique
et les insomnies persistantes primaires (les plus fréquentes) qui ne reconnaissent pas de cause spécifique.
1.Insomnie chronique d’origine physique
Certaines dyssomnies :
mouvements périodiques du sommeil,
impatience des membres inférieurs à l’éveil,
syndrome d’apnées du sommeil
Sont plus souvent responsables de somnolence diurne, et décrites dans le chapitre correspondant.
D’autres étiologies sont le plus souvent facilement identifiées :
pathologies douloureuses ou inflammatoires, notamment cancéreuses et rhumatismales ;
maladies neurologiques (Parkinson, démences, etc.) ;
toxiques (alcool entre autres).
2.Insomnie chronique d’origine psychique
Se sont les affections psychiatriques :
Les troubles thymiques :
Dépression : l’insomnie est une plainte précoce du dépressif, souvent associée à une clinophilie (il « se réfugie » dans son lit) ;
Etat maniaque, avec une difficulté d’endormissement et une diminution du temps de sommeil dont le patient ne se plaint pas habituellement ;
Les troubles anxieux : une des causes les plus importantes ;
Les psychoses : l’insomnie se voit surtout lors des épisodes féconds, dont elle est d’ailleurs un signe précoce ;
Les démences où il y a une « inversion du rythme nycthéméral » avec somnolence diurne et éveil nocturne.
3.Insomnie persistante primaire
C’est l’insomnie « maladie », appelée aussi insomnie « psychophysiologique ».
L’insomnie est souvent apparue à un moment précis dans l’histoire du patient à l’occasion d’un deuil, d’une séparation ou d’une autre circonstance pénible, mais le retour au sommeil normal ne se produit pas, même lorsque la cause occasionnelle a disparu.
Elle comporte des difficultés d’endormissement et un trouble du maintien du sommeil, le sommeil devient une appréhension.
Le sommeil est perçu comme non réparateur, mais paradoxalement, et malgré l’impression de fatigue, il n’y a pas de somnolence diurne ; les tentatives de sieste « réparatrice » échouent en raison de la même difficulté d’endormissement que pour le sommeil de nuit ; la présence d’une somnolence est un argument contre le diagnostic d’insomnie persistante primaire et doit faire rechercher une étiologie spécifique. démontre l’absence de perturbation.
Diagnostic différentiel
Erreur d’hygiène de sommeil : l’augmentation du temps passé au lit
Troubles du rythme circadien :
le syndrome de retard de phase ;
le syndrome d’avance de phase, rare ;
les vols transméridiens ;
le travail posté (les « 3 huit »).
Bilan et conduite à tenir
1.Interrogatoire
Reconstituer l’histoire actuelle et passée du patient, la chronologie et les mécanismes de l’insomnie ;
Laisser le patient se raconter et raconter comment, où, dans quel environnement il s’endort (par exemple, rechercher s’il s’endort en regardant la TV dans son lit, quel type d’activité il a dans la soirée, comment il ménage la transition de la veille au sommeil…, etc.) ;
Cerner le contexte psychique du patient ;
Définir son environnement, ses habitudes, les contraintes auxquelles il est soumis ;
Répertorier ses antécédents, tant pathologiques que thérapeutiques ;
Rechercher une pathologie du sommeil (notamment un syndrome d’impatience des membres inférieurs ou un syndrome d’apnées du sommeil).
Tenue d’un agenda de sommeil→ appréciation de l’écart entre le regard du patient et la réalité.
2.Examens complémentaires
a)Enregistrement actimétrique:
Au moyen d’un accéléromètre porté au poignet, il permet d’établir le rythme activité-repos sur plusieurs semaines et donc d’objectiver les données (subjectives) de l’interrogatoire ou de l’agenda de sommeil.
b)Polysomnographie au laboratoire
Elle n’apporte guère de renseignements, d’autant que le patient affirme (souvent à raison) qu’il a passé au laboratoire une nuit d’une exceptionnelle bonne qualité. Ils ne sont indiqués que si l’on suspecte une étiologie spécifique.
Traitement
1.Traitement étiologique
Lorsqu’une étiologie est identifiée (syndrome des apnées du sommeil, des mouvements périodiques du sommeil, maladie psychiatrique ou organique…, etc.).
2.Traitement symptomatique
L’hypnotique idéal :
doit entraîner une induction rapide de sommeil ;
doit maintenir le sommeil pendant au moins 7 heures ;
doit respecter l’architecture du sommeil ;
ne doit pas avoir d’effet résiduel (au réveil, pendant la journée) ;
ne doit pas induire d’accoutumance ni de tolérance ;
ne doit pas induire de syndrome de sevrage ;
doit avoir une bonne marge de sécurité ;
ne doit pas avoir d’interactions médicamenteuses.
Aucun hypnotique ne réunit toutes ces propriétés : l’hypnotique idéal n’existe pas.
BEZODIAZEPINES à 1/2t courtes ou analogues (zolpidem, Stilnox® et zopiclone, Imovane®)
Approche cognitivo-comportementale
SOMNOLENCE EXCESSIVE ET TROUBLES DE L’ÉVEIL
Préoccupation médicale d’émergence relativement récente
On lui a attribué certaines des catastrophes majeures qui ont menacé la survie et l’équilibre écologique de tout ou partie de notre planète (Three Mile Island, Tchernobyl, Exxon-Valdez) et elle est responsable de nombreux accidents (les endormissements sont actuellement la première cause d’accidents sur les autoroutes).
Définition de la somnolence
1.Approche subjective
La première définition proposée était entièrement introspective, fondée sur l’impression du sujet, qui était le seul à pouvoir évaluer sa somnolence.
2.Approche objective
On peut définir la somnolence par la survenue d’un endormissement objective. un endormissement est pathologique lorsqu’il se produit « anormalement » rapidement dans des circonstances standardisées ou lorsqu’il se produit dans des circonstances inappropriées
Évaluation
Témoignage du sujet et de son entourage
L’interrogatoire accident ou incident lié à la somnolence lui en ait fait prendre conscience.
Questionnaires: questionnaire d’Epworth
Techniques instrumentales utilisant l’EEG
Causes de la somnolence
1.Sommeil insuffisant ou perturbé :
perturbations socioprofessionnelles (environnement, travail posté, vols transméridiens, restriction de sommeil…) ;
perturbations pathologiques (douleurs, cancers…) ;
événements pathologiques liés au sommeil : syndrome d’apnées du sommeil, mouvements périodiques du sommeil.
2.Pathologie intrinsèque touchant les mécanismes générateurs du sommeil :
narcolepsie-cataplexie ;
hypersomnie idiopathique.
Syndrome des apnées du sommeil (SAS) et syndrome de résistance des voies aériennes supérieures (SRVAS)
1. Définitions
Une apnée est une interruption de la ventilation ; par convention, on ne prend en compte chez l’adulte que les apnées d’une durée minimum de 10 secondes.
Une hypopnée est une diminution de la ventilation d’une durée minimum de 10 secondes.
On peut définir différents types d’événements respiratoires (hypopnées ou apnées) suivant qu’ils s’associent ou non à une interruption des efforts respiratoires.
Le syndrome de résistance des voies aériennes supérieures est une variante du SAOS : il se traduit par une augmentation progressive de l’effort respiratoire, mais :
sans variation du débit oronasal ;
sans hypoxémie ;
suivie d’un microéveil qui permet la normalisation de la respiration, mais fragmente le sommeil.
2. Physiopathologie du SAOS
Le pharynx peut être assimilé à un tuyau mou, interposé entre deux segments rigides, les fosses nasales et l’arbre trachéobronchique.
À l’inspiration, la pression s’exerçant sur les parois pharyngées est négative, d’où une tendance au collapsus du pharynx durant l’inspiration.
Tout dépend alors de la manière dont se font les interactions entre le système du sommeil et le système respiratoire.
Chez le ronfleur simple, le rétrécissement pharyngé est responsable d’un écoulement d’air turbulent générateur de vibrations, source de bruit : le ronflement.
S’il s’y associe une augmentation de l’effort respiratoire, celui-ci peut, en l’absence de diminution de la ventilation (sans hypopnée ou apnée), constituer un stimulus éveillant, responsable d’une fragmentation du sommeil et d’une somnolence diurne : c’est le syndrome de résistance des voies aériennes supérieures.
Dans les syndromes d’apnées du sommeil « classique », le collapsus est complet, il y a interruption du débit : c’est une apnée.
Comme au cours du SRVAS, c’est l’augmentation de l’effort respiratoire (de lutte contre l’obstacle que constituent les voies aériennes supérieures collabées), qui est responsable de l’éveil.
Cet éveil est à la fois salutaire, car il permet la reprise respiratoire, mais aussi délétère, car il fragmente le sommeil, du fait de la répétition des apnées qui sont couramment plusieurs centaines au cours d’une nuit.
3. Clinique
a) Signes fonctionnels
L’association somnolence diurne + ronflement doit à elle seule faire suspecter un SAS.
La somnolence diurne est parfois majeure, responsable d’endormissements intempestifs dans des circonstances très diverses, mais parfois modérée, voire absente ou niée par le patient qui a souvent oublié ce qu’est une vigilance normale et ne percevra l’importance de ces symptômes qu’après leur disparition sous traitement.
Le ronflement est sonore, souvent très ancien, et l’entourage observe souvent l’interruption répétée du ronflement à l’occasion des apnées, suivie d’une reprise respiratoire, particulièrement sonore, et accompagnée d’une agitation.
Il existe d’autres symptômes moins spécifiques :
troubles cognitifs (mémoire, attention, fonctions exécutives) ;
troubles du caractère (irritabilité) ;
problèmes sexuels (baisse de la libido) ;
sommeil agité ;
sudation nocturne ;
polyurie nocturne, énurésie (rare chez l’adulte) ;
céphalées matinales.
b) Examen clinique
70% des patients atteints de SAS sont obèses .
On retrouve le plus souvent un morphotype particulier, bréviligne, avec un cou court, épais, et une conformation mandibulaire particulière avec micrognathie et/ou rétrognathie, en particulier chez les patients qui ne sont pas obèses.
50 % des cas, s’y associe aussi une HTA => impact cardio-vasculaire
4. Diagnostic
Repose sur l’enregistrement polygraphique du sommeil
5. Épidémiologie du SAOS
2 et 5 % de la population générale adulte.
L’affection a une très forte prédominance masculine (de l’ordre de 90 %)
6. Traitement
Outre la correction des facteurs aggravants (réduction pondérale, arrêt des benzodiazépines et de l’alcool), le traitement du SAOS repose essentiellement, à l’heure actuelle, sur la pression positive continue (PPC)
L’uvulo-palatopharyngoplastie (UPPP) a été proposée mais effet inconstant
Le traitement chirurgical maxillofacial
La correction d’une hypertrophie amygdalienne et/ou d’une déviation de la cloison nasale peut être un élément thérapeutique adjuvant, voire suffisant chez l’enfant
Impatience des membres inférieurs (IMI) et mouvements périodiques du sommeil (MPS)
1. Impatience des membres inférieurs
Définition et aspects cliniques
caractérisé par :
oune compulsion à bouger les membres inférieurs souvent associée à (ou causée par) des paresthésies ;
maximum au repos et à l’inactivité (le plus souvent assis ou couché) ;
soulagée ou améliorée par le mouvement (marche ou étirement, au moins tant que dure l’activité) ;
maximum le soir ou la nuit (au moins au début, indépendamment du niveau d’activité).
La physiopathologie reste mal comprise
2. Mouvements périodiques du sommeil (MPS)
Définition et aspects cliniques :
Les MPS sont de constatation fréquente dans la population générale (environ 5 %) et leur prévalence augmente de façon importante avec l’âge.
Il s’agit de mouvements brefs stéréotypés des membres inférieurs, plus rarement des membres supérieurs, qui se répètent au cours du sommeil, à intervalles réguliers habituellement compris entre 15 et 40 secondes.
Ils surviennent en général par épisodes d’une durée de quelques minutes à plusieurs heures
3. Explorations complémentaires
Le diagnostic de MPS repose sur l’enregistrement polygraphique nocturne comportant un électromyogramme des muscles jambiers antérieurs qui objective les mouvements en flexion à prédominance distale.
4. Traitement
Les benzodiazépines ont un effet encore discuté et ne nous paraissent pas souhaitables pour une utilisation au long cours.
L’action thérapeutique des opiacés est connue de longue date dans le syndrome des jambes sans repos et a été démontrée ensuite dans les MPS, mais leur utilisation est délicate.
La L-Dopa, à une dose de 50 à 200 mg par jour, ou les agonistes dopaminergiques, tels que la bromocriptine, le piribédil, le ropinirole, ou le pramipexole sont également actifs
Narcolepsie-cataplexie (syndrome de Gelineau)
1. Définition
La narcolepsie est une somnolence diurne excessive comportant des accès de sommeil quasi irrépressibles qui surviennent par vagues au cours de la journée.
2. Physiopathologie
D’origine au moins en partie génétique.
Une atteinte des neurones hypocrétinergiques hypothalamiques y joue un rôle fondamental.
Elle peut être vue comme une maladie du sommeil paradoxal, notamment :
la cataplexie comme une intrusion de l’atonie musculaire en pleine veille ;
les paralysies hypnagogiques et hypnopompiques comme une intrusion de l’atonie musculaire à la jonction veille-sommeil ;
les hallucinations hypnagogiques comme une intrusion de l’imagerie des rêves.
Mais c’est aussi une maladie du sommeil lent :
dyssomnie par fragmentation du sommeil lent ;
les épisodes narcoleptiques ne correspondent pas toujours à des endormissements en sommeil paradoxal, et n’impliquent parfois que le sommeil lent.
3. Diagnostic clinique
La tétrade narcoleptique
a) Les attaques de cataplexie sont des accès de résolution du tonus musculaire
b) Les paralysies du sommeil surviennent au moment de l’endormissement (hypnagogiques) ou du réveil (hypnopompiques).
c) Les hallucinations hypnagogiques
d) une dyssomnie : le sommeil est en effet souvent de mauvaise qualité
4. Épidémiologie
La prévalence de la narcolepsie-cataplexie est d’environ 50 pour 100 000 habitants, du même ordre que la sclérose en plaques.
L’affection débute habituellement dans la 2e décennie.
Elle est très largement sous-diagnostiquée.
5. Traitement
Siestes programmées, qui permet de restaurer plus ou moins durablement la vigilance.
Elle peut également être combattue par divers produits stimulants.
Le modafinil (Modiodal®)
Les amphétaminiques (Ritaline®) ne sont utilisés qu’en cas d’échec du modafinil
Petites doses d’antidépresseurs (tricycliques ou inhibiteurs de recapture de la sérotonine, indications hors AMM).
Hypersomnie idiopathique
1. Tableau clinique
Sommeil nocturne anormalement prolongé suivi d’une très grande difficulté à se réveiller (ivresse du sommeil), survient en général chez des sujets jeunes.
2. Diagnostic
Le diagnostic repose avant tout sur l’interrogatoire, complété par un agenda de sommeil
3. Traitement
Répond particulièrement bien au traitement par Modiodal®
MANIFESTATIONS MOTRICES PAROXYSTIQUES DU SOMMEIL
1. Manifestations épileptiques
a) Crises partielles ou généralisées : présentes au cours de la veille peuvent aussi survenir pendant le sommeil et ne sont pas différentes des crises comitiales survenant lors de la veille.
b) Dystonie paroxystique nocturne (DPN) : Dénommée également éveils paroxystiques ou déambulations nocturnes épisodiques, sa description est relativement récente (une dizaine d’années). Initialement considérée comme une nouvelle forme de parasomnie, reconnue aujourd’hui comme une forme d’épilepsie frontale, dont les crises su rviennent exclusivement au cours du sommeil.
2. Parasomnies
« Parasomnie » signifie à côté du sommeil. Les parasomnies regroupent donc toutes les manifestations qui accompagnent le sommeil:
Sursauts hypnagogiques
Rythmies
Bruxisme
Sommeil lent profond (SLP)
Somnambulisme: éveil dissocié
Terreurs nocturnes
Énurésie
Paralysies du sommeil
Cauchemars
Troubles du comportement du sommeil paradoxal
Somniloquie: le fait de parler pendant le sommeil.
Références:
 2015-Purpan: 37, Allées Jules Guesde - 31000 Toulouse
2015-Purpan: 37, Allées Jules Guesde - 31000 Toulouse
PHYSIOLOGIE HUMAINE APPLIQUÉE Claude Martin Bruno Riou Benoît Vallet-John Libbey Eurotext, Paris, 2017.
ATLAS DE POCHE ANESTHÉSIE Norbert Roewer Holger Thiel 2017, Lavoisier, Paris.
Arrangement BMS.
d) Physiologie et physiopathologie de la thermorégulation
Objectif 1 :Etablir la différence entre la température centrale et la température de surface.
Objcetif 2 : Expliquer les mécanismes de thermorégufation (thermogenèse et thermolyse); définir l'hypothermie, l'épuisement dû à la chaleur, le coup de chaleur et la fièvre .
Production de chaleur
Quand le niveau métabolique s'élève, la température corporelle augmente, et quand il baisse, la température corporelle diminue. Une partie de l'énergie libérée dans
les cellules pendant l'activité métabolique l'est sous forme de chaleur, et les organes les plus actifs produisent le plus de chaleur.
Les principaux organes impliqués sont les suivants.
• Les muscles squelettiques. La contraction des muscles squelettiques produit une grande quantité de chaleur, et plus l'exercice est vigoureux, plus la quantité de chaleur produite est grande. Le frissonnement implique aussi la contraction musculaire lisse, qui augmente la production de la chaleur quand la température corporelle risque de tomber au-dessous de la normale.
• Le foie est métaboliquement très actif, et de la chaleur est produite comme produit annexe. Le niveau métabolique et la production de chaleur augmentent
après un repas.
• Les organes digestifs. Ils produisent de la chaleur pendant leur péristaltisme et pendant les réactions chimiques impliquées dans la digestion.
L'homéostasie
La peau joue un rôle important dans la thermorégulation (ou homéostasie de la température corporelle).
L'être humain peut maintenir une température corporelle remarquablement constante (autour de 37 °C), même si la température ambiante passe d'un extrême
à un autre.
Les systèmes de rétroaction négative assurent la stabilité de la température corporelle (l'état contrôlé).
Supposons qu'une personne se trouve dans un endroit où la température est de 38 °C. La chaleur (le stimulus) est transmise depuis l'extérieur jusqu'au corps humain, et augmente ainsi la température corporelle.
Dans un état contrôlé, une série d'événements se déclenchent afin de neutraliser le changement.
Des récepteurs cutanés sensibles à la température (des terminaisons nerveuses), appelés thermorécepteurs, détectent le stimulus et envoient des influx nerveux (l'information) à l'encéphale (le centre de contrôle).
Un centre de thermorégulation de l'encéphale (l'hypothalamus) renvoie alors des influx nerveux (la réponse) aux glandes sudoripares (les effecteurs) qui produisent de la sueur plus rapidement.
A mesure que la sueur s'évapore de la surface de la peau, cette dernière se refroidit, ce qui rétablit la température du corps (retour à l'homéostasie).
L'encéphale envoie également de l'information aux vaisseaux sanguins (un deuxième groupe d'effecteurs) du derme, afin de les dilater et d'augmenter la circulation sanguine
cutanée.
Alors qu'une quantité accrue de sang circule dans les capillaires, à la surface de la peau, la déperdition de chaleur par radiation s'accroît et, par conséquent, la température corporelle diminue.
La radiation est le transfert de la chaleur sans contact physique entre un objet plus chaud et un objet plus froid. Lorsqu'une personne est au soleil ou qu'elle place la main au-dessus d'une cuisinière, elle reçoit de la chaleur par radiation.
Ainsi, par évaporation et par radiation, il se produit une perte de chaleur corporelle.
La température corporelle revient à sa valeur normale afin de rétablir l'homéostasie.
Par contre, les vaisseaux sanguins du derme se contractent, le débit sanguin diminue et la perte de chaleur par radiation est éliminée lorsqu'il se produit une baisse de la température ambiante.
Rappelons-nous que, dans la thermorégulation de l'organisme par la peau, un système de rétroaction négative intervient.
En effet, la réaction (le refroidissement de la peau) s'oppose au stimulus (la chaleur) précurseur du cycle.
En outre, les thermorécepteurs contrôlent constamment la température corporelle et renvoient des messages à l'encéphale pour le tenir informé de la situation. En revanche,
l'encéphale transmet des influx nerveux aux glandes sudoripares et aux vaisseaux sanguins jusqu'à ce que la température corporelle revienne à la normale, soit 37 °C.
Le maintien de la température par la transpiration et le changement du débit sanguin du derme ne représente que deux des mécanismes de régularisation de la température
corporelle.
Contrôle de la température corporelle
Le centre régulateur de la température, dans l'hypothalamus, est sensible à la température du sang circulant qui l'irrigue.
Ce centre réagit à la diminution de la température en envoyant des influx nerveux aux :
• artérioles du derme, qui réalisent une constriction du flux sanguin cutané ;
• muscles squelettiques, qui stimulent le frissonnement.
La chaleur étant conservée, la température corporelle s'élève et, quand elle revient à la normale, le mécanisme de rétroaction négative est de nouveau interrompu .
À l'inverse, quand la température corporelle s'élève, la perte de chaleur est accrue par la dilatation des artérioles du derme, ce qui augmente le flux sanguin cutané, et par
la stimulation des glandes sudoripares, entraînant un gonflement, et ce jusqu'au retour à la normale, quand le mécanisme de rétroaction négative est interrompu.
Activité des glandes sudoripares.
Quand la température corporelle s'élève de 0,25 à 0,50 °C, les glandes sudoripares sécrètent de la sueur sur la surface cutanée.
L'évaporation de la sueur refroidit le corps, mais elle est plus lente en milieu humide.
La perte de chaleur corporelle due à l'évaporation de l'eau par la peau et l'air expiré (importante chez les malades anesthésiés) se produit même quand la température ambiante est basse. Cette évaporation est appelée perte insensible d'eau (d'environ 500 ml par jour), et elle s'accompagne d'une perte insensible de chaleur.
Régulation du flux sanguin par la peau.
La quantité de chaleur perdue par la peau dépend en grande partie du flux sanguin dans les capillaires dermiques. Quand la température corporelle s'élève, les artérioles se dilatent, et plus de sang circule dans le réseau capillaire cutané. La peau est chaude et rose. En plus de l'augmentation de la quantité de sueur produite, la température cutanée s'élève, et davantage de chaleur est perdue par radiation, conduction et convection.
Si la température ambiante est basse, ou si la production de chaleur diminue, il se produit une vasoconstriction des artérioles du derme. Cela diminue le flux du sang
proche de la surface du corps, et la chaleur est conservée.
La peau paraît plus pâle et elle est froide.
Fièvre
C'est souvent la conséquence d'une infection ; elle est due à la libération de substances chimiques (des pyrogènes) par
des cellules inflammatoires et des bactéries envahissantes.
Les pyrogènes, par exemple l'interleukine 1 (p. 403), agissent sur l'hypothalamus, qui libère des prostaglandines réglant le thermostat hypothalamique à une plus haute
température. L'organisme répond en activant les mécanismes déclenchant la production de chaleur, par exemple le frissonnement et la vasoconstriction, jusqu'à ce que la nouvelle température plus élevée soit atteinte.
Quand le thermostat est à nouveau réglé à son niveau normal, les mécanismes de perte de chaleur sont activés.
Il se produit une vasodilatation avec peau chaude et rose, jusqu'à ce que la température corporelle revienne à la normale.
Hypothermie
L'hypothermie correspond à une température centrale (c'est-à-dire rectale) inférieure à 35 °C. Quand la température rectale tombe au-dessous de 32 °C, les
mécanismes visant à rétablir à la normale la température corporelle sont habituellement défaillants, c'est-à-dire que le frissonnement est remplacé par une rigidité et des
crampes musculaires, la vasoconstriction ne se produit pas, la pression artérielle baisse, le pouls et la respiration se ralentissent. Une confusion et une désorientation
apparaissent.
La mort est habituelle quand la température tombe au-dessous de 25 °C.
Les sujets aux âges extrêmes sont particulièrement exposés à l'hypothermie, la régulation de la température étant moins efficace chez les personnes jeunes et âgées.
Références
Anatomie physiologie normales et pathologiques-Ross et Wilson-12e édition Elsevier; 2015
Principes d'Anatomie et physiologie-TORTORA-GRABOWSKI- 2e Édition DeBoeck S Université 1994.
Arrangement BMS.
e) Physiopathologie de l'oedème cérébral (OC)
Définition
L’oedème cérébral (OC) est défini par l’accumulation nette d’eau et de solutés dans le secteur intracellulaire et/ou dans le secteur extracellulaire cérébral, à l’origine d’une augmentation de volume de la masse cérébrale.
ou plus simplement c'est L’oedème cérébral est une accumulation anormale de liquide dans le tissu cérébral, intercellulaire et intracellulaire dans les astrocytes.
Classification d'Igor Katzo (1967)
02 types d’OC :
L’oedème cytotoxique, ou oedème cellulaire, lié à une atteinte de la perméabilité membranaire de la cellule, conduisant à l’accumulation intracellulaire d’eau et d’ions (Na+, Ca++) ;
L’oedème vasogénique, où l’ouverture de la BHE provoque un passage d’eau, d’électrolytes et de protéines dans le secteur interstitiel.
NB: Certains auteurs distinguent aussi l’oedème osmotique, lié à un gradient osmotique de part et d’autre de la BHE, combinant un oedème cellulaire et un oedème interstitiel pauvre en protéines (BHE intacte)
RAPPEL : La barrière hémato-encéphalique (BHE)
Plus qu'un obstacle anatomique s’opposant passivement au passage des substances indésirables de la circulation. la BHE limite l’accès au tissu cérébral par l’action conjointe du renouvellement du liquide céphalo-rachidien et de plusieurs systèmes actifs de transport sélectif.
La BHE est localisée au niveau du système vasculaire cérébral, qui est une association complexe de cellules endothéliales des microcapillaires cérébraux (CEMC), d’astrocytes et de péricytes.
Le modèle de barrière hémato-encéphalique représenté comme simple système passif de membranes imperméables et par conséquent des critères physico-chimiques peuvent prédire le passage des molécules à travaers la BHE présente des limites .
Alors qu’un bon pouvoir prédictif apparaissait dans certaines familles de substances pour une surface moléculaire réduite, de faibles charges de surface et une forte lipophilicité (reflétée en un coefficient de partition octanol/eau élevé), un nombre significatif de molécules faisait toutefois exception, compromettant la portée globale de ces modèles.
Toutefois, cette vision demeure probablement adéquate pour expliquer l’absence de pénétration cérébrale de la plupart des grosses molécules fortement chargées présentes dans la circulation sanguine.
Principales causes d’oedème cérébral (OC) associé (+) ou non (–) à une augmentation de la perméabilité de la barrière hémato-encéphalique (BHE).
Caractères de l’OCCausesPerméabilité de la BHE
DiffusTraumatisme crânien+
Hémorragie sousarachnoïdienne+
Encéphalopathie hypertensive+
Méningite bactérienne (pneumocoque)+
Encéphalite virale (herpès)+
Hépatite fulminante+
Épuration extrarénale+
Mal aigu des montagnes+
Acidocétose diabétique?
Intoxication à l’eau-
Encéphalopathie anoxique-
Syndrome de Reye-
LocaliséAccident vasculaire ischémique+
Tumeur primitive ou secondaire+
Hémorragie intracérébrale+
Dans la plupart des cas, les deux types d’OC, cellulaire et vasogénique, coexistent, avec un délai d’apparition entre 1 et 6 heures, une amplitude maximale à 24-48 heures, et
une résolution spontanée entre 5 et 15 jours en l’absence de complications.
Cependant, des différences dans le mode d’apparition selon le type d’OCpeuvent avoir lieu ; par exemple, l’oedème vasogénique fait suite à l’oedème cellulaire en cas de lésion ischémique complète avec reperfusion.
L’OC post-traumatique a longtemps été considéré comme purement vasogénique enraison de la présence de contusions hémorragiques (BHE rompue). En fait, le type d’OC post-traumatique dépend des lésions initiales (diffuses ou focales) et de la présence ou non de facteurs secondaires aggravants (hypotension artérielle, hypoxémie, ischémie). Dans la majorité des lésions post-traumatiques, en clinique comme en expérimental, l’oedème cellulaire est prédominant ; il pourrait être précédé d’un oedème vasogénique de survenue ultraprécoce (60 minutes post-traumatique) . Enfin, il a été clairement montré que le « brain swelling » post-traumatique n’est pas lié à un engorgement vasculaire mais correspond à un oedème cellulaire .
Quel que soit son type, la survenue d’un OC représente une double menace pour le cerveau : une ischémie et un risque d’engagement cérébral.
Un OC localisé (hématome, tumeur) peut provoquer un déplacement de structures encéphaliques à l’origine d’un engagement temporal, sous-falcoriel ou cérébelleux.
Au cours de l’OC diffus, une augmentation de 1 % du contenu en eau intracérébrale équivaut à 13 mL dans un cerveau de 1 300 g ; cette augmentation
est largement suffisante pour élever la pression intracrânienne (PIC) de 10 à 20 mmHg dans un cerveau à compliance réduite (index pression-volume de 20 mL).
L’apparition d’une hypertension intracrânienne (HTIC) compromet alors la perfusion cérébrale et entraîne une ischémie cérébrale qui, à son tour, aggrave l’OC.
L’OC devient alors un oedème ischémique, associant un oedème cellulaire et un oedème vasogénique.
L’oedème cellulaire
Le cerveau ne se comporte pas comme un osmomètre idéal : de grandes variations de l’osmolalité plasmatique entraînent des changements beaucoup plus
modestes du contenu en eau intracérébrale (10).
Ceci est lié à la régulation fine et rapide du volume cellulaire sous la dépendance de pompes ioniques transmembranaires : cotransporteur Na+/K+/Cl-, échangeurs Na+/H+ et HCO3-/Cl-.
Ainsi, la perte d’eau intracellulaire induite obligatoirement par une augmentation de l’osmolalité plasmatique est compensée en partie par une accumulation intracellulaire d’ions osmotiquement actifs.
Cependant, en cas d’hyperosmolalité plasmatique prolongée, il y a une synthèse intracellulaire d’osmoles idiogéniques (sorbitol, myoinositol, taurine, alanine), pérennisant l’état d’hyperosmolarité intracellulaire et rendant toute baisse ultérieure de l’osmolalité plasmatique plus difficile à réguler.
L’oedème cellulaire résulte d’une accumulation intracellulaire d’osmoles, avec transfert concomitant d’eau. Le volume de l’espace interstitiel peut être alors réduit. Par un mécanisme adaptatif visant à protéger les neurones, l’OC cellulaire prédomine au niveau des cellules gliales et, accessoirement, des dendrites neuronales.
La lésion tissulaire induit la libération et l’accumulation extracellulaire d’ions H+, de K+, d’acide arachidonique, de radicaux libres et de glutamate, pouvant générer la mort des cellules neuronales.
La capacité de recaptage de ces éléments par les cellules gliales est alors stimulée, entraînant, par le jeu des cotransporteurs ioniques, une accumulation intracellulaire de Na+ et d’eau et une baisse intracellulaire de K+ . La dépolarisation membranaire ainsi induite provoque une accumulation intracellulaire de Ca++, à l’origine d’une cascade de réactions biochimiques délétères pour la cellule.
L’oedème vasogénique
L’oedème vasogénique correspond à un filtrat du plasma à travers la BHE.
Il prédomine dans la substance blanche en raison de la meilleure compliance liée à l’orientation parallèle des fibres à ce niveau.
D’après l’équation de Starling modifiée , on peut distinguer deux grands mécanismes à l’origine de l’oedème vasogénique, qui sont étroitement liés :
une augmentation du gradient de pression hydrostatique (origine mécanique)
et une augmentation de la perméabilité membranaire (origine biochimique).
L’encéphalopathie hypertensive est la traduction clinique d’une rupture de la BHE par augmentation excessive du gradient de pression hydrostatique.
Ainsi, l’élévation de la pression artérielle moyenne(PAM) au-delà de 170 mmHg entraîne une distension passive des parois artériolaires sur vaisseaux isolés : la limite supérieure de l’autorégulation cérébrale est dépassée, et toute augmentation de la PAM est source d’une extravasation d’eau et de solutés dans le tissu cérébral.
Il est connu depuis longtemps qu’un gradient excessif de pression hydrostatique est un élément majeur dans l’apparition d’un oedème vasogénique dans la zone de pénombre entourant le territoire ischémié : un oedème vasogénique apparaît précocement si la PAM est augmentée de 40-50 mmHg par rapport à sa valeur initiale.
Au cours du traumatisme crânien, la séquence hypoperfusion initiale-hyperhémie secondaire a été bien décrite. Le rôle joué par le gradient de pression hydrostatique dans la survenue ou la majoration de l’oedème vasogénique est alors à la base de conceptions très différentes dans le choix d’une pression de perfusion cérébrale (PPC) optimale chez un patient traumatisé (PPC supérieure à 70 mmHg selon la théorie de Rosner fondée sur le principe de l'autorégula- tion cérébrale , ou PPC 50-60 mmHg selon le concept de Lund qui s’appuie sur l’équation de Starling ).
En l’absence d’essais comparatifs, il est difficile d’adopter une attitude définitive en clinique humaine. Il semble cependant prudent de maintenir des valeurs de PPC de 60-70 mmHg pour la plupart des patients traumatisés crâniens .
Au rôle joué par le gradient de pression hydrostatique s’associe de manière très étroite celui d’une perméabilité membranaire accrue. Sous l’influence de médiateurs chimiques (inflammation), les propriétés mécaniques de la BHE sont altérées.
En conclusion, l’oedème cellulaire et l’oedème vasogénique relèvent de nombreux mécanismes, souvent intriqués. L’exemple type est l’OC post-traumatique qui peut être vasogénique pendant les premières minutes (poussée hypertensive, réaction inflammatoire) avant d’être cellulaire.
L’ensemble des mécanismes à l’origine de l’OC post-traumatique est illustré par la figure ci dessous
Références
Payen, J.-F., Francony, G., & Fauvage, B. (n.d.). Œdème cérébral: physiopathologie et diagnostic. La Réanimation Neurochirurgicale, 43–53.
T. Buclin, J. Biollaz. Regards récents sur la barrière hémato-encéphalique.Rev Med Suisse 2005 ; 1 : 959-63
Copin, J. ., & Gasche, Y. (2003). Morphologie et physiologie de la barrière hématoencéphalique. Annales Françaises d’Anesthésie et de Réanimation, 22(3), 202–214.
Unterberg AW, Stover J, Kress B, Kiening KL (2004) Edema and brain trauma. Neuroscience 129: 1019-27
f) Physiopathologie des comas
En construction
Date de dernière mise à jour : 19/05/2023
Commentaires
-

1 Saibou Diarra Le 24/10/2022
je voudrais faire une demande d'admission -

2 Khodja Foued Le 31/01/2022
cherche des cours pour AMAR -

3 Zineb. Le 30/11/2021
Merci pour les informations -

4 Yasser hadj miloud Le 03/11/2021
Je suis un assistant en anesthésie réanimation
webamar Le 17/11/2021
Bienvenu.
Ajouter un commentaire